可口可乐无菌验证
- 格式:doc
- 大小:214.00 KB
- 文档页数:30

饮料微生物检测方法1、目的:通过检测将产品中的微生物状况真实反应出来。
2、范围:适用于所有成品饮料的微生物检测。
3、工作程序:3.1 测试方法:采用膜过滤测试法(采用滤膜为0.45um)。
3.2培养基和试剂3.2.1伊红美蓝琼脂培养基(用于测试饮料成品中的大肠菌群)称取37.5g伊红美蓝琼脂培养基溶于1L蒸馏水中,加热溶解,121℃15分钟高压灭菌。
最好根据样品数量配制培养基,现配现用,一次性用完。
3.2.2乳糖胆盐培养基配制方法(用于验证样品中的大肠菌群)称取35g乳糖胆盐培养基溶于1L蒸馏水中,加热煮沸至完全溶解,分别装于有倒立发酵管的试管中,115℃,15分钟,高压灭菌,现用现配,一次用完。
3.2.3平板计数琼脂(用于测试成品茶饮料中的细菌总数)用电子称准确称取23.5g平板计数琼脂溶于1L蒸馏水中,加热煮沸至完全溶解,分装,121℃15分钟高压灭菌。
最好根据样品数量配制培养基,现配现用,一次性用完。
3.2.4马铃薯葡萄糖琼脂(用于测试成品茶饮料中的霉/酵母菌)用电子称准确称取38g马铃薯葡萄糖琼脂溶于1L蒸馏水中, 加热煮沸至完全溶解, 分装,121℃15分钟高压灭菌。
最好根据样品数量配制培养基,现配现用,一次性用完。
3.2.5若培养基经过消毒后已凝固,使用之前需将装有培养基的瓶子放在微波炉进行溶解。
培养基灭菌后,应在无菌室超净工作台内采用火焰消毒操作法往每个培养皿中倒入16-18毫升培养基,培养基凝固后,将培养皿倒置放入冰箱备用。
3.3取样:成品饮料取样为当天生产的产品,采用直接取样法,以每罐为一批进行检测。
3.4做样:将膜过滤支架放在超净工作台上,确定其阀门处于关闭状态,用火焰对其上端进行灭菌,在取用已经灭菌的滤器(牛皮纸包裹121℃灭菌15分钟)之前,用酒精棉球擦拭双手,安装滤斗,将镊子在酒精灯火焰区灭菌,待凉后,开启无菌滤膜的外包装,用镊子夹取滤膜置于滤斗上,安装滤杯,注意刻度向外,夹上弹簧夹,取300毫升样品倒入滤杯,启动抽滤泵,马上开启阀门过滤,过滤完毕后,关闭抽滤泵,取下弹簧夹,拿下滤杯,用酒精棉球擦拭剪刀,与镊子一起在酒精灯火焰区灭菌,待凉后,用镊子夹住,用剪刀将滤膜均匀剪成三部分,取一小部分置于带有伊红美蓝琼脂培养基的培养皿中;取一部分置于带有平板计数琼脂的培养皿中;取一部分置于马铃薯葡萄糖琼脂的培养皿中。


商业无菌检验方法学验证报告一、验证目的验证GB4789.26-2013《食品安全国家标准食品微生物学检验商业无菌检验》在本实验室的适用性。
二、验证方法严格按照GB4789.26-2013进行实验,附录B选做项目不在验证范围,本实验方法设计如下:样品种类样品名称样品编号实验人员实验方法灭菌乳 A XXX a、b 双人双平行灭菌乳 B XXX c、a 双人双平行调制乳 C XXX c、b 双人双平行三、验证设备和试剂1.冰箱:BCD-212DG/A 海信(北京)电器2.生化培养箱:LRH-70 上海一恒科学仪器3.电位pH计:PHS-3C+(精确度0.01)成都世纪方舟科技有限公司4.显微镜:B203LED 重庆奥特光学仪器有限公司5.天平:JE-502 上海浦春计量仪器有限公司6.超净工作台:SW-CJ-2FD 上海博迅实业7.培养基和试剂:按GB 4789.26.2013附录A中规定配制。
四、验证环境1.无菌室检验:详见《xxx省疾病预防控制中心检验报告书xxxxx》;2.操作间和超净台沉降菌实验结果合格,详见相关记录表。
五、验证步骤1.样品准备去除表面标签,在包装容器表面用防水的油性记号笔做好标记,并记录容器、编号、产品性状、泄漏情况、是否有小孔或锈蚀、压痕、膨胀及其他异常情况。
2.称重1 kg及以下的包装物精确到1 g并记录。
3.保温3.1每个批次取1个样品置2 ℃~5 ℃冰箱保存作为对照,将其余样品在36 ℃±1 ℃下保温10 d。
保温过程中应每天检查,如有膨胀或泄漏现象,应立即剔出,开启检查。
3.2保温结束时,再次称重并记录,比较保温前后样品重量有无变化。
如有变轻,表明样品发生泄漏。
将所有包装物置于室温直至开启检查。
4.开启4.1如有膨胀的样品,则将样品先置于2 ℃~5 ℃冰箱内冷藏数小时后开启。
4.2如有膨用冷水和洗涤剂清洗待检样品的光滑面。
4.3在超净工作台或百级洁净实验室中开启。

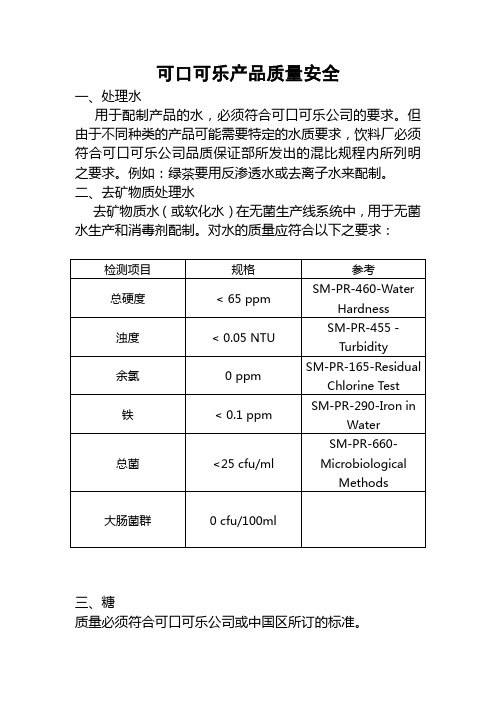
可口可乐产品质量安全一、处理水用于配制产品的水,必须符合可口可乐公司的要求。
但由于不同种类的产品可能需要特定的水质要求,饮料厂必须符合可口可乐公司品质保证部所发出的混比规程内所列明之要求。
例如:绿茶要用反渗透水或去离子水来配制。
二、去矿物质处理水去矿物质水(或软化水)在无菌生产线系统中,用于无菌水生产和消毒剂配制。
对水的质量应符合以下之要求:三、糖质量必须符合可口可乐公司或中国区所订的标准。
* 若使用不需要净化处理的糖时,必须确认糖的微生物含量符合要求。
如有需要,应进行杀菌处理后方可用于配制成品。
四、液氮1 质量标准必须符合可口可乐公司中国区文件T-36 氮气标准(液氮和气氮)。
2 供应商需每批液氮提供CoA 和CoC 报告3 接受厂需要每批检验气味4 液氮安全使用要求为避免液氮低温(-195 oC (-320 oF) 特性可能引起对人皮肤和眼睛接触的严重伤害,必须严格按照供应商提供的安全作业指导说明进行作业和管理。
工厂应根据实际使用之场合的评估,指定合适的作业规范和安全防范措施。
五、浓缩果汁所有浓缩果汁必须从认可的供应商购买并满足公司的标准及规格。
(a) 接收入库品控程序- 运抵检查:销售文件和容器上的标签应该在入库时进行检查。
应该具备下列资料:(1) 原料名称(2) 生产批号(3) 数量(4) 生产/销售日期- 浓缩果汁运到厂时温度:当不符合可口可乐公司规定时必须拒收并通知可口可乐公司处理。
-包装密封防盗标记:凡未密封或遭破坏的容器不能接收。
-包装的物理条件:* 损坏的容器应被拒绝* 积尘严重的容器在放入仓库之前应该清洗* 有迹象表明曾在不适宜的温度下贮存或运输的容器应该扣存进行进一步的检测(b)浓缩果汁之贮存- 冷冻浓缩果汁在运送期间必须保持-18 oC。
- 冷冻浓缩果汁应贮存在-18 oC。
- 冷冻库必须能上锁以确保冷冻果汁之安全。
*当浓缩果汁使用无菌包装时,运送期间温度可保持在冷藏状态。

可口可乐质量管理一瓶可口可乐是怎样到达您手中的?使用的原材料,要经过400多项检测,之后送入无菌车间,几乎全身消毒的工人操控机器,混合其他原材料灌装,之后送入保持10—20度的仓库中,按照订单,全程温度控制送货到各大超市和商店,经过销售到消费者手中。
在郑州太古可口可乐饮料有限公司(以下简称郑州太古可口可乐),这样的程序周而复始。
在整个过程中,质量安全,被公司提在极高的位置。
从原材料,到生产、储存、配送,可口可乐公司把每一个环节,都做到了极致。
原材料:使用的果肉,要经过400多项检测在和郑州太古可口可乐多位部门负责人的交谈中,记者得到这样一个信息,食品安全和给顾客提供高质量产品是可口可乐公司的核心价值之一。
可口可乐在全球有一套非常完善的质量管理体系,来保障其产品在送到消费者手上时,是完全符合公司规定和中国食品安全的相关法规。
在采购环节中,可口可乐公司对供应商有非常严格的认证体系,对于原料的入场检验,包括监控,也是有一套非常完整的体系。
在可口可乐公司(中国),从巴西、美国买很多的果汁、果肉,每一批都会经过超400多项的严格检测,包括农药残留、重金属、微生物等,用以保证产品安全。
之后,这些检测合格的原材料,被运送至各装瓶厂使用。
这样做的目的,在于从源头上保证产品最后是安全的,也是符合标准的。
而对于提供产品上下游原材料的公司,如瓶坯供应商,可口可乐公司也有着严格的要求:企业经营要在三年以上,还要对原材料主要供应商进行认可,合作也不是一劳永逸的,可乐公司会建立清单,定期进行审核。
生产:对空瓶的目视检测,员工的裸眼视力要在1.0以上合格的原材料,要经过安全的加工,产品才能真正让消费者放心,这就要求工人有较高的素质。
而想要进入郑州太古可口可乐,并不容易。
“必须接受入厂培训、岗前培训、上岗培训、评估,达标后方可单独上岗,并有年度的考试评估支持。
”据郑州太古可口可乐生产部经理吕书学介绍,即使进入到公司,从厂区进到车间,也得过好几关。
食品微生物学检验
商业无菌检验能力验证技术方案
根据《新项目论证技术要求》,为保证此次能力验证数据准确,结果可靠,特制定如下技术方案:
一、检验依据
《食品微生物学检验商业无菌检验GB4789.26-2013》
二、检品
灭菌乳:取两个品牌的同品种产品
调制乳:灭菌工艺生产的产品
三、人员比对
灭菌乳A:a、b分别试验进行数据比对(双人双平行);
灭菌乳B:c、a分别试验进行数据比对(双人双平行);
调制乳:c、b分别试验进行数据比对(双人双平行)。
三、准备工作
仔细核对并灭菌本试验使用试剂、耗材以及玻璃容器等。
四、质量控制
1、按照国家标准规定准确称重并按照不同温度进行保藏或培养。
2、仪器设备性能和检测环境的确认
(1)依据《消毒与灭菌效果的评价方法与标准GB15981-1995》定期对高压蒸汽灭菌锅的灭菌效果进行检测评价并记录;
(2)依据《无菌室消毒灭菌操作规程》定期对对无菌室、生物安全柜、超净台、无菌衣进行清洁消毒灭菌;
(3)依据《实验室质量控制规范食品微生物检测GB/T27405-2008》定期对对无菌室、生物安全柜及超净台进行沉降菌检测并记录。
3、对照
每次实验均应进行低温对照确保实验数据的可靠性。
五、注意事项
1、实验人员要严格按照《无菌检查系统操作规程》进出无菌室;
2、严格按照《食品微生物学检验总则GB4789.1-2016》进行采样
和实验;
3、PH测定所用到的酸度计每次应进行校准;
4、本实验不包含商业无菌异常原因分析;。
无菌药品包装容器的密封性验证方案1.概述:无菌药品的容器应能在整个有效期内有完好的密封性,防止微生物的浸入。
药品包材的设计及选择要考察相互的配合情况。
无菌容器/密封件系统的完整性测试可以在培养基灌装时进行。
2.目的:评估产品包装的密封性,以充分保护产品在储存期的无菌状态。
3.依据:《药品生产质量管理规范》2010修订版:附录1:第九十五条无菌药品包装容器的密封性应经过验证,以避免产品遭受污染。
4.责任:质量部、生产部对本验证负责。
5.微生物浸入试验法验证密封完整性:往产品容器内灌入培养基并按照常规方式压塞封盖,灭菌后冷却备用。
将冷却后的容器倒置并将瓶口完全浸没于高浓度(108CFU/ml)的运动性菌液中,4小时后,将容器外表面消毒并培养,看是否有挑战性细菌在容器内生长。
多准备一些灌装培养基的样品,在与产品相同地的贮存条件下贮存。
在贮存的一定时间间隔(12,24,36和48个月等),取出部分样品,进行微生物浸入试验,以确定密封系统在贮存期内的有效性。
6.范围:西林瓶、胶塞及铝盖的密封性验证,共有10ml及2ml两种规格。
7.用品:胆盐乳糖培养基铜绿假单胞菌(ATCC 9027)乙酸异丙醇8.实施:8.1制备样品:取已经按相应清洗灭菌操作规程制备好的西林瓶、胶塞及铝塑组合盖150套,西林瓶内灌装入已灭菌的胆盐乳糖培养基,在正常生产线上抽真空、压塞、轧盖。
将每一试样品倒转,使培养基与西林瓶内表面及胶塞充分接触,在30~35℃竖立倒置培养14天,培养基应澄清,无菌落生长。
8.2制备微生物菌悬液:从铜绿假单胞菌(ATCC 9027)的新鲜斜面上取培养物,分别接入含6ml无菌胆盐乳糖培养基的试管中,在30~35℃下培养18~24h;将每管的培养物分别转入含600ml相同培养基的容器内,于30~35℃下培养(约24小时),在培养结束时,能明显见容器内培养基出现浑浊,计数,当菌落数大于108CFU/ml时,停止培养,待用(在微生物侵入试验开始,所用菌悬液浓度(活菌数)必须达到1×108CFU/ml。
饮料无菌灌装的微生物控制 李有为风险。
因此,如何控制微生物污染风险,以及如何验证无菌生产线十分重要。
中。
除霉菌孢子可自由悬浮在空气中,空气中的微生物一SHARING71交流727273SHARING73杀菌效率应大于4lg(PAA 2000ppm)。
2.5 设备表面涂抹验证COP 和SOP 前后在指定的位置各涂抹一次。
可涂抹设备的任何表面,在涂抹时要避免二次污染。
将涂抹棒在无菌条件下放入装有一定量营养肉汤培养基的试管,培养后检查样品是否浑浊、有沉淀或产气。
另将一根无菌的涂抹棒浸泡在培养基中作为空白样,另将一根涂抹棒接种微生物浸泡在培养基中作为阳性对照,然后以同样的条件培养。
要求微生物不得检出。
2.6 瓶内消毒灭菌效果验证取100个瓶子,接入0.1 mL 浓度为107 CFU/mL 的枯草芽孢杆菌黑色变种(ATCC9372)孢子悬浮液,使每个瓶子中的微生物达到106个。
在干燥2小时后,取其中20个瓶子要经过正常清洗消毒程序处理并灌入大约100mL 无菌水,盖好盖子。
在测试的瓶子中灌入100 mL 无菌水,至少振摇5min,然后用0.2μm 膜过滤。
将过滤膜置于PCA 平板,36℃培养2d。
要求灭菌效率≥4lg(PAA 2000ppm)。
2.7 瓶外消毒灭菌效果验证取100个瓶子,接0.1mL 浓度为105CFU/mL 的枯草芽孢杆菌黑色变种(ATCC9372)孢子悬浮液到每个瓶子上,每个瓶子大约含有104 个微生物。
接种位置可根据瓶型取2-3点,接种区域要用防水记号笔标出。
然后将瓶子放好,干燥2小时以上。
干燥好后,取其中20个瓶子经过正常清洗消毒程序处理。
测试的瓶子在出口传送带上取下来,用无菌袋收集瓶子,用无菌的剪刀无菌操作剪下染菌部位,装入含有100mL0.1%吐温20溶液的无菌瓶中进行20min 的洗脱,然后经过0.2μm 膜过滤。
将过滤膜置于PCA 平板,36℃培养2d。
要求灭菌效率≥3lg(PAA 2000ppm)。
本模块作为审核指南,完成模块中内审的考核以确定被审公司是否符合可乐要求。
1) Questionnaire:1.Is a microbiological monitoring program, in line with Companyrequirements, in place? ............................................有微生物监控程序吗,和公司要求一致吗2.Did the Division approve all microbiological sampling points? ..........取样点取得了认可吗3.Is appropriate record review in place? .................................有相应的记录可评审吗4.Is the plant following the required testing on water? ..................水的检验按要求做了吗5.Is the plant following the required testing on sweeteners? .............糖料按要求检测了吗6.糖浆和成品按要求检测了吗7.Is the plant following the required testing on process equipment andothers? ............................................................工艺设备和其他按要求进行了检测吗8.Is an adequate microbiological monitoring program in use to validate theeffectiveness of the cleaning & sanitation? (6)有没有对清洗消毒效果进行全面的微生物检验9.Is the plant using Company specified microbiological monitoring methods?7所用的检验方法符合公司要求吗10.Is the plant properly conducting the Membrane Filtration technique whereapplicable? (7)在适用的地方所用的是膜过滤吗11.Is the plant properly conducting the Pour Plate technique where applicable? 8在适用之处是用的倒平板法吗12.Is the plant properly conducting other microbiological methods? (8)工厂有用其它的检验方法吗13.Are correct media and incubation temperatures used? (8)培养基和培养温度正确吗14.Are correct incubation times applied? (11)培养时间恰当吗2) Reference Standards List:Beverage OperationsManualBO-RQ-435 Microbiological MonitoringRequirementsBO-RQ-434Microbiological Requirements– Cleaning & SanitationStandards Methods Manual- MicroSM-PR-Microbiological Methods SM-PR-Membrane Filtration660 625SM-PR-605 Commercially AvailableMicrobiological MethodsSM-PR-655Pour PlateEE&ME Air Quality Standards andMonitoringTCCQS updates are captured till December 15, 2005 3) Specifications and Requirements Summary:。
无菌线测试(S2-S11)S1:设备出厂前作的验证,在设备生产厂家内部进行。
S2:评估COP/SOP对无菌区的清洁和杀菌效能验证。
S3:包装材料外表面灭菌消毒效果测试。
S4:包装材料内表面灭菌消毒效果测试。
S5:注入无菌环境测试。
S6:整个生产线的无菌效果验证,认证从灭菌到无菌缸到充填及旋盖的全部过程。
S7:注入封盖系统的无菌环境验证,认证从灭菌到充填及旋盖的整个过程的无菌效果。
S8:隔离系统的抗污染能力验证。
S9:运输测试,测试运输期间,对微生物敏感的产品在分类卡车上,贮存和装卸条件下对包装完善方面的影响。
S10:饮料生产允许测试,确认无菌线是有能力对不同类型的饮料产品进行大批量的生产。
S11:饮料生产接受测试,证明无菌生产线是具备商业长期产生不同饮料的能力的。
无菌线S2验证SOP目的:评估COP/SOP对无菌区的清洁和杀菌效能应用:无菌灌注系统无菌区的设备外部表面,此钢片测试应于培养基注入测试之前进行第一部分:准备工作1.仪器与试剂:移液枪(1ml,0.1ml,0.01ml,推荐另配一把1-9ml)以及枪头各100个,钢片50片(Krones提供接种好的钢片),100ml塑料圆盒50个,不锈钢托盘3个,锡箔纸5卷,平皿(塑料/玻璃均可),TSA培养基,PCA培养基,石英砂、3M胶带、扎带,针筒(1ml,10ml各一个),振荡器1台,摇床(采购中),Duran瓶,或者三角瓶以制备培养基以及无菌水,2.洗脱液配制:吐温0.1% 、蛋白胨0.1%、石英砂稍许、氯化钠0.85%3.其它:酒精灯、过滤膜、试管第二部分:操作要求1.S2验证都应当在穿着无菌服,手套,进行全身杀菌的条件下进行2.将样品按照验证程序要求,进行相应的处理,完毕后采用无菌取样的方式移出,进行微生物检验。
3.操作前,按照要求进行洗手、更衣、消毒等人员卫生程序。
4.不相关的人员严禁进入净化间,避免人为污染的存在。
5.所用工具事先完成消毒处理。
6.操作过程中产生的废弃包装物、废弃样品和防护用品等物品及时销毁,并对相关操作区域和接触过的区域进行彻底消毒处理。
7.凡是使接触或可能接触过菌种的地方都要进行消毒,尤其是生产车间内的灌装间,凡是接触过菌种的设备,工具,仪器表面必须进行高温灭菌或者相对应的处理8.接种室的准备:一房间作为接种室,内部有恒温设施,温度计,湿度计,生石灰(作为干燥剂),桌,椅各一张。
出入此房间人员必须严格控制或者指定专人房间保管钥匙第三部分:S2验证步骤1.设备进行CIP和SIP,SIP时用温度测试条对微生物实验室中的杀菌锅,灌注UHT系统SIP温度,UHT保持管末端温度进行验证2.着色试验,确定S2验证中所挂钢片的位置3.挂钢片之前,由Krones人员做阳性对照试验,10组4.无菌钢片安置(协助Krones人员做):钢片使用塑料扎带或者双面胶,悬挂或黏贴在之前通过着色实验确认的30个点上。
安置钢片时,可由三人进行操作,一人在无菌环境内安置,其余两人则协助钢片安置人,比如为其用酒精消毒,穿戴鞋套,递送工具等。
钢片安置完毕之后,关闭灌装机各个密封门,并且确认。
之后,进行COP/SOP,并且期间有相关人员对于Hygiene Center上的参数,与灌装间COP/SOP的实际时间进行确认。
关于COP/SOP参数,需事先从Ecolab取得,后依照此数据,在Hygiene Center核对,并且通过秒表记数验证数据准确性,确认方法亦从Ecolab得到。
(需设记录实验的表格)5.无菌钢片卸载(协助Krones做):COP/SOP结束后,卸载钢片,可由三人进行操作,一人在无菌环境内安置,其余两人则协助钢片安置人,比如为其用酒精消毒,穿戴鞋套,递送工具等。
钢片背部以及边缘,需使用酒精或者PAA 稀释等消毒液进行消毒,但是消毒液绝对不允许接触钢片正面,消毒完毕后,用9ml无菌水冲洗,并立即放入100ml洗脱液的塑料盒中,上下摇晃20分钟。
6.洗脱液膜过滤(微生物品控员做):洗脱液塑料盒摇晃20分钟后,置于超净工作台上取出,直接对洗脱液进行膜过滤,如产生泡沫,使用100ml无菌水加入滤杯助滤,取下滤膜,放入事先准备好的培养基平板(事先倾倒好TSA无菌培养基)。
实验后,平皿放入35-38℃培养箱,48小时后计数第四部分:S2验证过程中无菌流体的取样从S2开始至结束,工厂品控人员需依据取样频率,进行微生物取样。
要求现场微生物QC取样,取样后进行膜过滤,以总菌以及霉菌/酵母温度培养。
1.无菌水总出水口2.V401,V165,V825无菌空气3.COP/SOP时化学中心无菌空气4.COP/SOP时化学中心无菌水第五部分:用差值法计算每片浓度为6 log的钢片所减少的微生物的数量级:R = log (C0) –log (Ct), 即:R=数量级缩减量或者数量级毁灭量,C0 =初试微生物数量和Ct =灭菌后微生物存活数量无菌区钢片测试可接受运行结果参考标准(COP/SOP):无菌线S3验证SOP目的:验证系统对包装材料外部表面消毒灭菌效果。
应用:瓶,盖必须与即将投入生产线生产的瓶,盖设计形状,尺寸相一致第一部分:准备工作1.微生物品控准备工作:移液枪(1ml,0.1ml,0.01ml,推荐另配一把1-9ml)以及灭菌过的枪头各100个,细菌悬浊液,菌液浓度确认后,将原液和108 浓度的菌悬液冷藏待用,装有洗脱液100ml的塑料圆盒198个(121℃20分钟灭菌),无菌浇好TSA培养基的小平皿250套左右,和样品数量相当的0.45um 的无菌滤膜,无菌针筒(1ml,10ml各一个),2.洗脱液配比:吐温0.1% 、蛋白胨0.1%、石英砂稍许、氯化钠0.85%3.小圆盒上用标签识别5个组和阳性对照4.采样点所需物品准备无菌空气采样管、无菌空气取样器、无菌水取样器等,注意:除了正常采样数量,还必须增加化学中心的无菌空气和无菌水5.至少2L无菌水(用于过滤冲洗)6.无菌9ml稀释液,数量根据阳性对照数量确定7.75%酒精,35-38℃的培养箱,取塑料袋放入紫外灯下杀菌后备用。
酒精消毒不锈钢托盘备用3个,锡箔纸5卷,口罩若干,塑料手套若干,摇床,振荡器8.准备接种用PET瓶至少600个(包括阳性对照、阴性对照、在实验过程中掉落损失)9.强力剪刀1把,不锈钢剪刀2把,镊子2把,纸箱30个,10.1500ppm PAA 2L(以1L烧杯/塑料杯盛放,保证能覆盖到整把剪刀以及镊子上沿),标签纸(根据样品个数准备)11.确认现场的PAA浓度符合要求第二部分:操作要求1.S3验证都应当在穿着无菌服,手套,进行全身杀菌的条件下进行2.将样品按照验证程序要求,进行相应的处理,完毕后采用无菌取样的方式移出,进行微生物检验。
3.操作前,按照要求进行洗手、更衣、消毒等人员卫生程序。
4.不相关的人员严禁进入净化间,避免人为污染的存在。
5.所用工具事先完成消毒处理。
6.操作过程中产生的废弃包装物、废弃样品和防护用品等物品及时销毁,并对相关操作区域和接触过的区域进行彻底消毒处理。
7.凡是使接触或可能接触过菌种的地方都要进行消毒,尤其是生产车间内的灌装间,凡是接触过菌种的设备,工具,仪器表面必须进行高温灭菌或者相对应的处理8.接种室的准备:一房间作为接种室,内部有恒温设施,温度计,湿度计,生石灰(作为干燥剂),桌,椅各一张。
出入此房间人员必须严格控制或者指定专人房间保管钥匙第三部分:S3验证步骤1.生产部保证灌装机可以正常运行2.生产部要在注入间内放置两张用于放置瓶子和剪瓶子的非木质桌子。
3.微生物工程师准工作(由克朗斯微生物工程师主导):104接种:将稀释至106/105菌悬液,用移液枪取0.01ml/0.1ml至验证所用PET 空瓶外表规定区域,在该区域作好标记,室温干燥4-8小时不等,具体数量和部位参照Validation Protocol(可以事先备好生石灰做干燥剂)。
准备好30个1.25L 产品的纸箱,顶端开瓶口大小圆孔,安置倒置干燥之PET瓶,空瓶按照实际情况放置(比如接种点为瓶底,瓶子要倒置插在纸箱上安放,干燥)。
4.接种瓶上菌液干燥后,就可进行S3。
5.接种后PET瓶,使用塑料袋,按照不同部位,将175个已接种的PET瓶分成5个组别,从接种室转移到注入间,以35个一组(5个备用),挂上风道。
6.按照规定最大灌装速度(比如NT480瓶型对应的36000bph),进行验证。
7.杀菌后PET瓶不封盖,迅速从注入机出口运输带取出,放入已杀菌的速封袋,转移至指定区域,把PET瓶做标记部分剪下,放入洗脱液中(放置洗脱液与接种样品的小盒子,必须事先用标签纸标示清楚,待用)。
8.将样品的洗脱液充分摇匀晃(接种在瓶口罗纹部分的样品需要摇晃25分钟,其余区段产品摇晃20分钟),摇匀后将样品置于超净工作台上取出,直接对洗脱液进行膜过滤,取下滤膜,放入事先准备好的TSA培养基平板(事先倾倒好无菌培养基)。
将平皿放入35-38℃培养箱,48小时后计数。
9.每个阳性对照做10-3稀释,10-4稀释,0.1*10-3稀释各一次。
阳性对照建议一共5个点,每个点5组。
注意:a.剪下带有标记的瓶子时,每完成一个瓶子的剪切,必须使用1500ppm的PAA对双手,剪刀进行消毒。
b.由于剪切样品数量较多,建议两组人员进行操作,每组两人,一人剪瓶,一人为另一人消毒)c.过滤时,使用100ml无菌水加入滤杯助滤.d.以上项目由克朗斯培训,微生物品控操作,同时由克朗斯微生物工程师主导。
第四部分:过程监控取样由Krones提供取样培训、微生物品控取样,生产部协助通知取样时间、品控组长协助取样。
从S3开始至结束,工厂品控人员需依据取样频率,进行微生物取样(无菌水总出水口、无菌空气、Hygiene Center无菌空气、Hygiene Center无菌水、冲瓶无菌水、冲瓶无菌空气),取样后进行膜过滤,以总菌以及霉菌/酵母温度培养。
现场的检测和巡检项目和正常时一致。
第五部分:用差值法计算每个瓶子,瓶盖所减少微生物的数量级:R = log (C0) –log (Ct), 即:R=数量级缩减量或者数量级毁灭量,C0 =初试微生物数量和Ct =灭菌后微生物存活数量外部表面杀菌测试可接受运行结果参考标准:无菌线S4验证SOP目的:验证系统对包装材料内部表面消毒灭菌效果。
应用:瓶,盖必须与即将投入生产线生产的瓶,盖设计形状,尺寸相一致第一部分:准备工作:1.仪器与试剂:移液枪(1ml,0.1ml,0.01ml,推荐另配一把1-9ml)以及枪头,细菌悬浊液(枯草芽孢杆菌ATCC 9372),100ml塑料圆盒150个,不锈钢托盘,锡箔纸,平皿(塑料/玻璃均可),OSA培养基,PCA培养基,吐温试剂(0.1% Tween(界面活性剂) / 0.1% peptone(蛋白胨)溶液),3M胶带,扎带,针筒(1ml,10ml各一个),振荡器,超声波洗瓶器,摇床,Duran瓶或者三角瓶制备培养基以及无菌水,以及其他微生物实验室仪器耗材等。