配位化学6-磁性
- 格式:ppt
- 大小:756.50 KB
- 文档页数:49


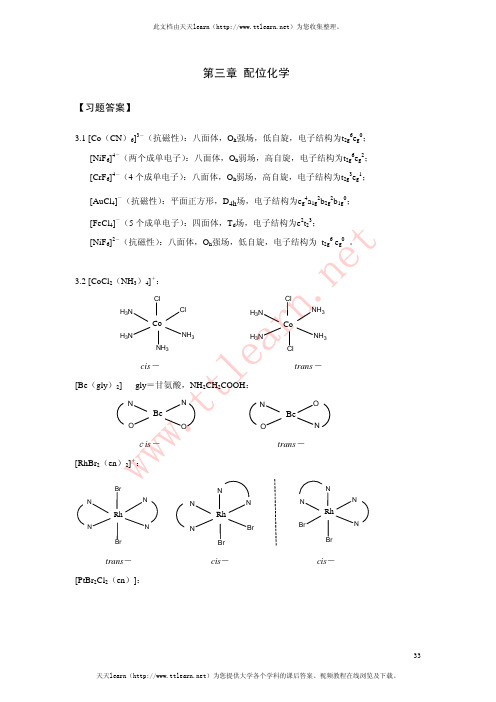
第3章配位化学-习题第三章配位化学【习题】3.1 试判断下列配离子的几何构型和电子结构:[Co(CN)6]3-(抗磁性);[NiF6]4-(两个成单电子);[CrF6]4-(4个成单电子);[AuCl4]-(抗磁性);[FeCl4]-(5个成单电子);[NiF6]2-(抗磁性)3.2 画出下列各配合物(配离子)所有可能的异构体:[CoCl2(NH3)4]+,[Be(gly)2],[RhBr2(en)2]+,[PtBr2Cl2(en)],[Ir(C2O4)2Cl2]3-,[Cr(gly)3],[Pt(gly)2](gly=glycine,甘氨酸)3.3 已知配合物[M(A-B)2]和[M(A-B)2X2]型的配合物都是旋光活性的,请分别画出它们的几何结构。
3.4 紫红色的[Ti(H2O)6]3+在可见区的吸收光谱如教材中例题3-1的图所示,其最大吸收峰位置对应于20.3×103 cm-1,并在该最大吸收峰位置的右边(低频方向)出现一个肩峰,试用晶体场理论解释上述肩峰的由来。
3.5 下列配离子中哪些属于高自旋构型?(a)Mn(H2O)62+;(b)Fe(H2O)63+;(c)Co (NH3)63+;(d)Co(H2O)62+;(e)CoCl42-;(f)Fe(CN)64-3.6 下列配合物或配离子中属于低自旋构型的是(a)Fe(H2O)63+;(b)Co(H2O)62+;(c)Co (H2O)63+;(d)CoF63-3.7 对于CoF63-配离子,下面的哪项论述是正确的?(a)CoF63-的晶体场分裂能大;(b)F-为强场配体;(c)CoF63-是顺磁性的;(d)所有论述都不正确。
3.8 下列配离子中,哪一种可能产生Jahn-Teller效应?(a)Fe(CN)64-;(b)Fe(H2O)62+;(c)Cr(H2O)63+;(d)Co(NH3)63+;3.9 试画出配合物[Co(NO2)3(NH3)3]可能存在的几何异构体。

第六章配位化学配位化学是一门在无机化学基础上发展起来的交叉学科,现代配位化学不仅和化学学科中的物理化学、有机化学、分析化学和高分子化学密切融合,而且通过材料科学及生命科学,进而与物理学和生物学等一级学科相互渗透和交叉。
经过几代人的共同努力,我国配位化学研究水平大为提高,一些方向逐渐步入国际先进行列。
本章将对我国化学工作者近年在配位化学领域研究前沿上具有一定国际影响力的代表性成果进行论述。
6.1配位化学中的新反应及方法学研究配位化学中的新反应和合成方法研究是进行配位化学研究的重要前提和基础研究课题之一。
配合物最传统的合成方法是溶液法将反应物在溶剂中搅拌,或者缓慢扩散(包括分层扩散,蒸汽扩散,U型管缓慢扩散)通过直接、交换、氧化还原反应等方法,一般适用于反应物(金属盐和配体)溶解性比较好的,在温度不太高就可以反应的配位化合物的合成。
而对于金属盐以及有机配体都难于溶解的体系,传统的溶液法往往无能为力。
无机化学家除了继续发展传统的配位化合物合成方法外,对发现新合成反应或建立新合成方法的研究都从来没有间断过,特别是在利用这些新反应、新方法来制备、合成具有新颖结构或特殊功能的配位化合物方面,近年来取得了长足的进展,其中利用水热和溶剂热合成的方法已经取得了很多值得关注的成果,包括一些新颖的原位金属/配体反应,被誉为“连接配位化学和有机合成化学的桥梁”[1];而模板合成技术也被成功得用于配合物以及其聚集体的可控组装中;一些特殊的合成技术和方法如离子热、微波辅助、固相反应等也将在本节介绍。
6.1.1溶剂(水)热条件下原位金属/配体反应作为配位化学和有机化学的重要研究内容之一,原位金属/配体反应已被广泛地用于新型有机反应的发现,反应机理的阐述以及新型配位化合物的合成,尤其是用于合成那些利用有机配体直接反应难以得到的配合物。
传统的合成反应一般是在敞开体系而且比较温和的条件下发生的,而在溶剂热或水热反应条件下,利用原位金属/配体反应法制备配位化合物是十几年兴起的一种新合成方法,这一源于无机材料,特别是多孔分子筛材料的合成方法,已被广泛地应用于配位化合物,尤其是难溶的配位聚合物的合成[1, 2]。


二茂铁[Co(NH3)6]Cl3K3[Fe(CN)6]cis - [PtCl2(Ph3P)2] 顺-二氯·二(三苯基磷)合铂(II)K[PtCl3NH3] 三氯·氨合铂(II)酸钾二(μ- 氯) ·四氯合二铁(III) 二(μ- 氯) ·二(二氯合铁(III))顺-二氯·二氨合铂(II)经-三氯·三氨合钴(III )配位化合物的异构现象异构现象是配合物的重要性质之一。
所谓配合物的异构现象是指分子式(或实验式)相同,而原子的连接方式或空间排列方式不同的情况。
配位化合物有两种类型的异构现象:化学结构异构(构造异构)立体异构化学结构异构是化学式相同, 原子排列次序不同的异构体。
包括电离异构、键合异构、配位异构、配位体异构、构型异构、溶剂合异构和聚合异构;立体异构是化学式和原子排列次序都相同, 仅原子在空间的排列不同的异构体。
包括几何异构和光学异构。
立体异构体:实验式相同,成键原子的联结方式也相同,但其空间排列不同,由此而引起的异构称为立体异构体一般分为非对映异构体(或几何异构)和对映异构体(或旋光异构)两类化学结构异构:结构异构是因为配合物分子中原子与原子间成键的顺序不同而造成的, 常见的结构异构包括电离异构, 键合异构, 配位体异构和聚合异构。
电离异构:在溶液中产生不同离子的异构体。
[Co(NH3)5Br]SO4紫红色和[Co(NH3)5SO4]Br(红色), 它们在溶液中分别能产生SO42-和Br-。
Lewis(路易斯)电子酸碱理论:Lewis电子酸碱理论是一个广泛的理论,它完全不考虑溶剂,实际上许多Lewis酸碱反应是在气相中进行的。
在Liwis酸碱反应中,一种粒子的电子对用来与另一种粒子形成共价键。
“供给”电子对的粒子是碱,而“接受”电子对的粒子是酸。
反应可以写成:A(酸)+:B(碱) A←:B显然,路易斯酸应该有空的价轨道,这种轨道可以是 轨道,也可以是 轨道。
第1章配位化学导论配位化学(coordination chemistry)是无机化学的一个重要分支学科。
配位化合物(coordination compounds)(有时称络合物complex)是无机化学研究的主要对象之一。
配位化学的研究虽有近二百年的历史,但仅在近几十年来,由于现代分离技术、配位催化及化学模拟生物固氮等方面的应用,极大地推动了配位化学的发展。
它已广泛渗透到有机化学、分析化学、物理化学、高分子化学、催化化学、生物化学等领域,而且与材料科学、生命科学以及医学等其他科学的关系越来越密切。
目前,配位化合物广泛应用于工业、农业、医药、国防和航天等领域。
1.1 配位化学发展简史历史上记载的第一个配合物是普鲁士蓝。
它是1704年由柏林的普鲁士人迪斯巴赫(Diesbach)制得,它是一种无机颜料,其化学组成为Fe4[Fe(CN)6]3·nH2O。
但是对配位化学的了解和研究的开始一般认为是1798年法国化学家塔萨厄尔(B.M.Tassaert)报道的化合物CoCl3·6NH3,他随后又发现了CoCl3·5NH3、CoCl3·5NH3·H2O、CoCl3·4NH3以及其他铬、铁、钴、镍、铂等元素的其他许多配合物,这些化合物的形成,在当时难于理解。
因为根据经典的化合价理论,两个独立存在而且都稳定的分子化合物CoCl3和NH3为什么可以按一定的比例相互结合生成更为稳定的“复杂化合物”无法解释,于是科学家们先后提出多种理论,例如,布隆斯特兰德(W.Blomstrand)在1869年、约尔更生(S.M.Jørgensen)在1885年分别对“复杂化合物”的结构提出了不同的假设(如“链式理论”等),但由于这些假设均不能圆满地说明实验事实而失败。
1893年,年仅27岁的瑞士科学家维尔纳(A.Werner)发表了一篇研究分子加合物的论文“关于无机化合物的结构问题”,改变了此前人们一直从平面角度认识配合物结构的思路,首次从立体角度系统地分析了配合物的结构,提出了配位学说,常称Werner配位理论,其基本要点如下:(1) 大多数元素表现有两种形式的价,即主价和副价;(2) 每一元素倾向于既要满足它的主价又要满足它的副价;(3) 副价具有方向性,指向空间的确定位置。
配位化合物的磁性与配位数的影响配位化合物是指由一个或多个配位基团与中心金属离子配位形成的化合物。
在配位化合物中,配位基团以孤对电子或共用电子对的形式与中心金属离子形成配位键,构建起配位化合物的结构。
配位基团的选择和配位数的变化会显著影响配位化合物的磁性特性。
一、配位基团的选择对磁性的影响在配位化合物中,不同的配位基团具有不同的电子性质,可以是给电子基团,也可以是取电子基团。
给电子基团具有供给电子的能力,容易与中心金属离子形成强偶极磁性。
常见的给电子基团有水、氨等。
相反,取电子基团具有接受电子的能力,容易与中心金属离子形成弱偶极磁性。
常见的取电子基团有氯、溴等。
以配位数为4为例,由四个配位基团(如四个氨分子)与一个中心金属离子(如铜离子)形成的四配位配位化合物通常具有强磁性。
这是因为氨分子是给电子基团,有供给电子的能力,容易与中心金属离子形成强偶极磁性。
相反,如果取代氨分子的是取电子基团(如氯离子),则形成的四配位配位化合物通常具有弱磁性。
这是因为取电子基团不能有效地供给电子,无法形成强偶极磁性。
二、配位数的变化对磁性的影响配位数是指与中心金属离子配位的配位基团的数量。
配位数的变化会导致配位化合物的结构和性质的变化。
在磁性方面,配位数的增加通常会增强配位化合物的磁性。
以配位数为6为例,由六个配位基团(如六个氨分子)与一个中心金属离子形成的六配位配位化合物通常具有高自旋态,表现出强磁性。
这是因为六配位配位化合物的电子构型满足特殊的规则,使其能够形成高自旋态。
相反,如果配位数减少到4,则形成四配位配位化合物,通常具有低自旋态,表现出弱磁性。
这是因为四配位化合物的电子构型不能满足高自旋态的要求。
此外,配位数的变化还会影响配位化合物的几何构型,进而影响电子的排布方式和移动性,影响配位化合物的磁性。
例如,四配位化合物通常具有较为简单的平面结构,而六配位化合物通常具有更为复杂的八面体结构,这些结构差异会影响磁性的表现。