配位化学讲义第六章溶液中配合物的稳定性
- 格式:doc
- 大小:467.00 KB
- 文档页数:48

3、作图外推法(β0=1)展开:移项整理:以对作图,则[L] 0时,应近似接近于一斜率为β2,截距为β1的直线。
若再展开一项:移项:整理:以对作图,[L] → 0时,应近似于斜率为β3,截距为β2的直线。
依次类推,即可得到各级βj。
二、利用Leden函数求稳定常数(要求测定[M]、[L])1、联立方程法:若测得多组([M], [L])值,列方程组用最小二乘法求βj。
2、外推法:以Y1对[L]作图,[L] →0时,应近似为一截距为β1的直线。
再令:以Y2对[L]作图,[L] →0时,外推得到截距为β2的直线。
依次类推:令,可按上述方法求出βj。
值得注意的是:j=n-1时,Y n-1 = βn-1 + βn[L]j=n 时,Y n = βn所以将Y n-1和Y n对[L]作图时,应得两条直线,并且后一直线与[L]轴平行,由此可求出配位数n。
第四节测定稳定常数的实验方法一、浓度稳定常数与条件稳定常数M + L = ML浓度稳定常数与T、P及I有关用高浓度的惰性盐维持离子强度恒定。
在这种条件下测得的浓度稳定常数称为条件稳定常数。
惰性盐的选择条件:1)其阳离子或阴离子不与配体或金属离子形成配合物。
常采用NaClO4。
2)对配合物的物理性质无干扰。
如用分光光度法测定平衡常数时,在所选波长不应有吸收。
3)在所用溶剂中应有足够的溶解度。
(以保持离子强度)4)不与配体或金属发生氧化还原反应。
如:NaClO4不能用于V3+体系,因V3+为强还原剂。
5)使用高浓度NaClO4时,应考虑其中杂质(Cl−、SO42−)的影响。
二、pH电位法适用范围:迄今应用最广的方法,适用于弱酸根离子或碱分子(Bronsted酸、碱理论)作为配体的体系。
1) 用pH电位法测定配体的加质子常数操作:用标准NaOH溶液滴定已知浓度的(salt + B + HCl)溶液, 记录pH值变化。
原理:L+H = HL β1H = K1HHL+H = H2L β2H = K1H K2HH2L+H = H3L β3H = K1H K2H K3H……… ………… ……….定义:酸生成函数总酸度:C H=T H-T OH+[OH]酸性条件下:C H = T H - T OH + 水电离产生的[H] = T H - T OH + 溶液中[OH]因此C H = T H - T OH + [OH]碱性条件下:C H = 水电离产生的[H] = 水电离产生的[OH] = 溶液中[OH] – (T OH - T H )因此C H = T H - T OH + [OH]由实验测得[H],算出即可求出多组(L)—[H]数据.进而可用前述求βj的方法求βj H(联立方程法、半整数法、外推法)2)测配合物稳定常数操作:用标准NaOH溶液滴定已知浓度的(salt + M + B + HCl)溶液, 记录pH值变化。




化学配位化学与配合物的稳定性化学配位化学是研究金属离子和有机配体之间发生配位作用形成配合物的学科。
配位化学的一个重要方面是配合物的稳定性,即在一定条件下配合物形成的程度和配合物的稳定度。
本文将探讨配位化学与配合物稳定性的关系以及其在实际应用中的意义。
一、配位化学基础配位化学是指两种或两种以上的分子或离子通过配位键形成一个稳定的化合物的过程。
在配位化学中,金属离子称为中心离子,配体则是与中心离子通过均态或非均态(配位键)连接的分子或离子。
配位键通常由配体的孤对电子与中心离子的空位轨道形成。
二、配合物的稳定性配合物的稳定性可以通过判断配位键的强度来确定。
配位键强度与多种因素相关,包括金属离子的价态、配体的化学性质以及溶剂环境等。
以下是几个主要影响配合物稳定性的因素:1. 金属离子的价态:不同价态的金属离子对配位键的强度有不同的影响。
通常来说,高价态金属离子与配体形成的配合物更稳定。
2. 配体的化学性质:配体的化学性质也会影响配合物的稳定性。
一般而言,含有多个供体原子的配体对配位键的强度贡献更大,因此形成的配合物更稳定。
3. 配体的立体和电子效应:配体的立体和电子效应也会影响配合物的稳定性。
立体效应指的是配体的空间结构对配位键的影响,而电子效应则是指配体的电子供体性质对配位键的影响。
4. 溶剂效应:溶剂环境对配合物的稳定性也具有重要影响。
溶剂分子可以与金属离子或配体形成氢键或其他非共价键,从而影响配合物的稳定性。
三、配合物稳定性的应用意义配合物的稳定性对于理解和应用配位化学具有重要意义。
以下是几个典型的应用实例:1. 催化剂设计:稳定的配合物常用于催化剂的设计与制备。
配体的选择和调整可以使得配合物具有良好的催化活性和选择性。
2. 药物设计:配合物的稳定性与药物的活性和毒性密切相关。
通过对配合物的结构和稳定性的研究,可以为药物的设计和优化提供重要依据。
3. 金属离子输运:稳定的配合物可以用于金属离子的输运和储存。

配合物在溶液中的稳定性【摘要】配合物在溶液中的稳定性是指配离子或分子在溶液中解离为水合金属离子和配体,当达到平衡时其解离程度的大小。
稳定性是配合物在溶液中的一个重要性质,了解配合物对在溶液中的稳定性及其规律,必须从中心离子和配体的本性以及它们之间的相互作用入手。
本文主要讨论中心离子性质对配合物稳定性的影响【关键词】惰气性、d10型、d10s2型、d1-9型金属离子1、惰气性金属离子碱金属: Li+、Na+、K+、Rb+、Cs+碱土金属:Be2+、Mg2+、Ca2+、Sr2+、Ba2+及:Al3+、Sc3+、Y3+、La3+(1)作用力:中心原子与配体间的作用主要是静电作用。
(2)影响稳定性的因素:中心离子的电荷和半径。
中心离子的电荷越大,半径越小形成配离子越稳定。
配合物的稳定性随z2/r增大而增大稳定性顺序为: Li>Na>K>Rb>Cs; Be>Mg>Ca>Sr>Ba2、d10型金属离子Cu(Ⅰ)、Ag(Ⅰ)、Au(Ⅰ) Zn(Ⅱ)、Cd(Ⅱ)、Hg(Ⅱ)Ga(Ⅲ)、In(Ⅲ)、Tl(Ⅲ) Ge(Ⅳ)、Sn(Ⅳ)、Pb(Ⅳ)(1)作用力:化学键在不同的程度上有明显的共价性。
(2)稳定性的规律:①这种金属离子的配合物一般比电荷相同、体积相近的惰气金属离子的配合物要稳定些。
②Zn(Ⅱ)、Cd(Ⅱ)、Hg(Ⅱ)这三种金属离子配合物的稳定性是Hg(Ⅱ)的最高。
③Zn(Ⅱ)和Cd(Ⅱ)的顺序不一致,在与有些配体配位时,Zn(Ⅱ)的配合物的稳定性大于Cd(Ⅱ)的配合物的稳定性,但与另一些配体配位时则出现相反的现象。
例如:Zn(Ⅱ)、Cd(Ⅱ)、Hg(Ⅱ)与卤素离子形成的配离子时,在Cl-、Br-、I-作配体时稳定性顺序都是Zn<Cd<Hg;在F-作为配体是,稳定性顺序却是Zn>Cd<Hg;原因:由于Cl-、Br-、I-有比较明显的变形性,配离子中共价结合的成分随着Zn、Cd、Hg的顺序而增加;因此半径越大越稳定。
研究发现:第四周期过渡金属离子与含O、N配位原子的配体的高自旋八面体配合物,其稳定性顺序如下:Mn2+<Fe2+< Co2+< Ni2+< Cu2+ >Zn2+CFSE(Dq) 0 -4 -8 -12 -6 0这称为Irving-Williams顺序,可用CFSE解释。
Ni2+<Cu2+,可用Jahn-Teller效应解释。
三、配体性质对配合物稳定性的影响1、碱性配位原子相同,结构类似的配体与同种金属离子形成配合物时,配体碱性越强,配合物越稳定。
例:Cu2+的配合物:配体lgK H lgK1BrCH2CO2H 2.86 1.59ICH2CO2H 4.05 1.91phCH2CO2H 4.311.982、螯合效应1)螯合效应:螯合环的形成使配合物稳定性与组成和结构相似的非螯合配合物相比大大提高,称为螯合效应。
例:[Ni(NH3)6]2+lgβ6 = 8.61;心原子的关系1、软硬酸、碱概念(指Lewis酸碱)硬酸:其接受电子对的原子(离子)正电荷高,变形性低。
如:Li+、Mg2+、Al3+。
软酸:其接受电子对的原子(离子)正电荷低,变形性高。
如:Cu+、Ag+、Au+。
硬碱:其给出电子对的原子变形性小,电负性大。
如: F-、OH-。
软碱:其给出电子对的原子变形性大,电负性小。
如: I-、S2-。
2、软硬酸碱规那么在配合物稳定性中的应用1)硬酸倾向于与硬碱结合;2)软酸倾向于与软碱结合;配位化学中,作为中心离子的硬酸与配位原子各不相同的配体形成配合物倾向为:F>Cl>Br>I (1)O>>S>Se>Te (2)N>>P>As>Sb (3)而与软酸中心离子形成配合物的倾向的顺序为:F < Cl < Br < I (4)O << S ~ Se ~ Te(5)N << P > As > Sb (6)对(6)的解释:σ键增强N << P > As > Sb空d轨道:无3d 4d 5d反馈π键减弱π键作用大于σ键。

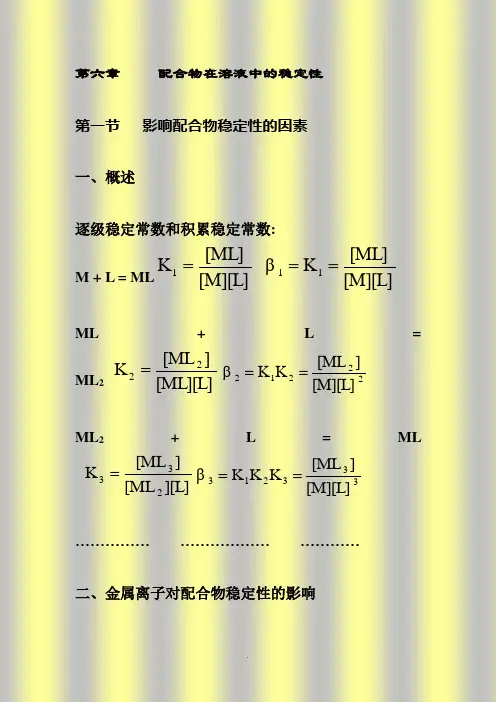
配位化学讲义第六章溶液中配合物的稳定性第六章 配合物在溶液中的稳定性第一节 影响配合物稳定性的因素一、概述逐级稳定常数和积累稳定常数: M+L=ML[M][L][ML]K 1=[M][L][ML]K β11==ML+L=ML 2[ML][L]][ML K 22=22212[M][L]][ML K K β==ML 2+L=ML][L][ML ][ML K 233=333213[M][L]][ML K K K β==…………… ……………… …………二、金属离子对配合物稳定性的影响1、具有惰性气体电子结构的金属离子碱金属:Li+、Na+、K+、Rb+、Cs+碱土金属:Be2+、Mg2+、Ca2+、Sr2+、Ba2+及:Al3+、Sc3+、Y3+、La3+一般认为它们与配体间的作用主要是静电作用,金属离子z/r越大,配合物越稳定。
例:二苯甲酰甲烷[phC(O)CH2C(O)ph]配合物的lgK1值(30℃,75%二氧六环)M2+ lgK1Be2+13.62Mg2+8.54Ca2+7.17Sr2+ 6.40Ba2+ 6.102、Irving-Williams顺序研究发现:第四周期过渡金属离子与含O、N配位原子的配体的高自旋八面体配合物,其稳定性顺序如下:Mn2+ < Fe2+ < Co2+ < Ni2+ < Cu2+ > Zn2+CFSE(Dq) 0 -4 -8 -12 -6 0这称为Irving-Williams顺序,可用CFSE解释。
Ni2+<Cu2+,可用Jahn-Teller效应解释。
三、配体性质对配合物稳定性的影响1、碱性配位原子相同,结构类似的配体与同种金属离子形成配合物时,配体碱性越强,配合物越稳定。
例:Cu2+的配合物:配体lgK H lgK1BrCH2CO2H 2.861.59ICH2CO2H 4.051.91phCH2CO2H 4.311.982、螯合效应1)螯合效应:螯合环的形成使配合物稳定性与组成和结构相似的非螯合配合物相比大大提高,称为螯合效应。

第六章溶液中配合物的稳定性规律稳定性包括有两种:1 热稳定性2 溶液中的稳定性,即稳定常数的大小。
主要要讨论的内容有:1 中心离子的本性与配合物稳定性的关系2 配体性质与配合物稳定性的关系3 其它因素,如溶剂、离子强度等的影响讨论所涉及的稳定常数的类型有三种1 热力学稳定常数,即活度稳定常数2 浓度稳定常数,在固定的离子强度下测定得到的数据,3 混合稳定常数,其中有的组分(如H+)用活度,另外的组分用浓度在进行比较时,应当采用同一条件下测出的稳定常数。
第一节配位键的强弱与软硬酸碱原理1 软硬酸碱规则广义的酸碱定义:碱(如OH-)能给出电子对,而酸(H+)则能接受电子对。
据此定义,所有的金属离子都是广义酸,而所有的配体都是碱配合物的形成过程可看成是酸碱反应的过程:H++ OH- = H2OCu2++ 4NH3= Cu(NH3 )42+中心离子配体配合物广义酸广义碱酸碱化合物广义酸有软酸、硬酸、交界酸之分硬酸:若中心离子的正电荷高,体积小,极化性低的金属离子软酸:若中心离子的正电荷低,体积大,外层电易被激发。
交界酸:介于硬、软酸之间的称为交界酸广义碱:硬碱:若配体体积小,电负性高,极化性低,难氧化,难失去外层电子,称为软碱软碱:若配体体积大,极化性高,易氧化,即易失去外层电子的称为软碱。
交界碱:介于两者之间的称为交界碱。
配体中碱的分类:硬碱:O2-, H2O, OH-, F-, CH3COO-, PO3-4,SO42-, CO32-, ClO4-, NO3-, ROH, RO-, R2O, NH3软碱:S2-,R2S, RSH, RS-, I-, SCN-, S2O32-, R3P, R3As, (RO)3P, CN-, RNC, CO, C2H4, C6H6, H-, R-, 酸碱软硬的大小称为标度,现在有三种方法求得●1)由实验数据求得,●2)以酸碱的若干性质,如离子半径、电离势、电负性求得,●3)由酸碱一般性质求得其中第3)种最有意义,常称Ahland法,也称Ahland软硬标度。


2、Irving-Williams顺序
研究发现:第四周期过渡金属离子
与含O、N配位原子的配体的高自旋
八面体配合物,其稳定性顺序如下:
Mn2+ < Fe2+ < Co2+ < Ni2+ < Cu2+ > Zn2+
CFSE(Dq) 0 -4 -8 -12 -6 0
这称为Irving-Williams顺序,
可用CFSE解释。
Ni2+ < Cu2+,可用Jahn-Teller效应解释。
三、配体性质对配合物稳定性的影响
1、碱性
配位原子相同,结构类似的配体
与同种金属离子形成配合物时,配体
碱性越强,配合物越稳定。
例:Cu2+的配合物:
配体lgK H
lgK1
BrCH2CO2H 2.86 1.59
ICH2CO2H 4.05 1.91
phCH2CO2H 4.31
1.98
2、螯合效应
1)螯合效应:螯合环的形成使配合
物稳定性与组成和结构相似的非螯
合配合物相比大大提高,称为螯合效
应。
例:[Ni(NH3)6]2+ lgβ6= 8.61;
[Ni(en)3]2+lgβ3=
18.26
稳定常数增加近1010倍。
2)螯合环的大小
5员及6员饱和环稳定性较好,
且5员饱和环更为稳定。
如:Li+、Mg2+、Al3+。
软酸:其接受电子对的原子(离子)正电荷低,变形性高。
如:Cu+、Ag+、Au+。
硬碱:其给出电子对的原子变形性
小,电负性大。
如: F-、OH-。
软碱:其给出电子对的原子变形性大,电负性小。
如: I-、S2-。
2、软硬酸碱规则在配合物稳定性中
的应用
1)硬酸倾向于与硬碱结合;2)软酸倾向于与软碱结合;
配位化学中,作为中心离子的硬酸与配位原子各不相同的配体形成配合物倾向为:
F>Cl>Br>I (1)
O>>S>Se>Te (2)
N>>P>As>Sb (3)
而与软酸中心离子形成配合物的倾向的顺序为:
F < Cl < Br < I (4)
O << S ~ Se ~ Te (5)
N << P > As > Sb (6)
对(6)的解释:
σ键
增强
N << P > As >
Sb
空d轨道:无 3d 4d 5d
反馈π键
减弱
π键作用大于σ键。
对于O << S ~ Se ~ Te (5),可作类
似解释。
3、软硬酸碱规则应用实例
Mg2+ + NH3·H2O Mg(OH)2↓
Ag+ + NH3·H2O [Ag(NH3)2]+
五、其他因素对配合物稳定性的影响
1、温度的影响
对于放热的配位反应,T上升,K 减小;
而对于吸热的配位反应,T上升,
K增大。
2、压力的影响
压力变化很大时,不可忽略。
如:Fe3+ + Cl- == [FeCl]2+
压力由0.1atm增至2000atm时,K减小约20倍。
*研究海洋中配合物的平衡时要考虑压力的影响。
3、溶剂的影响
1)当溶剂有配位能力时,有如下竞争反应:
ML + S == MS + L
S配位能力越强,ML稳定性越差。
如[CoCl4]2-在下列溶剂中的稳定性顺序:
CH2Cl2 > CH3NO2 > (CH3O)3P=O >
HC(O)N(CH3)2 > (CH3)2 SO
2)配体与溶剂的缔合作用
在质子溶剂(H2O、EtOH)中,有如下竞争反应
ML + S == M + L(S)
L与S通过氢键结合。
如:
C L — 配体总浓度,C M — 金属总浓度,
[L]为配体平衡浓度。
其物理意义:每个M 离子结合L 的平均数目。
C M = [M] + [ML] + [ML 2] + ……+ [MLn]
= [M] + β1[M][L] + β2[M][L]
2 + ……+ βn [M][L]n
∑=+=n 1j j
j }[L]β[M]{1
C L = [L] + [ML] + 2[ML 2] + ……+ n[ML n ]
数目
M(Hg)。