植酸酶活性测定应注意的几个问题
- 格式:doc
- 大小:30.50 KB
- 文档页数:3


植酸酶活力的测定方法及应注意问题
郭会灿;李会然
【期刊名称】《科技信息》
【年(卷),期】2009(000)036
【摘要】酶活力大小是衡量酶制剂质量的主要指标,选择具有高度专一性和灵敏度的酶活测定方法是酶制剂质量的保障.
【总页数】1页(P11)
【作者】郭会灿;李会然
【作者单位】石家庄职业技术学院化学工程系;石药集团维生药业
【正文语种】中文
【相关文献】
1.小麦粉过氧化苯甲酰测定方法应注意问题探析
2.对发酵生产植酸酶过程中植酸酶活性测定方法的初步探讨
3.对发酵生产植酸酶过程中植酸酶活性测定方法的初步探讨
4.PHGPx底物合成及其活力测定方法的研究──Ⅰ.PHGPx活力测定方法的建立
5.血液胆碱酯酶活力测定方法的进一步研究Ⅰ.红细胞/全血胆碱酯酶活力比例及红细胞计数校正酶活力值的研究
因版权原因,仅展示原文概要,查看原文内容请购买。

饲用植酸酶活性测定关键控制点于洪莲【期刊名称】《《饲料博览》》【年(卷),期】2019(000)008【总页数】4页(P38-40,44)【关键词】饲用植酸酶; 酶活性; 测定方法【作者】于洪莲【作者单位】广东溢多利生物科技股份有限公司广东珠海 519060【正文语种】中文【中图分类】S816.7随着畜牧业的发展和饲料生产水平的提高,植酸酶作为一种绿色环保型添加剂广泛应用于单胃动物饲料中,其通过催化将饲料原料中丰富的植酸及植酸盐分解为能被动物利用的无机磷和肌醇,可有效提高植物性饲料中磷、矿物质元素和蛋白质的可利用率,提高动物生产性能,因此植酸酶在饲料生产中可定量取代或减少无机磷的添加量,在降低畜禽养殖成本的同时还减少了动物粪便中磷的排放量,减轻磷对环境污染。
植酸酶的研究对解决环境污染和满足营养需求方面有着重要意义。
饲用酶制剂活性分析与检测在饲料工业中具有重要的作用,酶制剂生产企业通过检测产品酶活力来监控产品稳定性,保证酶制剂产品品质,饲料生产企业需要通过检测饲料产品中酶制剂的含量来验证其添加效果(即饲料中酶的活力保存率),以保障饲料品质,因此酶活力的测定是控制酶制剂产品质量的关键环节,也是使用效果的基本保障。
如何准确检测植酸酶含量是许多饲用酶制剂工作者普遍关心的问题。
本文以国标检测方法为依据,综述了植酸酶活力测定方法及检测中关键控制点,以期为植酸酶的检测提供可行性参考。
1 植酸酶活性测定的方法及原理1.1 测定方法《饲用植酸酶活性的测定分光光度法》是现行有效的饲用植酸酶活性测定的国标方法,即GB/T 18634-2009。
本文以国标检测方法为依据。
1.2 测定原理依据国标检测方法,其原理为:植酸酶在一定温度和pH条件下,将底物植酸水解,生成正磷酸和肌醇衍生物。
在酸性溶液中,能与钒钼酸铵生成黄色的复合物,可于波长415 nm下进行比色测定[1]。
1.3 植酸酶活性单位酶活性单位定义为:样品在37 ℃、pH 5.5 的条件下,每分钟从浓度为5.0 mmol·L-1植酸钠溶液中释放出1 μmol 无机磷,即为一个植酸酶活性单位,以U 表示[1]。
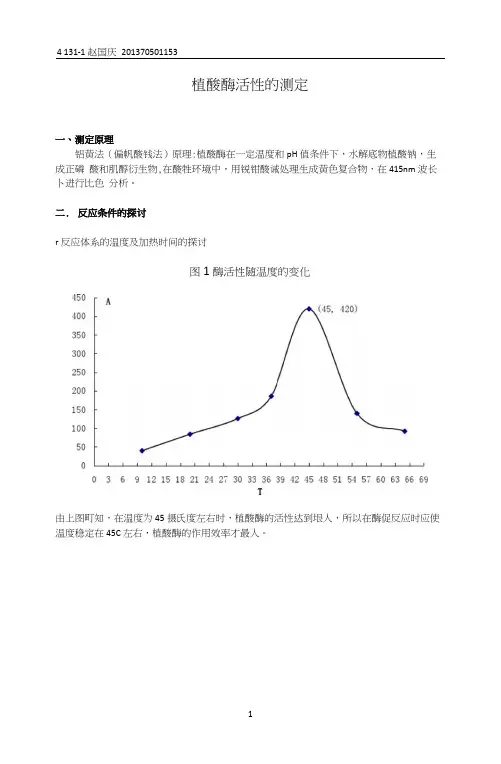
植酸酶活性的测定一、测定原理铝黄法(偏帆酸钱法)原理:植酸酶在一定温度和pH值条件下,水解底物植酸钠,生成正磷酸和肌醇衍生物,在酸牲环境中,用锐钳酸诫处理生成黄色复合物,在415nm波长卜进行比色分析。
二.反应条件的探讨r反应体系的温度及加热时间的探讨图1酶活性随温度的变化由上图町知,在温度为45摄氏度左右时,植酸酶的活性达到垠人,所以在酶促反应时应使温度稳定在45C左右,植酸酶的作用效率才最人。
2酶活性随pH变化pH由匕图可知,在PH为5左右时,植酸酶的活性达到最人,所以植酸酶缓冲液提供的的PH 环境应在5左右3、不同的离子及离子浓度对植酸稱活性的影响图3离子对酶活性的影响由上图町知,Ca离子和Na离子对酶的活性影响最小.Zn离子利Cu离子对酶的活•性抑制影响较大。
图4离子浓度对酶的影响Con圆点系列表示Cu"浓度对酶的活性的影响,随着浓度增加,酶的活性增加: 三角形系列表示Zn 2*浓度对酶活性的影响,随着Zn"浓度增加,酚的活性増加。
4、不同反应体系条件对植酸酶活性测定影响不同温度和PH 下的酶比活性变化3.64.2 55.86.87.2PH图5所示为正交实验时,不同温度和pH 的组介的条件下测得的植酸酚的比活性,在pH 为 5,温度在45C 左右时植酸酶活性达到最大。
酶比活性5.酶促反应时间的确定0 0.5 1 1.5 2 2.5 3 3.5 4 4.5 5 5.5 6 6.537rhr由上图町知,在05h以前,酶作用底物的速度呈直线关系.所以测定时反应的时间应该在30mm左右。
斜率=0.854523227相关性=0.997923599碱距=3.383740831根据上图町求得[S m]=2.53mmol/L7.酶的稳定性图8酶的稳定性time 由图町得,酶活性随时间而降低,故酚样品溶液需要现配现用三、实验步骤1、标准曲线的制作准确称取0.680g在105-C烘至恒朿的基准磷酸二氢钾()于100ml容最瓶中,用乙酸缓冲液溶解,并定容至刻度,浓度为50.0mmol/L按卜表的比例用乙酸缓冲液稀释成不同的浓度,与待测样-•起反应测定。

植酸酶活性的测定——钼蓝法1 原理针对预混料复杂的物料体系,用不同的缓冲液对其进行抽提,最大限度的减少饲料中无机磷,微量元素,多维及其他成分对植酸酶测定的影响,用钼蓝法对抽提液中植酸酶活性进行定量。
植酸酶在一定温度和pH条件下,水解底物植酸钠生成正磷酸和肌醇衍生物,在酸性环境中与钼酸铵显色剂反应生成蓝色的(Mo2O3•MoO3)复合物,在波长700nm下比色测定。
酶活力单位定义:在37℃、pH5.0条件下,每分钟从5.0mM植酸钠溶液中释放出1微摩尔的无机磷定义为1个酶活力单位(U)2 试剂本规定中所用试剂,在没有注明其它要求时,均指分析纯试剂;所用溶剂和水无注明时,均指蒸馏水。
清洗实验用容器不要用含磷清洗剂。
2.1 乙酸缓冲液A(0.25mol/L):称取14.355g无水乙酸钠,加入0.5gTriton X-100和0.5g牛血清白蛋白,900ml水溶解,冰乙酸调pH值至5.00±0.01,水定容至1000ml。
2.2乙酸缓冲液B(0.25mol/L):称取14.355g无水乙酸钠,加入1.0g吐温-20和30gEDTA,900ml水溶解,冰乙酸调pH值至5.00±0.01,水定容至1000ml。
2.3 植酸钠溶液(6.25mmol/L):称取577.4mg肌醇六磷酸钠,加入574.2mg无水乙酸钠,90ml水溶解,冰乙酸调pH值至5.00±0.01,水定容至100ml,现用现配(实际反应液中的最终浓度为5.0mmol/L)。
2.4 终止液:5%三氯乙酸(5%TCA)。
2.5 1.5%钼酸铵(试剂A):7.5g钼酸铵溶于400ml水中,慢慢加入22ml浓硫酸,水定容到500ml,冰箱储存,有效期1个月。
2.6 2.7%硫酸亚铁(试剂B):冰箱储存,有效期1个月。
2.7 显色剂:移取4份试剂A(2.5),1份试剂B(2.6)混合后使用,现用现配。
2.8 磷酸二氢钾:称量前于烘箱中烘至恒重,用乙酸缓冲液(2.2)配制50mmol/L标准液,再用50mmol/L 配制成4.0mmol/L磷酸二氢钾,溶剂为乙酸缓冲液(2.2),冰箱储存。

植酸酶活性测定的影响因素北京昕大洋科技发展有限公司周良娟现在,使用植酸酶的厂家越来越多,但一些使用厂家在测定含量时,容易出现测定偏差大,平行样间变异大的情况,这与植酸酶测定步骤繁多,测定条件严格有紧密的关系。
现在对影响其测定的关键过程做一探讨。
1 温度植酸酶作为一种酶制剂,对温度非常敏感,温度低会降低它的生物活性;温度高也会降低其生物活性,甚至完全失活。
因此,在检测过程中对温度的控制则显得非常重要,国标要求植酸酶活性测定时的温度为(37±0.1)℃。
在33℃时植酸酶不能很好地发挥其活性,酶活与其真实值相比约低10%;在40℃时,部分植酸酶会失活,酶活与其真实值相比约低8%。
另外,水浴加热时,水浴液面要超过试管内反应液液面,使其在规定时间内充分反应。
2 溶解度植酸酶测定中要保证植酸酶被完全溶解。
在样品处理中使用乙酸缓冲液,一般都会加入一些表面活性剂保证其溶解,并降低在所用容量瓶、试管中的黏附挂壁现象。
目前大肠杆菌来源的植酸酶分子量较小,约为40KD,比黑曲霉来源的分子量(约为8OKD)小,所以更容易出现黏附挂壁现象。
表面活性剂的类型较多,包括Tween ,Triton 等产品,尤其是Triton ×-100能够明显减少黏附挂壁现象,是植酸酶测定中比较理想的活性剂。
植酸酶在测定过程中被溶解之后,非常容易受测定过程中搅拌、离心等过程影响,牛血清白蛋白(BSA)是酶制剂良好的稳定剂,保证测定的准确性。
3 样品处理中的搅拌过程样品处理中的搅拌过程是为了保证植酸酶的充分溶出,搅拌过程一般使用磁力搅拌器来进行,如简单使用玻璃棒人工搅拌,溶出不完全,偏差甚至达到50%。
同时,搅拌时,尽量保证较高的搅拌速度。
4 pHpH值在酶活测定时影响很大,除了准确调整缓冲液中的PH外,特别要注意在配置底物溶液时也要进行调整。
根据本实验室的测定,如果底物配制过程没有调酸度4,pH一般为6.1-6.4,距离规定的pH条件较远,而植酸酶测定中pH影响较大,将无法保证测定的准确性。

2009年第20期从2009年10月1日起,GB/T 18634-2009《饲用植酸酶活性的测定———分光光度法》标准正式实施。
随着植酸酶的大规模应用,饲料企业如何选择和鉴别植酸酶产品的问题,已经成为使用者的当务之急。
在众多影响使用效果的因素中,产品本身的原因主要包括酶的种源、含量、温度稳定性、容重、pH 特性及体内水解效率等,其中酶活含量是最重要的质量指标。
GB/T 18634-2002《饲用植酸酶活性的测定———分光光度法》是在参考了AOAC 方法的基础上制定的,在国标颁布之初,由于市场上的植酸酶菌种相对单一,国标检测方法具有普遍的代表性,对植酸酶的生产、应用和检测起到了很好的指导作用。
随着植酸酶的逐渐普及,特别是在2004年以后,国内对植酸酶的研究开发进展迅速,有大量采用不同菌种发酵的植酸酶相继问世,GB/T18634-2002在检测新型植酸酶产品上显现出缺陷和不足,直接影响到检测结果的准确性。
这次标准的修订为植酸酶的制造、贸易、应用甚至纠纷仲裁、以及加酶饲料的质量控制和检测方法的统一都提供了充分的依据,也是植酸酶发挥效果的基本前提。
下面结合生产检测实际,谈谈新旧国标的主要区别:1缩小了方法的适用范围新标准(GB/T 18634-2009,以下同)适用范围删去原国标(GB/T 18634-2002,以下同)中规定的“添加有植酸酶的浓缩饲料和添加剂预混合饲料”。
修订为:“本标准适用于饲料添加剂用植酸酶产品、也适用于添加有植酸酶的配合饲料”。
预混合饲料、浓缩饲料中金属离子浓度高,成分复杂,对样品干扰大,随着样品保存时间的延长,酶的活性很不稳定,用现行的提取条件不能将酶活提取完全,检测结果不准确。
因此,新国标适用范围中去掉了“添加剂预混合饲料、浓缩饲料”,保留“添加剂用植酸酶产品、配合饲料”。
后两类产品按照新标准的方法检测均能达到较好结果。
2调整了最低检出限量和添加植酸酶的配合饲料样品两次试验的允许差方法最低定量限由原标准的“90U/g ”调整为“130U/g ”。

饲料中植酸酶活性测定方法探讨摘要:参照国标测定植酸酶活性的方法,研究了钼黄法和钼蓝法的稳定性及植酸酶活性测定时反应体系中缓冲液、pH值以及Cu、Zn、Mn金属离子对酶活性的影响。
结果表明:钼黄法与改进后的钼蓝法稳定性没有明显差异,但钼蓝法更适合微量磷的测定;柠檬酸盐缓冲液作为植酸酶酶解反应的缓冲体系时显色的稳定性较差;反应温度、pH及Cu、Zn金属离子对酶活性影响较大,测定植酸酶活性时需要严格控制反应条件,屏蔽金属离子的干扰。
关键词:饲料;植酸酶;活性;测定目前,植酸酶制剂在畜禽饲料生产中已得到广泛应用,但饲料中植酸酶活性的测定方法还存在一些争议。
2002年,国家颁布了饲用植酸酶活性的测定方法标准(GB/T 18634)2002),该标准注明其适用于饲料添加剂用的植酸酶产品,也适用于添加有植酸酶的配合饲料、浓缩饲料和添加剂预混合饲料,但配合饲料、浓缩饲料和添加剂预混合饲料成分显然更为复杂,其适用性受到质疑[1]。
因此,关于饲料中植酸酶活性测定方法问题有待进一步研究。
1 试验材料与方法1.1 主要仪器与设备电热恒温水浴锅(室温-100e,控温精度?1e)、离心机(最高转速6 000 r/min)、721型分光光度计、分析天平、pH计、磁力搅拌器、0. 22Lm微孔滤膜。
1.2 试剂1.2.1 偏钒酸铵-钼酸铵-硝酸显色液方法见GB/T 18634)2002。
1.2.2 盐酸-乙酸钠缓冲液方法见GB/T 18634)2002乙酸缓冲液(I)的配制。
1.2.3 磷标准溶液将磷酸二氢钾于105e恒温箱中干燥2 h,在干燥器中保存;称取磷酸二氢钾0. 020 3 g,溶解于蒸馏水中定容至100 ml。
1.2.4 植酸酶溶液方法见GB/T 18634)2002。
1.2.5 植酸钠溶液方法见GB/T 18634)2002。
1.2.6 硫酸-钼酸铵溶液量取20 ml浓硫酸(98% )于100 ml蒸馏水中,称取1. 500 g钼酸铵微热溶解于50 ml蒸馏水中,按比例混合待用。

植酸酶活性的测定——钼蓝法1 原理针对预混料复杂的物料体系,用不同的缓冲液对其进行抽提,最大限度的减少饲料中无机磷,微量元素,多维及其他成分对植酸酶测定的影响,用钼蓝法对抽提液中植酸酶活性进行定量。
植酸酶在一定温度和pH条件下,水解底物植酸钠生成正磷酸和肌醇衍生物,在酸性环境中与钼酸铵显色剂反应生成蓝色的(Mo2O3•MoO3)复合物,在波长700nm下比色测定。
酶活力单位定义:在37℃、pH5.0条件下,每分钟从5.0mM植酸钠溶液中释放出1微摩尔的无机磷定义为1个酶活力单位(U)2 试剂本规定中所用试剂,在没有注明其它要求时,均指分析纯试剂;所用溶剂和水无注明时,均指蒸馏水。
清洗实验用容器不要用含磷清洗剂。
2.1 乙酸缓冲液A(0.25mol/L):称取14.355g无水乙酸钠,加入0.5gTriton X-100和0.5g牛血清白蛋白,900ml水溶解,冰乙酸调pH值至5.00±0.01,水定容至1000ml。
2.2乙酸缓冲液B(0.25mol/L):称取14.355g无水乙酸钠,加入1.0g吐温-20和30gEDTA,900ml水溶解,冰乙酸调pH值至5.00±0.01,水定容至1000ml。
2.3 植酸钠溶液(6.25mmol/L):称取577.4mg肌醇六磷酸钠,加入574.2mg无水乙酸钠,90ml水溶解,冰乙酸调pH值至5.00±0.01,水定容至100ml,现用现配(实际反应液中的最终浓度为5.0mmol/L)。
2.4 终止液:5%三氯乙酸(5%TCA)。
2.5 1.5%钼酸铵(试剂A):7.5g钼酸铵溶于400ml水中,慢慢加入22ml浓硫酸,水定容到500ml,冰箱储存,有效期1个月。
2.6 2.7%硫酸亚铁(试剂B):冰箱储存,有效期1个月。
2.7 显色剂:移取4份试剂A(2.5),1份试剂B(2.6)混合后使用,现用现配。
2.8 磷酸二氢钾:称量前于烘箱中烘至恒重,用乙酸缓冲液(2.2)配制50mmol/L标准液,再用50mmol/L 配制成4.0mmol/L磷酸二氢钾,溶剂为乙酸缓冲液(2.2),冰箱储存。

饲用植酸酶活性的测定一、适用范围本标准规定了以分光光度法测定饲用植酸酶活性的方法。
适用于作饲料添加剂用的植酸酶产品,也适用于添加有植酸酶的配合饲料、浓缩饲料和添加剂预混合饲料。
样品最低检出量为90U/kg。
二、方法原理植酸酶在一定温度和pH条件下,水解低物植酸钠,生成正磷酸和肌醇衍生物,在酸性溶液中,用钒钼酸铵处理会生成黄色的[(NH4)3PO4NH4VO3·16MoO3]复合物,在波长415nm下进行比色测定。
三、试剂和溶液3.1乙酸缓冲液(I),c(CH3COONa·3H2O)为0.25mol/L:称取34.02g三水乙酸钠于1000 mL烧杯中,加入1000mL蒸馏水溶解,用冰乙酸调节pH至5.50±0.01。
室温下存放2个月有效。
3.2乙酸缓冲液(Ⅱ),c(CH3COONa·3H2O)为0.25mol/L:称取34.02g三水乙酸钠,0.5 g TritonX-100, 0.5g牛血清白蛋白于1000mL烧杯中,加入1000mL蒸馏水溶解,用冰乙酸调pH至5.50±0.01,室温下存放2个月有效。
3.3植酸钠溶液,c(C6H6O24P6Na12)为7.5mmol/L:称取0.6929g肌醇六磷酸钠(C6H6O24P6Na12)于100mL容量瓶中,用乙酸缓冲液(3.1)溶解并定容至刻度,现用现配(实际反应液中的最终浓度为5.0 mmol/L)。
3.4硝酸溶液:1+2水溶液。
3.5100g/L钼酸铵溶液:称取10g钼酸铵[(NH4)6Mo7O24·4H2O]于100mL。
容量瓶中,加入1.0mL 氨水(25%)用水溶解定容至刻度。
3.62.35 g/L钒酸铵溶液:称取0.235 g钒酸铵(NH4VO3)于100mL棕色容量瓶中,加入2 mL 硝酸溶液(3.4),用水溶解定容至刻度。
避光条件下保存一周有效。
3.7颜色终止液:移取2份硝酸溶液(3.4),1份钼酸铵溶液(3.5),1份钒酸铵溶液(3.6)混合后使用,现用现配。

固态发酵饲用植酸酶酶活的快速测定法
1. 引言
固态发酵饲用植酸酶酶活是非标准化和相互依存性的特性,广泛用于饲料行业,其功能受外界因素的影响,其不稳定性容易导致各种质量问题。
为了解决这一问题,本文提出一种快速、准确的固态发酵饲料植酸酶酶活测定方法。
2.材料与方法
2.1 试剂与仪器:蔗糖、脱水乳酸钠、无机盐混合物,热沉淀仪、加速器和水分热分析仪。
2.2 取样:采样样品的量必须在25-50g之间,通常在30g左右,应严格按程序要求获取样品。
2.3 准备实验室温度:将实验室温度调节到22-25℃,保持室内的温度稳定,保证测定的结果的可靠性和准确性。
2.4 酶活测定:将取样的样品置于热沉淀仪中,加入蔗糖和脱水乳酸钠,根据酶学原理,用加速器调节温度,在37℃~ 45℃温度下保持稳定温度进行搅拌20min,完成后改变用水温度冷却,把热水温度改变到4℃,再进行搅拌5min,然后用蒸馏水冲洗样品,取最后收集的液体放入无水盐混合物中,再用水分热分析仪测得样品的水分,由此算出酶活的数值。
3.结果
在经过上述步骤后,样品的固态发酵饲料植酸酶酶活结果为:82.4U/g,符合要求。
4.结论
通过本文提出的固态发酵饲料植酸酶酶活快速测定方法,操作简单,结果准确,可以有效解决固态发酵饲料行业中植酸酶酶活测定的问题。
国标绝对法测定植酸酶产品活性的关键控制点畜禽饲料中添加使用微生物发酵生产的植酸酶可提高植物性饲料中植酸及其盐的利用率, 减少日粮中磷酸氢钙等磷源的添加量, 降低饲料成本, 目前已经被广泛使用。
为了确保实际生产中植酸酶使用效果, 如何准确测定植酸酶产品的酶活性是养殖场、饲料企业和酶制剂生产、经销商所共同关注的问题。
目前, 国内植酸酶产品酶活性测定大多采用国家标准 GB/T 18643—2002《饲料用植酸酶活性的测定分光光度法》。
该方法标准中, 包括两种方法: 绝对法和相对法。
该测定方法的分析步骤不是很复杂, 所涉及的仪器设备饲料企业的实验室也都有配备, 但要获得准确和重复性好的分析结果也不容易, 需要加强对检测原理和步骤的理解。
该方法是基于样品在植酸钠浓度为 5.0 mmol/l、温度37 ℃、pH 值 5.50 条件下, 每分种从植酸钠中释放 1 μmol 无机磷,即为 1 个植酸酶活性(以 U 表示)的定义基础上测定的。
鉴于绝对法应用比较普遍, 现将我们在开展植酸酶产品活性测定过程中一些经验体会总结如下, 供同行们参考。
1 溶液配制植酸酶活性测定直接所用到的溶液主要有 3 种,即乙酸缓冲溶液、植酸钠底物溶液和显色终止液。
1.1 乙酸缓冲溶液国标方法中, 绝对法测定植酸酶产品酶活性所使用的乙酸缓冲溶液浓度为:c(CH3COONa·H2O)=0.25 mol/l。
缓冲溶液是确保整个酶反应体系的 pH 值在规定范围内的关键因素, 必须准确配制。
1.1.1 配制方法称取 34.02 g 三水乙酸钠,0.1 g 吐温 20 于 1 000 ml容量瓶中, 加入 900 ml 水溶解, 用乙酸调节 pH 值至!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!《饲料工业》·2008 年第 29 卷第 14 期检测技术475.50±0.01, 室温下贮存 2 个月有效。
饲用植酸酶活性的测定—分光光度法一、术语和定义在温度37℃、pH值5.50条件下,每分钟从浓度为5.0mmol/L植酸钠溶液中释放1mol无机磷,即为一个植酸酶活性单位,以U表示。
二、原理植酸酶在一定温度和pH条件下,将底物植酸钠水解,生成正磷酸和肌醇衍生物。
在酸性溶液中,能与钒钼酸铵生成黄色的复合物,可于波长415nm下进行比色测定。
三、试剂和材料除非另有说明,在分析中仅使用确认为分析纯的试剂和蒸馏水或去离子水或相当纯度的水。
清洗试验用器皿不要用含磷清洗剂。
1、磷酸二氢钾(KH2PO4):基准物。
2、乙酸缓冲液(I),c(CH3COONa)=0.25mol/L:称取34.02g三水乙酸钠于1000mL烧杯中,加入900mL水搅拌溶解,用冰乙酸调节pH值至5.50±0.01,再转移至1000mL容量瓶中,并用蒸馏水定容至刻度。
室温下存放2个月内有效。
3、乙酸缓冲液(Ⅱ),c(CH3COONa)=0.25mol/L:称取34.02g三水乙酸钠,0.5g曲拉通X-100(Triton X-100),0.5g牛血清白蛋白(BSA)于1000mL烧杯中,加入900mL水搅拌溶解,用冰乙酸调节pH值至5.50±0.01,再转移至1000mL容量瓶中,并用蒸馏水定容至刻度。
室温下存放2个月内有效。
4、底物溶液,c(C6H6O24P6Na12)=7.5mmol/L:称取0.69g植酸钠(C6H6O24P6Na12,相对分子质量为923.8,纯度为95%),精确至0.1mg,置于100mL烧杯中,用约80mL乙酸缓冲液I溶解,用冰乙酸调节pH值至5.50±0.01,转移至100mL容量瓶中,并用乙酸缓冲液I定容至刻度,现用现配(实际反应液中的最终浓度为5.0mmol/L)。
5、硝酸溶液:1+2水溶液。
6、钼酸铵溶液,100g/L:称取10g钼酸铵[(NH4)6Mo7O24·4H2O]于50mL烧杯中加水溶解,必要时可微加热,再转移至100mL容量瓶中,加入1.0mL氨水(25%)用水定容至刻度。
植酸酶活性最适条件测定一、实验目的1、掌握酶活力的测定方法以及影响酶活力的因素2、确定植酸酶活力的最佳条件二、实验原理植酸酶酶活性:样本在植酸钠浓度为5.0mol/L,温度37℃,pH5.5的条件下,每分钟从植酸钠中释放1µmol无极磷,即一个单位以U/ml或U/L计量。
植酸水解方程式:三、根据实验数据,通过作图分析得出植酸酶活性最佳条件1、酶活性随pH的变化由图可知当pH值5左右时酶活性最高,所以在该温度下植酸酶的最适pH在5左右。
2、离子对酶活性的影响通过柱形图可以看出,钾离子和镁离子的加入对酶活性几乎没有影响,加入钙离子和钠离子对酶活性具有促进作用,其中钙离子的作用大于钠离子,钙离子的加入是酶活性提高了大约50%,而锌离子和铜离子的加入对酶活性具有抑制作用。
3、酶活性随温度的变化通过酶活性随温度变化的曲线,得知酶的活性随温度升高而增大,当到达一定温度后,随温度增加而减小,曲线显示当温度为45℃左右时是植酸酶的最适温度。
4、酶的稳定性随时间的变化由实验数据作图知,植酸酶的稳定性随时间呈现指数下降的趋势,而且刚分离出的酶的稳定性最大。
5、双倒数曲线做出双倒数曲线,使1/ v 对1/[S]作图,可以获得一条直线。
从直线与x轴的截距可以得到1/Km的绝对值;而1/Vmax是直线与y轴的截距。
得Vm=0.2955 Km=0.25256、酶的初速度测定37℃酶醋的反应的速度随时间增大,且增大的越来越慢,最后接近恒定。
7、铜离子和锌离子浓度对酶的影响由离子对植酸酶的影响柱形图知,铜离子和锌离子对植酸酶的活性有抑制作用,通过数据分析得知,随着铜离子和锌离子浓度的提高,对植酸酶的活性抑制作用越明显。
科技信息植酸酶是催化植酸及植酸盐水解成肌醇与磷酸的一类酶的总称 [1]。
植酸酶是一种胞外酶 [2], 广泛存在于自然界中, 植物、动物、微生物均可产生植酸酶。
植酸酶的活性因来源不同而有差异。
植酸酶能将肌醇六磷酸 (植酸分解成为肌醇和磷酸。
植酸酶可以专一性地水解植酸中的磷酯键, 使磷酸游离出来, 植酸酶将植酸分子上的磷酸基团逐个切下, 形成中间产物肌醇五磷酸、肌醇四磷酸、肌醇三磷酸、肌醇二磷酸、肌醇一磷酸、终产物为肌醇和磷酸 [3]。
植酸酶的作用机理见图 1。
图 1植酸酶的作用机理1. 植酸酶酶活力测定的意义酶活力也称酶活性, 是指酶催化一定化学反应的能力, 用在一定条件下, 酶所催化某一反应的速率表示。
酶活性是研究酶的特性, 分离纯化以及酶制剂生产和应用时的一项不可缺少的指标。
酶活力单位是以酶活力为根据而定义的。
国际生化协会酶委员会规定, 1min 内将1μmol 的底物转化为产物的酶量定为 1个单位,称为标准单位, 同时规定了酶作用的条件。
因标准单位在实际应用时不够方便, 故在生产上往往根据不同的酶, 制定各自不同的酶活力单位。
在测定酶活力时, 对反应温度、 pH 、底物浓度、作用时间都有统一规定, 以便同类产品互相比较。
但是酶活力单位并不能直接反映酶的绝对数量, 只不过是一种相对比较的依据 [4]。
植酸酶活性的定义为:在最适宜条件下, 每分钟从一定浓度的植酸钠溶液中释放1μmol 的无机磷所需要的酶量为一个酶活力单位。
确定植酸酶的酶活, 可以提高实验的标准性和效率。
2. 植酸酶活力测定的原理及方法酶活力测定的原理都是利用酶水解植酸钠形成无机磷,然后测定无机磷的释放量。
植酸酶活性的测定方法较多 , 但至今尚没有被世界普遍公认的植酸酶的定量分析方法。
方法包括:钒 -钼酸铵法、硫酸亚铁 -钼蓝法、 Vc-钼蓝法、丙酮 -磷钼酸铵法、微板法和微量比色法等 [5]。
可根据实验需要选择不同的方法。
2.1钒 -钼酸铵法该方法是利用植酸酶可以水解植酸磷释放出无机磷的原理。
植酸酶活性测定的影响因素
北京昕大洋科技发展有限公司周良娟
现在,使用植酸酶的厂家越来越多,但一些使用厂家在测定含量时,容易出现测定偏差大,平行样间变异大的情况,这与植酸酶测定步骤繁多,测定条件严格有紧密的关系。
现在对影响其测定的关键过程做一探讨。
1 温度
植酸酶作为一种酶制剂,对温度非常敏感,温度低会降低它的生物活性;温度高也会降低其生物活性,甚至完全失活。
因此,在检测过程中对温度的控制则显得非常重要,国标要求植酸酶活性测定时的温度为(37±0.1)℃。
在33℃时植酸酶不能很好地发挥其活性,酶活与其真实值相比约低10%;在40℃时,部分植酸酶会失活,酶活与其真实值相比约低8%。
另外,水浴加热时,水浴液面要超过试管内反应液液面,使其在规定时间内充分反应。
2 溶解度
植酸酶测定中要保证植酸酶被完全溶解。
在样品处理中使用乙酸缓冲液,一般都会加入一些表面活性剂保证其溶解,并降低在所用容量瓶、试管中的黏附挂壁现象。
目前大肠杆菌来源的植酸酶分子量较小,约为40KD,比黑曲霉来源的分子量(约为8OKD)小,所以更容易出现黏附挂壁现象。
表面活性剂的类型较多,包括Tween ,Triton 等产品,尤其是Triton ×-100能够明显减少黏附挂壁现象,是植酸酶测定中比较理想的活性剂。
植酸酶在测定过程中被溶解之后,非常容易受测定过程中搅拌、离心等过程影响,牛血清白蛋白(BSA)是酶制剂良好的稳定剂,保证测定的准确性。
3 样品处理中的搅拌过程
样品处理中的搅拌过程是为了保证植酸酶的充分溶出,搅拌过程一般使用磁力搅拌器来进行,如简单使用玻璃棒人工搅拌,溶出不完全,偏差甚至达到50%。
同时,搅拌时,尽量保证较高的搅拌速度。
4 pH
pH值在酶活测定时影响很大,除了准确调整缓冲液中的PH外,特别要注意在配置底物溶液时也要进行调整。
根据本实验室的测定,如果底物配制过程没有调酸度4,pH一般为6.1-6.4,距离规定的pH条件较远,而植酸酶测定中pH影响较大,将无法保证测定的准确性。
5 底物植酸钠的型号
植酸钠有两种型号,一种是Sigma p-3168或Sigma p-0109,分子量为923.8;另一种是Sigma p-8810,分子量为660.03。
根据国标要求,植酸
钠应为Sigma p-3168或Sigma p-0109,笔者在实验中发现Sigma p-3168或Sigma p-0109植酸钠底色浅,且作磷标准曲线时梯度较好(见表1、表2)。
由表1、表2可以看出检测植酸酶活性时用Sigma p-3168为反应底物较好。
6 离心速度和时间
当水浴30min终止酶解反应后,需要进行离心。
国标要求4 000r/min,离心10min。
若以3 000r/min离心10min,则离心不彻底,测吸光度时发现标准曲线吸光度不呈梯度;以5 000r/min离心10min时,发现标准曲线各梯度的吸光度与以4 000r/min离心10min时相比偏低。
如果应用国标改进法,乙酸缓冲液中加入了牛血清白蛋白,离心时间需要15min。
有实验表明,用国标改进法进行了时间对比实验,测定酶活时离心10min和15min后样品的吸光度(见表3)。
由表3可见,离心时间对测定结果影响很大。
7 公式换算
在整个实验过程中即使做得再成功,若公式换算出错,将会前功尽弃。
植酸酶绝对法测定酶活时,计算公式如下:
植酸酶活性(U/g)= (C×F/m×30)
式中:C——根据实际样液的吸光值由曲线回归方程计算出的y值(U);
F——试样溶液反应前的总稀释倍数;
m——试样质量(g);
30——反应时间(min)。
其中F所代表的总稀释倍数换算时容易出现错误,现在我们举例说明:称取500IU植酸酶1.000 0g,用乙酸缓冲液溶解并稀释定容至100ml,从其中取出1ml继续稀释至12.5ml,稀释倍数为1 250;若称取1 000IU植酸酶0.500
0g,用上述方法进行稀释,则稀释倍数为2 500,计算时若写成C × 2
500/0.500 0× 30则错误,这样就多乘了2倍。
应写成C × 1 250/0.500 0×30,这是在公式换算时应注意的问题。