植酸酶活性的测定——钼蓝法(精)
- 格式:doc
- 大小:67.00 KB
- 文档页数:5





科技信息植酸酶是催化植酸及植酸盐水解成肌醇与磷酸的一类酶的总称 [1]。
植酸酶是一种胞外酶 [2], 广泛存在于自然界中, 植物、动物、微生物均可产生植酸酶。
植酸酶的活性因来源不同而有差异。
植酸酶能将肌醇六磷酸 (植酸分解成为肌醇和磷酸。
植酸酶可以专一性地水解植酸中的磷酯键, 使磷酸游离出来, 植酸酶将植酸分子上的磷酸基团逐个切下, 形成中间产物肌醇五磷酸、肌醇四磷酸、肌醇三磷酸、肌醇二磷酸、肌醇一磷酸、终产物为肌醇和磷酸 [3]。
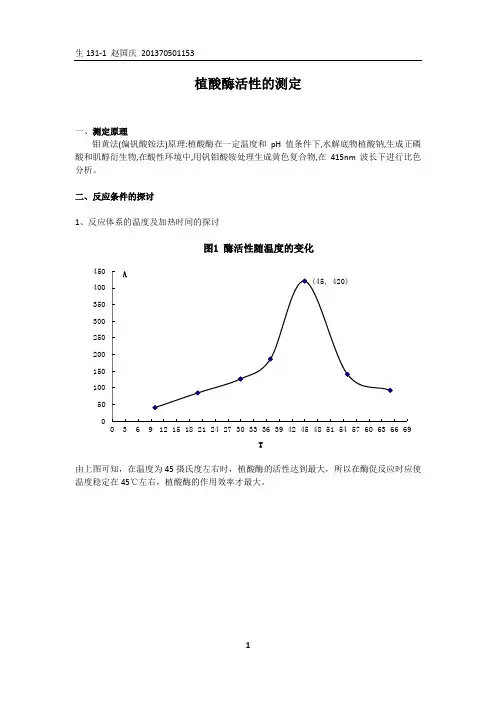
植酸酶的作用机理见图 1。
图 1植酸酶的作用机理1. 植酸酶酶活力测定的意义酶活力也称酶活性, 是指酶催化一定化学反应的能力, 用在一定条件下, 酶所催化某一反应的速率表示。
酶活性是研究酶的特性, 分离纯化以及酶制剂生产和应用时的一项不可缺少的指标。
酶活力单位是以酶活力为根据而定义的。
国际生化协会酶委员会规定, 1min 内将1μmol 的底物转化为产物的酶量定为 1个单位,称为标准单位, 同时规定了酶作用的条件。
因标准单位在实际应用时不够方便, 故在生产上往往根据不同的酶, 制定各自不同的酶活力单位。
在测定酶活力时, 对反应温度、 pH 、底物浓度、作用时间都有统一规定, 以便同类产品互相比较。
但是酶活力单位并不能直接反映酶的绝对数量, 只不过是一种相对比较的依据 [4]。
植酸酶活性的定义为:在最适宜条件下, 每分钟从一定浓度的植酸钠溶液中释放1μmol 的无机磷所需要的酶量为一个酶活力单位。
确定植酸酶的酶活, 可以提高实验的标准性和效率。
2. 植酸酶活力测定的原理及方法酶活力测定的原理都是利用酶水解植酸钠形成无机磷,然后测定无机磷的释放量。
植酸酶活性的测定方法较多 , 但至今尚没有被世界普遍公认的植酸酶的定量分析方法。
方法包括:钒 -钼酸铵法、硫酸亚铁 -钼蓝法、 Vc-钼蓝法、丙酮 -磷钼酸铵法、微板法和微量比色法等 [5]。
可根据实验需要选择不同的方法。
2.1钒 -钼酸铵法该方法是利用植酸酶可以水解植酸磷释放出无机磷的原理。

中国饲料2010年第20期植酸酶广泛存在于动物、植物和微生物中,能将植酸分解为肌醇和无机磷的一类磷酸单脂水解酶。
文章介绍了植酸酶活性的测定方法,除了以前的传统方法外,近10多年植酸酶活性检测出现了许多新的方法,如近红外光谱法、琼脂平板法、酶联免疫吸附法、生物传感器法、高效液相色谱法等,这些新方法为植酸酶活性测定开辟了新的检测途径。
1植酸酶活性测定方法的发展及意义1.1植酸酶活性测定方法的发展植酸酶发现至今已经有100余年,植酸酶的研究已经取得了丰硕的成果。
回顾植酸酶活性的测定方法:1925年Fiske-SubbaRow法,即钼黄法,因由Fiske和SubbaRow两人发现,所以早期钼黄法也叫Fiske-SubbaRow法;1943年Holman等发现了硫酸亚铁-钼蓝法,曾在国外许多国家发展为植酸酶测定的标准方法,至今还在许多研究中采用(Fu等,2008;Huang等,2008);1981年Heinonen和Lahti 建立了丙酮-磷钼酸铵法。
植酸酶活性的测定方法除了这些传统的方法外,近10多年来随着科学技术和检测手段的提高,植酸酶活性分析检测及标准化方面出现了许多新的方法,并颁布了新的标准,如近红外光谱法(NIR)、琼脂平板法、酶联免疫吸附法(ELISA)、生物传感器法、反相高效液相色谱法(RP-HPLC)等。
1.2植酸酶活性测定意义植酸酶没有特定光吸收波和鉴定试剂,所以植酸酶的分析和活性测定比较困难(Lasztity等,1990)。
动、植物植酸酶的提取、分离纯化,微生物植酸酶菌株的筛选,基因工程植酸酶表达产物等研究中都需要测定植酸酶活性。
随着植酸酶在饲料中的广泛应用,饲料管理部门、饲料质检机构、科研部门以及生产企业均面临植酸酶定量测定的工作。
目前存在着植酸酶酶活单位混乱、检测手段落后,测定结果误差大等一些问题,所以规范植酸酶酶活性定义和检测方法势在必行。
植酸酶活性的定义方法主要有以下几种:(1)酶活定义为每分钟从一定浓度的植酸钠溶液中释放1μmol的无机磷为一个酶活单位。

植酸酶活性的测定——钼蓝法1 原理针对预混料复杂的物料体系,用不同的缓冲液对其进行抽提,最大限度的减少饲料中无机磷,微量元素,多维及其他成分对植酸酶测定的影响,用钼蓝法对抽提液中植酸酶活性进行定量。
植酸酶在一定温度和pH条件下,水解底物植酸钠生成正磷酸和肌醇衍生物,在酸性环境中与钼酸铵显色剂反应生成蓝色的(Mo2O3•MoO3)复合物,在波长700nm下比色测定。
酶活力单位定义:在37℃、pH5.0条件下,每分钟从5.0mM植酸钠溶液中释放出1微摩尔的无机磷定义为1个酶活力单位(U)2 试剂本规定中所用试剂,在没有注明其它要求时,均指分析纯试剂;所用溶剂和水无注明时,均指蒸馏水。
清洗实验用容器不要用含磷清洗剂。
2.1 乙酸缓冲液A(0.25mol/L):称取14.355g无水乙酸钠,加入0.5gTriton X-100和0.5g牛血清白蛋白,900ml水溶解,冰乙酸调pH值至5.00±0.01,水定容至1000ml。
2.2乙酸缓冲液B(0.25mol/L):称取14.355g无水乙酸钠,加入1.0g吐温-20和30gEDTA,900ml水溶解,冰乙酸调pH值至5.00±0.01,水定容至1000ml。
2.3 植酸钠溶液(6.25mmol/L):称取577.4mg肌醇六磷酸钠,加入574.2mg无水乙酸钠,90ml水溶解,冰乙酸调pH值至5.00±0.01,水定容至100ml,现用现配(实际反应液中的最终浓度为5.0mmol/L)。
2.4 终止液:5%三氯乙酸(5%TCA)。
2.5 1.5%钼酸铵(试剂A):7.5g钼酸铵溶于400ml水中,慢慢加入22ml浓硫酸,水定容到500ml,冰箱储存,有效期1个月。
2.6 2.7%硫酸亚铁(试剂B):冰箱储存,有效期1个月。
2.7 显色剂:移取4份试剂A(2.5),1份试剂B(2.6)混合后使用,现用现配。
2.8 磷酸二氢钾:称量前于烘箱中烘至恒重,用乙酸缓冲液(2.2)配制50mmol/L标准液,再用50mmol/L 配制成4.0mmol/L磷酸二氢钾,溶剂为乙酸缓冲液(2.2),冰箱储存。


饲料中植酸酶活性测定方法探讨摘要:参照国标测定植酸酶活性的方法,研究了钼黄法和钼蓝法的稳定性及植酸酶活性测定时反应体系中缓冲液、pH值以及Cu、Zn、Mn金属离子对酶活性的影响。
结果表明:钼黄法与改进后的钼蓝法稳定性没有明显差异,但钼蓝法更适合微量磷的测定;柠檬酸盐缓冲液作为植酸酶酶解反应的缓冲体系时显色的稳定性较差;反应温度、pH及Cu、Zn金属离子对酶活性影响较大,测定植酸酶活性时需要严格控制反应条件,屏蔽金属离子的干扰。
关键词:饲料;植酸酶;活性;测定目前,植酸酶制剂在畜禽饲料生产中已得到广泛应用,但饲料中植酸酶活性的测定方法还存在一些争议。
2002年,国家颁布了饲用植酸酶活性的测定方法标准(GB/T 18634)2002),该标准注明其适用于饲料添加剂用的植酸酶产品,也适用于添加有植酸酶的配合饲料、浓缩饲料和添加剂预混合饲料,但配合饲料、浓缩饲料和添加剂预混合饲料成分显然更为复杂,其适用性受到质疑[1]。
因此,关于饲料中植酸酶活性测定方法问题有待进一步研究。
1 试验材料与方法1.1 主要仪器与设备电热恒温水浴锅(室温-100e,控温精度?1e)、离心机(最高转速6 000 r/min)、721型分光光度计、分析天平、pH计、磁力搅拌器、0. 22Lm微孔滤膜。
1.2 试剂1.2.1 偏钒酸铵-钼酸铵-硝酸显色液方法见GB/T 18634)2002。
1.2.2 盐酸-乙酸钠缓冲液方法见GB/T 18634)2002乙酸缓冲液(I)的配制。
1.2.3 磷标准溶液将磷酸二氢钾于105e恒温箱中干燥2 h,在干燥器中保存;称取磷酸二氢钾0. 020 3 g,溶解于蒸馏水中定容至100 ml。
1.2.4 植酸酶溶液方法见GB/T 18634)2002。
1.2.5 植酸钠溶液方法见GB/T 18634)2002。
1.2.6 硫酸-钼酸铵溶液量取20 ml浓硫酸(98% )于100 ml蒸馏水中,称取1. 500 g钼酸铵微热溶解于50 ml蒸馏水中,按比例混合待用。

饲用植酸酶活性的测定分光光度法1范围本标准规定了以分光光度法测定饲用植酸酶活性的方法。
本标准适用于作饲料添加剂用的植酸酶产品,也适用于添加有植酸酶的配合饲料、浓缩饲料和添加剂预混合饲料。
样品最低检出量为90U/kg。
2 引用标准下列标准所包含的条文,通过在本标准中引用而构成为本标准的条文。
本标准出版时,所示版本均为有效。
所有标准都会被修订,使用本标准的各方应探讨使用下列标准的最新版本的可能性。
GB/T 6682—1992 分析实验室用水规格和试验方法(neq ISO 3696:1987)3 植酸酶活性单位定义样品在植酸钠浓度为5.0 mmol/L、温度37℃、PH值5.00的条件下,每分钟从植酸钠中释放1μmol无机磷,即为一个植酸酶活性单位,以U表示。
4 方法原理植酸酶在一定温度和pH条件下,水解底物植酸钠,生成正磷酸和肌醇衍生物,在酸性溶液中,用钒钼酸铵处理会生成黄色的[(NH4)3PO4NH4VO3·16MoO3]复合物,在波长415nm 下进行比色测定。
5 试剂和溶液本标准中所用试剂,在没有注明其他要求时,均指分析纯试剂和符合GB/T 6682中规定的三级水。
清洗试验用容器不要用含磷清洗剂。
5.1 0.25mol/L 乙酸缓冲液(I)称取34.02g三水乙酸钠于1000mL容量瓶中,加入900mL水溶解,用冰醋酸调节pH至5.00±0.01,并用蒸馏水定容至1000mL,室温下存放2个月有效。
5.2 0.25mol/L乙酸缓冲液(Ⅱ)称取34.02g三水乙酸钠,0.5g TritonX-100,0.5g牛血清白蛋白(BSA)于1000mL容量瓶中,加入900mL水溶解,用冰醋酸调节pH至5.00±0.01,并用蒸馏水定容至1000mL,室温下存放2个月有效。
5.3 7.5mmol/L植酸钠溶液 c(C6H6O24P6Na12)为7.5mmol/L称取0.6929g肌醇六磷酸钠(C6H6O24P6Na12)于100mL。
目录摘要 (2)Abstract (2)1前言 (4)2酶活定义 (6)3样品 (6)4试剂及溶液 (6)4.1试剂 (6)4.2溶液 (7)5实验仪器及设备 (8)6实验方法 (8)6.1植酸酶标准曲线的绘制 (8)6.2发酵前面粉中植酸酶活性的测定 (9)6.3发酵后面粉中植酸酶活性的测定 (10)7结果分析 (10)7.1植酸酶标准曲线的获得 (10)7.2 测定发酵前面粉中植酸酶活性 (11)7.3 测定发酵后面粉中植酸酶活性 (12)7.4发酵前后面粉中植酸酶活性的比较 (13)8重现性实验 (19)9讨论 (20)10结论 (21)总结与体会 (22)致谢词 (23)参考文献 (24)摘要植酸酶是一类特殊的催化剂,能将食品和饲料中植酸及其盐转化为可供有机体利用的有效磷,降低粪便中的磷含量,减轻对环境的污染,改善营养成分的吸收和利用[1]。
但它会因为其天然结构遭到修饰而丧失活性,植酸酶结构上的微小改变可以大大改变其与目标底物(即植酸)的结合能力[2]。
这些蛋白质发挥功能时所处的环境对其特性也非常关键, 因为它们对诸如温度和pH 值等因素高度敏感[2]。
本实验采用钒一钼酸铵法,既利用植酸酶可以水解植酸钠释放出无机磷的原理。
通过加入酸性钒-钼酸铵试剂使水解反应停止,同时与水解释放出来的无机磷产生颜色反应,形成黄色的[(NH4)3PO4NH4VO3.16MoO3]复合物在415 nm波长下测定磷的含量。
以标准植酸酶为参照物,间接计算被测样品中植酸酶的含量[3]。
摘要应包括主要的实验目的方法结果结论【关键词】面粉发酵钼蓝比色法植酸酶AbstractPhytase is a special kind of catalyst.It will chang phytic acid and its salts in food and feed into available phosphorus to meet the need of organisms,reduce the phosphorus content in the manure and the pollution of the environment, improve the absorption and use of nutrients . But because its natural structure was modified, it will loss its activity. The small chang in the structure can greatly chang the ability to combine with phytic acid. When these proteins function works, the environment is also very critical of their properties, because they are highly sensitive to temperature and pH .This study used a V-ammonium molybdate, which is the principle that phytase can hydrolyze sodium-sik to release inorganic phosphorus. Acidic vanadium - ammonium molybdate reagents joined can hydrolysis stop, and then generate a color reaction with hydrolysis of inorganic phosphorus released, and produce a yellow [(NH4)3PO4NH4VO3 .16MoO3] complex in the 415 nm wavelength of the phosphorus content . Content of phytase in the samples tested can be indirect calculated by a standard reference for the phytase.Keywords:wheat flour Fermentation Molybdenum bluecolor method phytase1 前言磷在植物中的主要存在形式为植酸磷,植酸磷不能被单胃动物直接利用,从而造成磷源浪费和形成高磷粪便污染环境。
对发酵生产植酸酶过程中植酸酶活性测定方法的初步探讨佚名
【期刊名称】《《中外食品加工技术》》
【年(卷),期】2003(000)012
【摘要】以钼蓝法、钼钒法 ,对标准磷溶液和发酵液中的植酸酶酶活进行了测定 ,并研究了影响测定结果的各个因素。
结果表明 ,钼蓝法、钼钒法均可用于植酸酶酶活的测定 ,且同样有效 ,但钼钒法相对快速、简便。
研究中同时发现 ,发酵过程中发酵液含有的无机磷远远大于酶活测定产生的无机磷含量 ,直接用发酵液测得的植酸酶酶活是不可靠的。
文中采用发酵液透析后测定酶活。
【总页数】1页(P72)
【正文语种】中文
【相关文献】
1.玉米子粒植酸酶活性测定方法研究 [J], 刘娜;李静;柳鸿敏;盖春宇;于壮;张明
2.饲料中植酸酶活性测定方法探讨 [J], 万丹;周琪;钮海华;齐德生;张妮娅
3.对发酵生产植酸酶过程中植酸酶活性测定方法的初步探讨 [J], 杨平平;王燕;史宝军;陶文沂
4.发酵液中植酸酶活性测定方法的研究 [J], 洒荣波;唐瑜菁
5.小麦在发芽过程中植酸酶活性变化探讨 [J], 兰云贤;林鹏;王宝全;郑碧玉
因版权原因,仅展示原文概要,查看原文内容请购买。
植酸酶活性的测定——钼蓝法1 原理针对预混料复杂的物料体系,用不同的缓冲液对其进行抽提,最大限度的减少饲料中无机磷,微量元素,多维及其他成分对植酸酶测定的影响,用钼蓝法对抽提液中植酸酶活性进行定量。
植酸酶在一定温度和pH条件下,水解底物植酸钠生成正磷酸和肌醇衍生物,在酸性环境中与钼酸铵显色剂反应生成蓝色的(Mo2O3•MoO3)复合物,在波长700nm下比色测定。
酶活力单位定义:在37℃、pH5.0条件下,每分钟从5.0mM植酸钠溶液中释放出1微摩尔的无机磷定义为1个酶活力单位(U)2 试剂本规定中所用试剂,在没有注明其它要求时,均指分析纯试剂;所用溶剂和水无注明时,均指蒸馏水。
清洗实验用容器不要用含磷清洗剂。
2.1 乙酸缓冲液A(0.25mol/L):称取14.355g无水乙酸钠,加入0.5gTriton X-100和0.5g牛血清白蛋白,900ml水溶解,冰乙酸调pH值至5.00±0.01,水定容至1000ml。
2.2乙酸缓冲液B(0.25mol/L):称取14.355g无水乙酸钠,加入1.0g吐温-20和30gEDTA,900ml水溶解,冰乙酸调pH值至5.00±0.01,水定容至1000ml。
2.3 植酸钠溶液(6.25mmol/L):称取577.4mg肌醇六磷酸钠,加入574.2mg无水乙酸钠,90ml水溶解,冰乙酸调pH值至5.00±0.01,水定容至100ml,现用现配(实际反应液中的最终浓度为5.0mmol/L)。
2.4 终止液:5%三氯乙酸(5%TCA)。
2.5 1.5%钼酸铵(试剂A):7.5g钼酸铵溶于400ml水中,慢慢加入22ml浓硫酸,水定容到500ml,冰箱储存,有效期1个月。
2.6 2.7%硫酸亚铁(试剂B):冰箱储存,有效期1个月。
2.7 显色剂:移取4份试剂A(2.5),1份试剂B(2.6)混合后使用,现用现配。
2.8 磷酸二氢钾:称量前于烘箱中烘至恒重,用乙酸缓冲液(2.2)配制50mmol/L标准液,再用50mmol/L 配制成4.0mmol/L磷酸二氢钾,溶剂为乙酸缓冲液(2.2),冰箱储存。
3 仪器设备恒温水浴锅,分光光度计(有10mm比色皿),磁力搅拌器,涡流式混合器,酸度计(精确至小数点后两位),离心机(最高转速4,000rpm以上),其它实验室常用设备。
4 标准曲线绘制将4.0mmol/L磷酸二氢钾标准溶液用乙酸缓冲液(2.2)稀释成0.0、0.8、1.6、2.4、3.2、4.0mmol/L 的溶液,按表1的操作步骤一起反应。
以无机磷含量为纵坐标(0.2ml以上稀释液无机磷含量分别为:0.00、0.16、0.32、0.48、0.64、0.80μmol),以吸光值为横坐标,绘制标准曲线,列出直线回归方程(Y=K X+B)。
5 样品测定5.1 试样溶液的制备建议称取5-10g含酶饲料,精确至0.01g,置于100mL容量瓶中,加入乙酸缓冲液(2.1)定容(之前需充分搅拌20min),取其中2-10ml置于另一100ml容量瓶中用乙酸缓冲液(2.2)定容。
稀释的最终结果应使样液浓度保持在0.02-0.06U/mL.左右,待反应。
5.2 反应按下面的反应顺序进行操作,在反应过程中,从加入底物(2.3)开始,向每支管中加入试剂的时间间隔要绝对一致,37℃保温30min 。
反应步骤及试剂、溶液用量见表A1。
A5.3 样品测定反应后的试样在室温下静置10min ,如出现混浊需在离心机上以4,000rpm 离心10min ,上清液以标准空白调零,在分光光度计700nm 波长处测定样品空白(A 0)和样品溶液(A )的吸光值,A -A 0为实测吸光值。
用直线回归方程计算样品植酸酶的活性。
A6 结果计算和表示植酸酶活性U 按下式计算:U = ×F其中:U ——样品植酸酶活性,U/g ; K ——标准曲线斜率;F ——样品溶液反应前的总稀释倍数; S ——样品测试量,表1中S =0.2ml ; V ——反应总体积,表1中V=1ml ; m ——试样质量,g ;A 0——测定样品空白吸光值; A ——样品溶液吸光值; 30——反应时间,min 。
两个平行样品的测定结果用算术平均值表示,保留整数。
A7 允许差同一样品两个平行测定值的相对偏差不大于8%。
K ×(A -A 0)×V S ×m ×30Determination of Phytase Activity——Molybdate-Blue MethodA1. PRINCIPLEDetermination of phytase activity is based on the colorimetrical reaction between ammonium molybdate and free phosphorus which released from by the hydrolysis of phytate. The product solution painted in blue is measured by spectrophotometer at a wave-length 700nm, the measured absorbency quantificates with the amount of free phosphorus.1 unit of phytase activity (U)is the amount of enzyme which releases 1 umol inorganic orthophosphate from substrate (sodium phytate ,50mM) at the temperature 37℃and pH5.0 in 1 minute.A2. REAGENTSAll the reagents used must be analytical prue. Detergents containing phosphate should not be used in washing container.A2.1. Water—Distilled water, or equivalent.A2.2. Buffer solution (0.1 mol/L)—Dissolve 5.742 g sodium acetic acid, 0.5 g Triton X-100 and0.5 g bovine serum albumin in 900 mL water; adjust to pH 5.0 with acetic acid (100%),and dilute to 1 L with water.A2.3. Substrate solution—Dissolve 577.4 mg sodium phytate (C6H6O24P6Na12) from rice (Cat.No. P-3168, Sigma Chemical Co., St. Louis, MO) and 574.2 mg sodium acetic acid in 90 mL water, adjust the pH to 5.0 with acetic acid (100%), and dilute to 100 mL with water.Prepare this solution fresh daily.A2.4. Reaction stop solution—Trichloroacetic acid (5%).A2.5. Ammonium heptamolybdate solution (Solution A)—Dissolve 7.5 g ammonium heptamolybdate (N6H24Mo7O24.4H2O) in 400 mL distilled water, slowly add 22 mL sulfuric acid (98%), and dilute to 500 mL with water. This solution may be kept at 4℃shielded from light for 1 month.A2.6. Ferrous sulfate solution (Solution B)—Ferrous sulfate (2.7%). This solution may be kept at 4℃ and shielded from light for 1 month.A2.7. Color solution—Mix 100 mL solution A and 25 mL solution B. Prepare this solution fresh daily.A2.8. Potassium dihydrogen phosphate stock solution—Prepare potassium dihydrogen phosphate to constant weight at 60℃ before dissolving it to a final concentration of 4.0mmol/L using buffer solution (A2.2). Prepare this solution fresh daily.A3. APPARATUSA3.1. Waterbath: thermostatically controlled to 37.0 ± 0.1℃ by circulating water.A3.2. Ultraviolet-visible spectrophotometerA3.3. Centrifuge: can be used at a relative centrifugal force of 3000gA3.4. pH meterA4. PREPARATION OF STANDARD SOLUTIONS AND CURVEPrepare working standards of 0.0、0.8、1.6、2.4、3.2、4.0mmol/L potassium dihydrogen phosphate solution by serial dilution of stock solution (A2.8). Carry out the procedure which described in Table A1, and then plot the absorbance difference of the standard solutions (X-axis) against the corresponding exactly calculated amount of potassium dihydrogen phosphate (Y-axis). Draw the best fitting curve through the origin and give the regression equation (Y=K X+B).A5. PREPARATION OF SAMPLEIt is suggested that weithted 5-10g enzyme sample ,place it in a volumetric of 100mL, adjust the volume to the mark by the acetate buffer solution and mix thoroughly.Dilute the weighted sample in duplicate (sample and blank) with buffer solution to the phytase activity within 0.03-0.08 U/mL.A standard sample with exactly calculated activity is recommended to be determined as the same procedure to test the accuracy.A6. ASSAYThe assay is carried out according to the procedure in Table A1. In this procedure, interval of adding reagents to every tube should be the same after the substrate adding to the reaction solution.Centrifuge all the tubes for 10 min at 4,000 rpm before standing for 10 min at room temperature. Measure the absorbance of sample (A)and its blank (A0)at 700 nm with the spectrophotometer after zeroing the instrument with standards blank of. Determine the enzyme activity by reading the corrected absorbance difference for the sample (A-A0) and calculating the released phosphorus.A7. Treatment (analysis) of resultsActivity of sample (U) is calculated according to the formula:K×(A-A0)×VU = ×FS×m×30Where:U——Activity of sample,U/g;K——Slope of standard curve;F——Dilution multiple;S——volume of reaction solution of sample, S=0.2 (mL) in Table A1;V——volume of reaction solution, V=1 mL in Table A1;m——Sample weight, g;30——Time of reaction, min.The final result is from two average values, and should be expressed by whole number. A8. DEVIATION PERMITTEDThe relative deviation of two parallel values from one sample should be no more than 8%.。