第十三章不饱和醛酮及取代醛酮
- 格式:doc
- 大小:1017.50 KB
- 文档页数:14

第十三章醛和酮(一) 醛和酮的命名(二) 醛和酮的结构(三) 醛和酮的制法(四) 醛和酮的物理性质(五) 醛和酮的化学性质(六) α,β-不饱和醛、酮的特性(七) 乙烯酮卡宾第十三章醛和酮分类:①根据烃基的不同,可将醛、酮分为:脂肪族醛、酮,芳香族醛、酮;饱和醛、酮,不饱和醛、酮;②根据醛、酮分子中羰基的个数,可分为:一元醛、酮,二元醛、酮等;③根据酮羰基所连的两个烃基是否相同,分为:单酮,混酮。
官能团:醛 R -C -H O酮 (-CHO 为醛基)(两个R 可以相同,也可不同)C O(羰 基)R -C -R°O'(一) 醛和酮的命名(1)普通命名法(2) 系统命名法(一) 醛和酮的命名醛、酮的命名与醇相似。
(1) 普通命名法酮的普通命名法是按照羰基所连接的两个烃基命名。
甲乙酮CH 3CCH 2CH 3OCH 3CH 2CH 2CHO CH 3CHCH 2CHO CH 3CH 3-C-CH=CH 2O 正丁醛异戊醛甲基乙烯基酮CHO 苯甲醛C-CH 3O 苯乙酮C-O二苯甲酮(2) 系统命名法CH 3CHCH 2CHO CH 3CH 3CH 2-C-CH-CH 3O CH 343-甲基丁醛2-甲基-3-戊酮β−甲基丁醛12345苯基丙烯醛3-CH=CH-CHO (肉桂醛)321321CH 3CH=CHCHO CH-CHO CH 32-丁烯醛苯基丙醛2−CH 3C-CH 2-CCH 3O O β−戊二酮戊二酮 2,4-(巴豆醛)1234苯基丙醛α−(二) 醛和酮的结构羰基的结构:C O sp 杂化C O电子云分布: C Oδ−δ+C OCH 3CH 3C OH H2.27D2.85D极性分子 有偶极矩(三) 醛和酮的制法(1)醇的氧化或脱氢(2) 羰基合成(3) 同碳二卤化物水解(4) 羧酸衍生物的还原(5) 芳烃的氧化(6) 芳环上的酰基化(三) 醛和酮的制法(1) 醇的氧化或脱氢RCH 2OH RCHORCOOH及时蒸出1 醇醛酸。



Xiezx -Lzu2一、α,β-不饱和醛酮二、醌三、羟基醛酮四、不饱和酸及其衍生物内容Xiezx -Lzu3C=C C=OC C C=O C C C=O C C=C O+_Br BrBr C=C C O +_+_C=C C OLi R C=C C OHRC C=C OH NuRLiH O1.Nu (1)(2)(3)(1)(2)(3)2.H C C C=O NuC=C 亲电加成C=O 亲核加成1,4-共轭加成α,β-不饱和醛酮的加成反应1、分类一、α,β-不饱和醛酮Xiezx-Lzu4C C=C OHNu H +互变异构C=C C=O+Nu -C C=C O -Nu C C C=O _Nu C C C=ONu H在碱性条件下1,4-加成反应的机理Xiezx-Lzu5C C=C OHC=C C OH++C=C C=O + H+Z -互变异构C C=C OH C C C=O ZZH在酸性条件下1,4-加成反应的机理Xiezx -Lzu61.卤素、HOX 不发生共轭加成,只在C=C 双键上发生亲电加成。
2.HX 、HCN 、NH 3及NH 3的衍生物等与α,β-不饱和醛酮的加成以发生1,4-共轭加成为主。
3.不饱和醛与RLi, RMgX 反应时以C=O 双键的1,2-亲核加成为主。
与R 2CuLi 反应,以1,4加成为主。
4.不饱和酮与金属有机物加成时,使用RLi,主要得C=O 的1,2-加成产物,使用R 2CuLi,主要得1,4-加成产物,使用RMgX,如有亚铜盐如CuX 做催化剂,主要得1,4-加成产物,如无亚铜盐做催化剂,发生1,2加成还是1,4-加成,与反应物的空间结构有关,空阻小的地方易发生反应。
α,β-不饱和醛酮加成反应的规律Xiezx -Lzu7C 6H 5CH=CHCOC 6H 5KCN,HOAc EtOH C 6H 5CHCH 2COC 6H 5CNRCH=CHR'KCN, HOAc EtOHN. R.(1)93-96%C 6H 5CH=CHCOCH 3C 6H 5CHCH 2COCH 3NHN+(2)(3)1,4-产物85%HX 、HCN 、NH 3及NH 3的衍生物与α,β-不饱和醛酮的加成以发生1,4-共轭加成为主.CH 2=CH-CH=O+ HCl-15o CClCH 2CH 2CH=O例子Xiezx -Lzu8(CH 3)2C=CHCOCH 3CH 2=CH-CCH 2COCH 3+(CH 2=CH -)2CuLi1. Et 2O2. H 2OCH 3CH 3(4)72%1. Et 2O2. H 2OOCH 3+(CH 3)2CuLi OCH 3CH 3(5)98%R 2CuLi 与α,β-不饱和醛酮的加成反应,以1,4-加成为主。

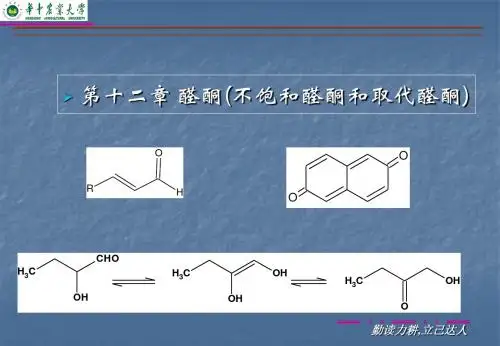
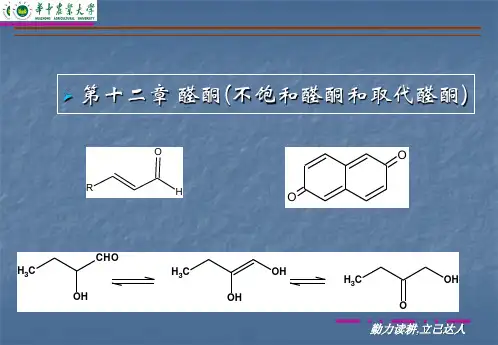
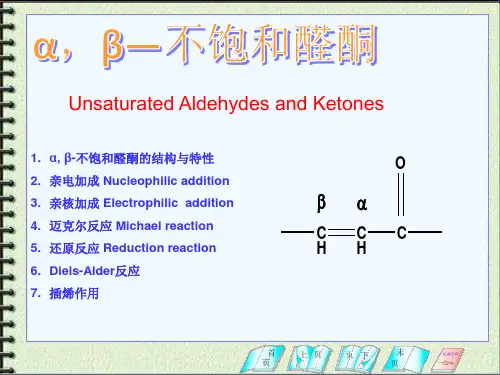



13--不饱和醛酮及取代醛酮§1.α,β-不饱和醛酮不饱和醛酮分子中,C=C 位于α-和β-碳原子间的称谓α,β-不饱和醛酮;位于β-和γ-碳原子间的,则称为β,γ-不饱和醛酮,由于前者和羰基组成共轭体系,所以比后者更稳定。
例如:H 2C CHCH 2CH OH 3CHC CHCH O△H =-25kJ/mol 放热 反 应在酸或碱催化下,3-丁烯醛容易转变成2-丁烯醛: ①在碱催化下:H 2C CHCH 2CH O H 3CHC CHCH O+OH H 2O +CH 2=CHCHCH=OCH 2=CHCH=CH OCH 2CH=CHCH=O②在酸催化下:H 2C CHCH 2CH O2C CH CH 2CH OHH 2C C HCH 2HC OHH +H 2C C H C H C H OH3CH C H CHOHCH 3CH=CHCH OHH 3CHC CH CH=OH- H +CH 3CH=CHCH=O1.α,β-不饱和醛酮 的反应 (1) 亲核加成:①与HCN 加成α,β不饱和酮与HCN 反应,主要生成1,4加成产物:α,β不饱和醛与HCN反应,主要生成1,2加成产物。
②与格氏试剂加成羰基上的取代基大小对1,2 和 1,4 加成有一定影响。
下列反应中的数据也说明了羰基上取代基大小对1,2和1,4 加成的影响:C6H5HC CHCOR(1)C H MgBr3C6H5HC CH COHRC2H5+C6H5CHCH2COR2H5 1,2-加成产物1,4-加成产物R=H CH3 C2H5 CH(CH3)2 C(CH3)3 C6H5 1,4-加成产物% 0 60 71 100 100 99③与烃基锂加成主要发生在1,2加成:④与二烃基酮锂加成以1,4 加成为主H OO(2)、亲电加成αβ不饱和醛酮与亲电试剂,一般都发生1,4加成OHBr(g)OBr (3)还原①使羰基还原②使双键还原③使羰基,双键同时被还原(催化加氢)H 3CH 2CH 2CHC CCHOCH 2CH 3H 2CH 3CH 2CH 2CH 2CHCH 2OH2CH 3(4)氧化αβ不饱和醛在温和条件下,可氧化为αβ不饱和羧酸(5)狄尔斯-阿尔德反应(Diels-Alder )反应2. α,β-不饱和醛酮的制备 有醛酮的缩合反应制备。