第二章自由基聚合2.6自由基聚合反应机理
- 格式:ppt
- 大小:424.50 KB
- 文档页数:28

了解有机化学中的自由基聚合反应反应机制和应用自由基聚合反应是有机化学中非常重要的一种反应类型,它在合成高分子材料、制备聚合物以及药物研发等领域都具有广泛的应用。
本文将深入探讨自由基聚合反应的机理和应用。
一、自由基聚合反应的机制自由基聚合反应是一种通过自由基的自由基反应形成聚合物链的过程。
该反应包括三个关键步骤:起始、传递和终止。
1. 起始自由基聚合反应的起始是通过引入一种起始剂,使之发生自由基解离,生成两个自由基。
常用的起始剂有过氧化物、硝酸酯和过氧硫酸铵等。
起始剂的解离会产生两个自由基,从而引发聚合链的生成。
2. 传递传递是自由基聚合反应的核心步骤,主要是自由基与单体分子之间的反应。
在传递过程中,自由基会与单体发生加成反应,生成一个新的自由基和一个共价键。
新生成的自由基会继续参与到传递反应中,进一步延长聚合链。
3. 终止自由基聚合反应的终止过程会导致聚合链的停止,从而形成聚合物。
终止反应可以分为两种类型:链传递终止和自由基自身的消失。
链传递终止是指两个自由基之间的反应,例如两个聚合链相遇并发生反应。
自由基自身的消失则是指自由基与其他物质发生反应或自由基的自发消失。
二、自由基聚合反应的应用自由基聚合反应的机理和特点使其在许多领域中得到广泛应用。
1. 聚合物合成自由基聚合反应是合成聚合物的主要方法之一。
通过选择不同的单体和起始剂,可以合成出具有不同结构和性能的聚合物。
聚合物的种类包括聚乙烯、聚苯乙烯、聚丙烯等广泛应用的工程塑料。
2. 化学药品合成自由基聚合反应在药物合成过程中也起到重要作用。
许多药物合成的关键步骤利用了自由基聚合反应的特点,通过选择不同的单体和反应条件,实现对目标化合物的构建。
3. 材料科学自由基聚合反应在材料科学领域有丰富的应用。
通过控制反应条件和单体的选择,可以制备出具有特定结构和性能的高分子材料,如塑料、橡胶和纤维。
4. 生物医学工程自由基聚合反应在生物医学工程领域中也得到广泛应用。



自由基聚合反应机理1. 引言自由基聚合反应是一种重要的有机化学反应,广泛应用于聚合物的合成和有机合成领域。
自由基聚合反应的机理对于合理设计反应条件和控制反应过程具有重要意义。
本文将简要介绍自由基聚合反应的机理及相关的反应条件和控制方法。
2. 自由基聚合反应的基本概念自由基聚合反应是指通过自由基的聚合反应来合成聚合物的过程。
在自由基聚合反应中,自由基分子通过聚合反应连续添加到聚合物链上,从而实现聚合过程。
聚合物链的生长是以共轭双键或其他反应位点为基础的。
3. 自由基聚合反应的机理自由基聚合反应包括引发步骤、传递步骤和终止步骤。
下面将逐个介绍这些步骤的机理。
3.1 引发步骤在自由基聚合反应中,反应的开始需要引发剂作为引发步骤的催化剂。
引发剂会被激活形成自由基,通常是通过热量、光或化学剂的作用来实现。
引发剂能够引发起反应的原因在于它能够提供链建立反应起点所需的自由基。
3.2 传递步骤在自由基聚合反应的传递步骤中,自由基分子会逐一添加到聚合物链的末端,并延长聚合物链的长度。
这个过程中,自由基通过与单体分子反应,将自由基转变为共轭双键或其他反应位点,从而继续聚合的过程。
3.3 终止步骤自由基聚合反应的终止步骤是不可逆的,通过各种反应途径来消除自由基,结束聚合反应。
终止步骤可以分为自发性终止和人为控制的终止。
4. 自由基聚合反应的控制方法为了获得所需的聚合物特性,需要对自由基聚合反应进行控制。
下面介绍几种常用的控制方法。
4.1 温度控制温度是自由基聚合反应的主要控制因素之一。
通常情况下,聚合反应速率随温度的升高而加快。
通过控制反应温度,可以调节聚合反应的速率和产物分子量分布。
4.2 引发剂选择不同的引发剂会对自由基聚合反应的速率和选择性产生影响。
选择合适的引发剂可以实现更高的反应活性和选择性。
4.3 单体选择单体的选择性也是自由基聚合反应的重要控制因素之一。
通过选择不同的单体,可以合成出具有不同结构和性质的聚合物。


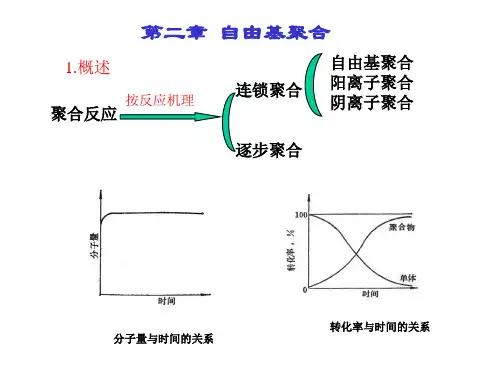
第二章 自由基聚合2-1 引言1.连锁聚合的基元反应链引发 R I 2→* **RM M R →+链增长 *2*RM M RM →+ *3*2RM M RM →+︰ ︰()**1n m RM M RM →+-链终止 *n RM → 聚合物分子2.连锁聚合的类型⎩⎨⎧异裂均裂θ:B A :B A R R R +→→∙∙⊕|2|⎪⎪⎩⎪⎪⎨⎧∙⊕配位离子θBAR 配位聚合阴离子聚合阳离子聚合自由基聚合 以上占聚合物总产量的%60 2-2连锁聚合的单体⎪⎪⎩⎪⎪⎨⎧动力学热力学适当的引发剂0〈∆G 等杂环作物羰基化合物烯类共轭二烯类单体类型T ⎪⎩⎪⎨⎧P19表2-1醛、酮中羰基π键异裂后,具有类似离子的特征,可由离子引发聚合::||-+--→=-O C O C乙烯基单体碳—碳π键既可均裂,又可异裂,可进行自由基聚合或离子聚合:--+−→←=−→←∙-∙:||||||||||||C C C C C C1. 取代基电子效应的影响∙-∙−→←=−→←-⊕Θ||||||||||||:C C C C C Cπ键断裂方向⎪⎩⎪⎨⎧⎩⎨⎧活性种的性质外因改变双键电子密度共轭诱导取代基的电子效应内因: : ① 无取代基 CH CH 22=nCH 2=CHatm 43( CH 2---CH 2 )N ( CH 2---CH 2 )N② 取代基是供电基团 R-、 RO-、 、 、 例:CH 2=CH-∴ 唯有1,1-双烷基烯烃才能进行阳离子聚合注: 同一体系中,同时存在两种效应,往往共轭效应占主导地位。
结合有利于阳离子的进攻和Y CH CH −−←=-2δ此外,供电基团可使阳离子增长种共轭稳定 如:乙烯基烷基醚③ 取代基是吸电子基团 -CN 、 例:卤原子的诱导效应是吸电子,而共轭效应却有供电性,但两者较弱,只能进行自由基聚合注:Ⅰ 此类也可进行自由基聚合,独电子基易和带有吸电子基团双键上电子云密度低的单体结合。
丙烯腈、丙烯酸酯等Ⅱ 取代基吸电子能力很强时,只可进行阴离子聚合偏二腈乙烯 硝基乙烯 ④ 取代基是共轭基团如; 苯乙烯、甲基苯乙烯-α 、丁二烯 、异戊二烯 可进行三种聚合,π电子流动性较大,易诱导极化。



第二章自由基聚合(radical polymerization)【课时安排】2.1 单体的聚合能力2学时2.2 自由基聚合机理4学时2.3 链引发反应3学时2.4 聚合反应动力学2学时2.5 相对分子质量1学时2.6 链转移反应2学时2.7 聚合方法4学时总计18学时【掌握内容】1.单体聚合能力:热力学(△E, △S,T,P);动力学(空间效应-聚合能力,电子效应-聚合类型)2.自由基基元反应每步反应特征,自由基聚合反应特征3.常用引发剂的种类和符号,引发剂分解反应式,表征方法(四个参数),引发剂效率,诱导效应,笼蔽效应,引发剂选择原则4.聚合动力学:聚合初期:三个假设,四个条件,反应级数的变化,影响速率的四因素(M,I,T,P);聚合中后期的反应速率的研究:自动加速现象,凝胶效应,沉淀效应;聚合反应类型5.相对分子质量:动力学链长,聚合度及影响其的四因素(M,I,T,P),6.链转移:类型,聚合度,动力学分析,阻聚与缓聚7.本体,溶液,悬浮,乳液四大聚合方法配方,基本组成,优缺点及主要品种【熟悉内容】1.热、光、辐射聚合。
2.聚合动力学研究方法。
3 自由基聚合的相对分子质量分布。
4 悬浮聚合与乳液聚合所用分散剂种类、聚合过程。
【了解内容】1. 通用单体来源。
2. 自由基聚合进展。
【教学难点】1. 对具体单体聚合热力学与动力学的综合分析2. 终止方式的相对比例及其与体系状态的关系3. 氧化还原类的反应式;笼蔽效应与诱导效应4. 不同条件下反应速率对单体与引发剂浓度的反应级数的推导与分析5. 区别聚合反应速率、动力学链长、平均聚合度的影响因素和变化趋势6. 向不同转移对象的链转移程度的难易分析7. 乳液聚合机理及动力学【教学目标】1. 掌握自由基聚合相关基本概念。
2. 掌握自由基聚合常见单体、引发剂、阻聚剂、聚合方法。
3. 达到如下技能:(1)单体聚合能力的判断与类型的选择(2)引发剂的选择及正确书写引发反应式(3)正确书写任一体系的基元反应式(4)根据动力学方程计算各参数,选择适当方法控制反应进程(5) 根据相对分子质量方程计算各参数,选择适当方法控制产物结构(6)设计聚合工艺,线路与配方2.1 单体的聚合能力【教学内容】2.1.1 聚合热力学一聚合热二聚合熵三聚合温度四小结2.1.2 聚合动力学一连锁聚合种类与活性中心二单体对聚合类型的选择及聚合能力1 取代基对聚合能力的影响(空间效应)2 取代基对聚合类型的选择(电子效应)3 单体共聚能力【授课时间】2学时【教学重点】1影响聚合热的主要因素及其规律2单体对聚合类型的选择及聚合能力【教学难点】1影响聚合热的主要因素及其规律2 对具体单体聚合热力学与动力学的综合分析【教学目标】1 掌握影响聚合热的主要因素及其规律2掌握取代基对单体聚合类型选择及聚合能力的影响规律3 能正确综合分析具体单体的聚合热力学与动力学行为【教学手段】课堂讲授,辅以实例练习【教学过程】聚合能力:化学结构:两个可相互反应官能团常见聚合单体类型两个以上有机官能团单体C=C-X热力学:方向,限度,∆G<0 R-C=O动力学: 聚合方法杂环(O,N,P,S)2.1.1 聚合热力学∆G=∆H-T∆S= ∆E+P∆V-T∆S<0 聚合;=0 达到平衡;>0 解聚一聚合热∆H=∆E+P∆V1 内能变化∆E=∆E f+∆E R+∆E s+∆E’=( E fp - E fm)+( E Rp - E Rm)+( E sp - E sm)+ ∆E’E f------由键能所贡献的内能E R-----由共振效应所贡献的内能E s------由空间张力或位阻效应所贡献的内能∆E’----其它因素引起的内能变化(1) 双键断裂能CH 2=CH 2 -CH 2-CH 2- ∆E f =εm -εp=609.2-2×351.7=-94.2 kJ.mol -1 (实测值∆H=-88.8 kJ.mol -1)(2)共轭效应增强,|—∆H|减小(3)位阻效应增强,|—∆H|减小 (4)氢键与溶剂化作用增强,|—∆H|减小 (5)强电负性取代基的存在使|—∆H|增强(6)需具体综合分析2 压力影响: 压力增大,有利于聚合物进行二 聚合熵 ∆S=-100~-125 kJ.mol -1三 聚合温度1 聚合上限温度∆G=∆H-T ∆S=0→T c =∆H/∆S (不同压力与活度下数值)→T c 有一系列,对应一系列平衡单体浓度→常规定[M] e =1mol/L 时T c 为聚合上限温度→T c =∆H 0/∆S 02 平衡单体浓度eo oM RT S H Tc ]ln[+∆∆= 四 小结增强聚合倾向内因 ∆S 影响不大∆E: 降低共轭效应, 降低位阻效应, 降低氢键与溶剂化作用,增强强电负性取代基 外因 增大压力,降低温度可解释α-甲基苯乙烯(α-MeSt )的聚合现象2.1.2 聚合动力学一 连锁聚合种类与活性中心根据引发活性种与链增长活性中心的不同,链式聚合反应可分为自由基聚合、阳离子聚合、阴离子聚合和配位聚合等二 单体对聚合类型的选择及聚合能力1 取代基对聚合能力的影响(空间效应)(1)单取代能聚合(2)双取代一般可以聚合,但基团太大时难以聚合(3)三、四取代一般不可以聚合,氟取代除外2 取代基对聚合类型的选择(电子效应)(1) 取代基的诱导效应A A 自由基:2A A CH 2CH XA B 阳离子CH =CHX A CH 2H C X离解A +B -δ+B δ-A B 阴离子A CH 2H C X 离解A -B +δ+B δ-带给电子基团的烯类单体易进行阳离子聚合带吸电子基团的烯类单体易进行阴离子聚合与自由基带强给电子基团、强吸电子基团的烯类单体只能分别进行阳离子、阴离子聚合(2) 取代基的共轭效应:流动性大,易诱导极化,可进行多种机理的聚合反应(3) 带不同基团的单体进行几种聚合时的排序 阳离子聚合取代基-X: -NO 2,-CN,-F,-Cl,-COOCH 3,-CONH 2,-OCOR,-CH=CH 2,-C 6H 5,-CH 3,-OR 自由基聚合阴离子聚合3 单体共聚能力:与参与共聚的各种单体均有关2.2 自由基聚合机理【教学内容】2.2.1 自由基2.2.2 自由基聚合的基元反应一 链引发反应(chain initiation )二 链增长反应(chain growth )三 链终止反应(chain termination )四 链转移反应(chain transfer )2.2.3 自由基聚合的反应特征【授课时间】4学时【教学重点】自由基聚合的基元反应;自由基聚合反应特征【教学难点】终止方式的相对比例及其与体系状态的关系【教学目标】1 掌握自由基聚合机理2 掌握自由基聚合反应特征3 能正确写出具体聚合物的基元反应式【教学手段】课堂讲授,配以Flash 动画演示,辅以学生讨论【教学过程】2.2.1 自由基一 分类与产生二 活性1 影响因素:共轭效应大,吸电子诱导效应大,位阻效应强,稳定性强,活性小2 活性顺序三 反应:加成反应,氧化还原反应,偶合反应,脱氢反应,消去反应2.2.2 自由基聚合的基元反应一 链引发反应(chain initiation ) 慢 单体自由基引发剂引发为例二 链增长反应(chain growth ) 快 活性高分子链I 2 Ik I k i I CH 2引发活性种,初级自由基,引发自由基H 2C CHX +CHX M链结构在该步形成:序列结构→头尾为主顺反结构→温度升高有利于顺式结构生成立体结构→无规结构三 链终止反应(chain termination) 速 稳定大分子1 双基终止(均相体系,主要方式) PS,PAN 偶合为主; PMMA 偶合歧化兼有; PVAc 歧化为主问题:k t >>k p , 为何还可得到大分子?2 单基终止四 链转移反应(chain transfer )一定条件下 不同活性的链自由基 2.2.3 自由基聚合的反应特征 1 慢反应,快增长,速终止234 放热反应,低温有利2.3 链引发反应k I CH 2H 2C CH+CH XMCH 2CH CH 2CH 2偶合:CH 2CH CH CH 2歧化:CH 2CH 2CH 2CH 2CH CH X +k k k CH 2+CH S + SCH 2CH 2【教学内容】2.3.1 引发剂类型一 热分解型二 氧化还原类2.3.2 引发剂活性(表征方法)2.3.3 引发剂效率f2.3.4 引发剂的选择【授课时间】2学时【教学重点】典型类型引发剂;引发剂活性表征方法;引发剂效率及影响因素;引发剂的选择原则【教学难点】氧化还原类的反应式;笼蔽效应与诱导效应【教学目标】1 掌握引发剂活性表示方法及其计算方法2掌握引发剂效率、笼蔽效应、诱导效应等基本概念3能正确写出典型引发剂的结构式与引发反应式4 能根据具体要求选择匹配的引发剂【教学手段】课堂讲授,辅以多媒体幻灯图片及实例【教学过程】2.3.1 引发剂类型一 热分解型(Ed=80~140kJ/mol ,中高温使用)1 偶氮类引发剂2 过氧类引发剂(1) 有机过氧类a 烷基过氧化氢(RC-O-O-H):异丙苯过氧化氢(CHP ),叔丁基过氧化氢(t-BHP)b 二烷基过氧化物(R-O-O-R ’):过氧化二异丙苯c 过氧化酯(RCOOCR ’)d 过氧化二酰(RCOOOCOR ’)R 1C R 2N N C R 1R 2R C R N N C R 1R 2对称不对称(X=吸电子取代基)H 3C C CH 3CN N N C CH 3CH 3CN H 3C C CH 3CN 2+ N 2偶氮二异丁腈(AIBN)Ph C O C O Ph 2Ph C O O Ph C O OPh + CO 2过氧化苯甲酰(BPO )e 过氧化二碳酸酯(ROOC-O-O-COOR ’):过氧化二碳酸二异丙酯(IPP)(2) 无机过氧类:S 2O 82─→2 SO 4‧─二 氧化还原类(Ed=40~60kJ/mol ,低温使用)1 水溶性(1) 生成一种R ‧HOOH + Fe 2+→HO ‧+OH ─+Fe 3+S 2O 82─+ Fe 2+ →SO 42─ + SO 4‧─+Fe 3+用量:还原剂<氧化剂,否则Fe 2++‧OH →Fe 3++OH ─白白消耗自由基(2) 生成一种R ‧S 2O 82─+ SO 32─→SO 42─+ SO 4‧─+ SO 3‧─2 油溶性2.3.2 引发剂活性(表征方法)一 分解速率常数kd 越大,引发剂活性越大I k dt I d R d d =-=][二 分解活化能Ed 越小,引发剂活性越大三 半衰期t 1/2越小,引发剂活性越大2/12/][][ln t k I I d o o = 四 残留分率[I]/[I]o 越小,引发剂活性越大2.3.3 引发剂效率f一二 笼蔽效应(Cage Effect)引发剂分解产生的初级自由基,在开始的瞬间被溶剂分子所包围,不能与单体分子接触,无法发生链引发反应。
自由基聚合反应机理
自由基聚合反应机理:
①自由基聚合作为一种合成高分子材料重要方法其基本原理涉及链引发链增长链终止以及链转移四个主要步骤;
②链引发阶段通过热分解光照辐射等方式使单体分子或引发剂分解生成活性自由基物种作为聚合反应起点;
③一旦形成自由基便会迅速与单体分子发生反应打开双键形成新的共价键并将自由基特性传递给下一个单体;
④随着时间推移这个过程不断重复每个自由基链不断增长直至达到所需聚合度形成高分子链;
⑤链终止发生在聚合反应后期当两个自由基相遇时它们之间反应导致活性中心消失形成稳定聚合物;
⑥另一种终止方式为歧化终止其中一个自由基将氢原子或其它原子转移给另一自由基两者均转变为非活性物种;
⑦在整个反应过程中还可以观察到链转移现象即自由基与溶剂单体或引发剂等其他物质发生反应暂时中断增长;
⑧链转移虽然降低了聚合物分子量但却可以作为控制分子量分布和端基官能团手段被有意引入到合成中;
⑨实际操作中通过选择不同类型引发剂如过氧化物偶氮化合物以及控制反应条件可以调节聚合速率和产物特性;
⑩自由基聚合广泛应用于制备聚乙烯聚丙烯酸酯等众多商业塑料同时也为科研工作者提供了制备新型高分子材料平台;
⑪尽管具有诸多优点自由基聚合也面临一些挑战如难以获得极高分子量产品以及副反应控制等问题仍需深入研究解决;
⑫展望未来随着对自由基化学理解加深以及新催化剂新技术发展自由基聚合将在功能性高分子合成领域发挥更大作用;。