第二章--自由基聚合.
- 格式:doc
- 大小:425.00 KB
- 文档页数:25






第二章自由基聚合2.1 学习目の(1)熟悉各种能进行连锁聚合の单体の结构特点;(2)了解连锁聚合反应热力学。
(3)掌握自由基聚合机理。
(4)熟悉自由基聚合常用の引发剂以及引发剂分解动力学。
(5)了解各种类型の引发反应。
(6)掌握自由基聚合反应动力学。
(7)掌握聚合度の计算方法。
(8)熟悉各种链转移反应及其对聚合度の影响。
(9)熟悉自动加速过程。
(10)了解自由基聚合中の阻聚和缓聚作用及机理。
(11)了解速率常数の测定和计算。
(12)熟悉自由基聚合の相对分子质量の控制、分布及影响因素。
(13)了解自由基聚合の反应特征。
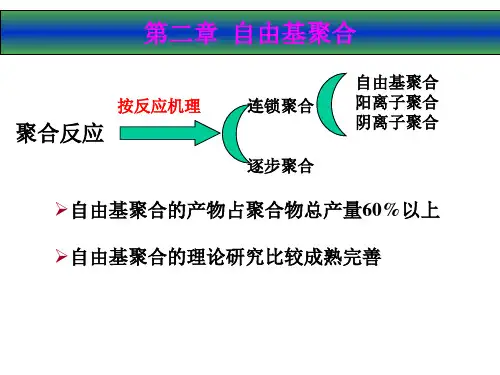
2.2 内容提要2.2.1 判断某种化合物能否进行聚合反应一、可进行连锁聚合单体の结构特点主要涉及能够作为聚合反应单体の烯烃の基本条件,以及单体结构与聚合反应类型之间の关系。
具体而言,首先从烯烃取代基所造成位阻大小の角度判断其能否进行聚合,然后再从取代基电负性和共轭性の角度判断其能够进行哪一种或哪几种类型の聚合反应。
1. 取代基の数目、位置、大小决定烯烃能否进行聚合(1)一取代烯烃原则上都能够进行聚合反应。
(2)对于1,1-二取代の烯类单体,一般都能按取代基の性质进行相应机理の聚合。
并且由于结构上更不对称,极化程度增加,更易聚合。
但两个取代基都是体积较大の芳基时,只能形成二聚体。
(3)1,2-双取代の烯类单体,结构对称,极化程度低,加上位阻效应,一般不能均聚或只能形成二聚体。
(4)三取代和四取代乙烯一般不能聚合,但氟代乙烯却是例外,不论氟代の数目和位置如何,均易聚合,这是氟の原子半径较小の缘故。
综上所述,一取代和1,1-二取代乙烯等无位阻障碍の取代烯烃,是连锁聚合单体の两种主要类型。
其它情况必须特别注意判断,除氟取代以外一般都无法进行均聚合反应。
2. 取代基の电负性和共轭性决定烯烃の聚合反应类型按照聚合反应活性中心の不同,连锁聚合反应通常包括自由基型、阴离子型、阳离子型和配位离子型等四种聚合反应类型。



第二章 自由基聚合2-1 引言1.连锁聚合的基元反应链引发 R I 2→* **RM M R →+链增长 *2*RM M RM →+ *3*2RM M RM →+︰ ︰()**1n m RM M RM →+-链终止 *n RM → 聚合物分子2.连锁聚合的类型⎩⎨⎧异裂均裂θ:B A :B A R R R +→→∙∙⊕|2|⎪⎪⎩⎪⎪⎨⎧∙⊕配位离子θBAR 配位聚合阴离子聚合阳离子聚合自由基聚合 以上占聚合物总产量的%60 2-2连锁聚合的单体⎪⎪⎩⎪⎪⎨⎧动力学热力学适当的引发剂0〈∆G 等杂环作物羰基化合物烯类共轭二烯类单体类型T ⎪⎩⎪⎨⎧P19表2-1醛、酮中羰基π键异裂后,具有类似离子的特征,可由离子引发聚合::||-+--→=-O C O C乙烯基单体碳—碳π键既可均裂,又可异裂,可进行自由基聚合或离子聚合:--+−→←=−→←∙-∙:||||||||||||C C C C C C1. 取代基电子效应的影响∙-∙−→←=−→←-⊕Θ||||||||||||:C C C C C Cπ键断裂方向⎪⎩⎪⎨⎧⎩⎨⎧活性种的性质外因改变双键电子密度共轭诱导取代基的电子效应内因: : ① 无取代基 CH CH 22=nCH 2=CHatm 43( CH 2---CH 2 )N ( CH 2---CH 2 )N② 取代基是供电基团 R-、 RO-、 、 、 例:CH 2=CH-∴ 唯有1,1-双烷基烯烃才能进行阳离子聚合注: 同一体系中,同时存在两种效应,往往共轭效应占主导地位。
结合有利于阳离子的进攻和Y CH CH −−←=-2δ此外,供电基团可使阳离子增长种共轭稳定 如:乙烯基烷基醚③ 取代基是吸电子基团 -CN 、 例:卤原子的诱导效应是吸电子,而共轭效应却有供电性,但两者较弱,只能进行自由基聚合注:Ⅰ 此类也可进行自由基聚合,独电子基易和带有吸电子基团双键上电子云密度低的单体结合。
丙烯腈、丙烯酸酯等Ⅱ 取代基吸电子能力很强时,只可进行阴离子聚合偏二腈乙烯 硝基乙烯 ④ 取代基是共轭基团如; 苯乙烯、甲基苯乙烯-α 、丁二烯 、异戊二烯 可进行三种聚合,π电子流动性较大,易诱导极化。

第二章 自由基聚合 习题参考答案1.举例说明自由基聚合时取代基的位阻效应、共轭效应、电负性、氢键和溶剂化对单体聚合热的影响。
解答:以结构最简单的聚乙烯为标准,其聚合热为-88.8kJ/mol 。
位阻效应:单体的位阻效应加大,聚合放热下降。
如异丁烯,其聚合热为-54kJ/mol 。
这是因为单体的取代基在空间伸展范围大,而成链后,伸展范围小,键角压缩,需贮藏一定能量。
共轭效应:单体的共轭效应加大,聚合放热下降。
如丁二烯,其聚合热为-73kJ/mol 。
这是因为聚合后,单体原有的共轭作用下降,稳定性下降,需用一定能量。
电负性:单体带强电负性取代基,聚合放热上升。
如四氟乙烯,其聚合热为-154.8kJ/mol 。
这是因为碳-氟键能大,氟原子半径小。
氢键和溶剂化:单体的氢键和溶剂化大于聚合物的,聚合放热下降。
如丙烯酸,其聚合热为-67kJ/mol 。
这是单体间氢键作用大的原因。
2.比较下列单体的聚合反应热的大小并解释其原因:乙烯、丙烯、异丁烯、苯乙烯、α-甲基苯乙烯、 氯乙烯、四氟乙烯。
解答:3.什么是聚合上限温度、平衡单体浓度?根据表3-3数据计算丁二烯、苯乙烯40℃、80℃自由基聚合时的平衡单体浓度。
解答:聚合上限温度:当聚合和解聚处于平衡状态时,△G = 0,则△H = T △S 。
这时的反应温度称为聚合上限温度(ceiling temperature ),记为T c 。
一般规定平衡单体浓度为1mol/L 时的平衡温度为聚合的上限温度。
平衡单体浓度:链增长和解聚达平衡时体系的单体浓度,一般取标准状态。
丁二烯:⎪⎪⎭⎫ ⎝⎛-=O cO e ΔS T ΔH R 1ln[M] (1)40℃(313K ),△H = -73.7KJ/mol ,△S = -85.8J/mol ,R = 8.314 [M]e = 1.52×10-8mol/L(2)80℃ [M]e = 3.77×10-7mol/L苯乙烯:(1)40℃(313K ),△H = -69.9KJ/mol ,△S = -104.7J/mol ,R = 8.314[M]e = 6.36×10-7mol/L(2)80℃ [M]e = 1.33×10-5mol/L4.α-甲基苯乙烯在0℃可以聚合,升温至66℃后不能聚合,但进一步加大反应压力,该单体又可以发生聚合。
请说明其原因。
解答:(1)在标准状态:eOOc Rln[M]ΔSΔH T +=△H = -35.2KJ/mol ,△S = -103.8J/mol ,R = 8.314T c = 339k = 66℃所以0℃可以聚合;升温至66℃,达T c,故不能聚合。
(2)PV = nRT V近似不变,P加大,T下降,可聚。
5.什么是自由基聚合、阳离子聚合和阴离子聚合?解答:自由基聚合:活性中心为自由基的聚合反应。
阴离子聚合:活性中心为阴离子(带负电荷)的聚合反应。
阳离子聚合:活性中心为阳离子(带正电荷)的聚合反应。
6.下列单体适合于何种机理聚合:自由基聚合,阳离子聚合或阴离子聚合?并说明理由。
CH2=CHCl,CH2=CCl2,CH2=CHCN,CH2=C(CN)2,CH2=CHCH3,CH2=C(CH3)2,CH2=CHC6H5,CF2=CF2,CH2=C(CN)COOR,CH2=C(CH3)-CH=CH2。
解答:7.根据表2-4,说明下列单体工业化所选择反应历程的原因CH2=CH2,CH2=CHCH3,CH2=CHCl,CH2=CHC6H5,CH2=CHCN,CH2=CHOCOCH3,CH2=CHCOOCH3,CH2=C(CH3)2,CH2=CH-OR,CH2=CH-CH=CH2,CH2=C(CH3)-CH=CH28.对下列实验现象进行讨论:(1)共轭效应使烯类单体的聚合热降低而使缺类单体的聚合热增高。
(2)乙烯、乙烯的一元取代物、乙烯的1,1-二元取代物一般都能聚合,但乙烯的1,2-取代物除个别外一般不能聚合。
(3)大部分烯类单体能按自由基机理聚合,只有少部分单体能按离子型机理聚合。
(4)带有π-π共轭体系的单体可以按自由基、阳离子和阴离子机理进行聚合。
解答:(1)主要为以下原因:①对烯类单体而言,聚合包含有一个π键的断裂,两个σ键的生成。
打开一个双键所需能量为609.2 kJ/mol,形成一个单键放出的能量为-351.7 kJ/mol,总的能量变化为:△H = 2Eσ- Eπ= 2×(-351.7)—(-609.2) = -94.2 kJ/mol对炔类单体而言,聚合包含有一个三键的断裂,一个π键和两个σ键的生成。
打开一个三键所需能量为812 kJ/mol,形成一个双键放出能量为-609.2 kJ/mol,一个单键放出的能量为-351.7 kJ/mol,总的能量变化为:△H = 2Eσ+Eπ-E三键= 2×(-351.7)+(-609.2) - (-812)= -500.6 kJ/mol相比乙烯聚合,乙炔聚合放热要多的多。
②对取代烯烃而言,聚合后无双键,共轭作用明显下降,聚合放热减少;对取代炔烃而言,聚合后还存在双键,共轭作用变化不明显,聚合放热变化不大。
(2)乙烯、乙烯的一元取代物、乙烯的1,1-二元取代物:总体看这类单体空间位阻小电效应较大,故查聚合;但乙烯的1,2-取代物空间位阻大,电效应因互抵而下降,故除个别外一般不能聚合。
(3)一般取代基电效应弱的只能自由基聚合,如:VC、V AC;有带强吸(供)电子取代基的单体可进行阴(阳)离子聚合,如:CH2=C(CN)COOR(烷基乙烯基醚);处于中间的带较强吸(供)电子取代基的单体可进行阴(阳)离子聚合和自由基聚合,如:MMA;故从目前可进行聚合的单体看,能进行自由基聚合的单体要多一些。
(4)带有π-π共轭体系的单体,如苯乙烯、丁二烯、异戊二烯等,不管形成什么样的活性中心,均存在较明显的共轭结构,这种共轭作用可稳定各种活性中心,一方面利于活性中心的形成,另一方面活性中心还有足够的活性以引发下一个单体,故可多种机理聚合。
9.判断下列烯类单体能否进行自由基聚合,并说明理由。
CH2=C(C6H5)2,ClCH=CHCl,CH2=C(CH3)C2H5,CH3CH=CHCH3,CH2=C(CH3)COOCH3,CH2=CHOCOCH3,CH3CH=CHCOOCH3。
解答:10.丙烯为什么不采用自由基聚合机理进行聚合。
解答:丙烯自由基聚合,活性中心易生成稳定的烯丙基自由基,使聚合反应停止。
~~~CH 2·CHCH 3 + CH 2 = CHCH 3 → ~~~CH 2CH 2CH 3 + CH 2=CH ·CH 2 ·CH 2CH=CH 211.以偶氧氮二异丁腈为引发剂,写出苯乙烯80℃自由基聚合历程中各基元反应。
解答:引发剂分解:(CH 3) 2C —N=N —C(CH) 2 2(CH 3) 2 C· + N 2↑| | | CN CN CN形成单体自由基:(CH 3) 2 C· + CH 2=CH → (CH 3) 2 C-CH 2-HC·| | | |CN C 6H 5 CN C 6H 5 链增长:(CH 3) 2 C-CH 2-HC· + CH 2=CH → → → ~~~~CH 2-HC ·| | | |CN C 6H 5 C 6H 5 C 6H 5链终止:2 ~~~~CH 2-HC · → ~~~~CH 2-HC-CH-CH 2~~~~| | | C 6H 5 H 5 C 6 C 6H 511.回答下列问题:(1)在自由基聚合中为什么聚合物链中单体单元大部分按头尾方式连接? (2)自由基聚合k t >>k p ,但仍然可以得到高分子量聚合物?解答:(1) 主要原因:① 于从活性链端结构分析,当取代基与自由基位于同一碳上时,取代基的电效应有利于活性中心的稳定;② 如要形成头-头结构,两单体的取代基处于相邻碳上,空间位阻加大;③ 单体取代基使其双键电荷分布向与取代基相连的碳上移动,使活性中心易向单体电荷少的碳进攻。
(2) ]M M][[K R p P ⋅= 2t t ][M k R ⋅=自由基聚合中虽然存在k t >>k p ,但自由基浓度很低[M ·]=10-7 ~ -9 mol/L ,而单体浓度则高达101 ~ -1 mol/L ,故聚合反应以生成高分子量聚合物为主。
13.将数均聚合度为1700的聚醋酸乙烯酯水解成聚乙烯醇。
采用高碘酸氧化聚乙烯醇中的1,2-二醇键,得到新的聚乙烯醇的数均聚合度为200。
计算聚醋酸乙烯酯中头-头结构及头尾结构的百分数。
解答:原理:~~~~CH —CH~~~~ + H 5IO 6 → ~~~~CHO + OHC~~~~~ (邢其毅 P403) | | OH OH1700 / 200 = 8.5 8.5 / 1700 = 0.5%80O C14.写出苯乙烯、醋酸乙烯酯和甲基丙烯酸甲酯60℃自由基聚合的双基终止反应式,分析三种单体聚合双基终止方式不同的原因。
解答:苯乙烯:可抽取的α-H少,活性中心与苯环间存在强的共轭,取代基为一苯环,空间位阻较小,偶合终止。
2 ~~~~CH2-HC ·→~~~~CH2-HC-CH-CH2~~~~| | |C6H5 H5 C6 C6H5醋酸乙烯酯:活性中心共聚作用弱,歧化终止。
2 ~~~~CH2-HC ·→~~~~CH2-CH2 + ~~~~CH2=CH| | |OCOCH3 OCOCH3 OCOCH3甲基丙烯酸甲酯:有三个抽取的α-H,有二个取代基,空间位阻较大,利于歧化终止;另一方面活性中心存在较强的共轭,利于偶合终止,故两种终止均存在。
CH3 CH3 CH3| | |2 ~~~~CH2-C ·→~~~~CH2-C —CH-CH2~~~~| | |COOCH3 CH3OOC COOCH3CH3 CH2| ||→~~~~CH2-CH + ~~~~CH2-C| |COOCH3 COOCH315.以H2C CCH3CH3HO N NH2CCCH3CH3OH为引发剂分别使苯乙烯、甲基丙烯酸甲酯在65℃下聚合,然会将其聚合产物分别与甲苯二异氰酸酯反应,发现前者的相对分子质量增加了数倍,而后者的相对分子质量只增加一倍,请说明其原因。
解答:引发剂分解后,一端带有-OH,引发苯乙烯聚合,最后发生偶合终止,所形成的大分子链两端均带-OH,而-OH可与-OCN发生加成反应,反应的结果是产物相对分子质量增加了数倍。
而引发MMA聚合,,大部分发生歧化终止,只在大分子链一端带-OH,反应的结果是产物相对分子质量只增加一倍。