镁铝图像专题(含答案)
- 格式:doc
- 大小:311.91 KB
- 文档页数:5

2017年高考化学专题冲刺专题06 镁铝及其化合物(含解析)编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(2017年高考化学专题冲刺专题06 镁铝及其化合物(含解析))的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为2017年高考化学专题冲刺专题06 镁铝及其化合物(含解析)的全部内容。
专题06 镁铝及其化合物一选择题1.如图是铝热反应(2Al+Fe2O3 Al2O3+2Fe)的实验装置,有关该反应的下列说法中正确的是()A.a为镁条B.b为氧化铁与铝粉混合物C.2 mol氧化剂参与反应转移电子6N A个D。
还原剂与氧化产物的物质的量之比为1∶2【答案】A【解析】a为镁条,起引燃作用,故A正确;b为氯酸钾,故B错误;该反应中氧化剂是氧化铁,2 mol氧化铁参与反应转移电子12N A个,故C错误;该反应中还原剂是铝,氧化产物是氧化铝,还原剂和氧化产物的物质的量之比为2∶1,故D错误.【题型】选择题【难度】一般2。
钠铝合金(常温液态)可作为核反应堆的载热介质。
下列说法错误的是()A。
该合金的熔点低于金属钠的熔点B.若将钠铝合金投入水中得到无色溶液且无金属剩余,则n(Na)≥n(Al)C.若将钠铝合金投入FeCl3溶液中有Fe(OH)3沉淀生成D。
等质量的钠铝合金中铝的含量越大,与足量盐酸反应时放出的氢气越少【答案】D2H2O=2NaOH+H2↑,Fe3++3OH-=Fe(OH) 3↓,故C正确;等质量的钠和铝分别与足量盐酸反应时,铝放出的氢气多,所以等质量的钠铝合金中铝的含量越大,与足量盐酸反应时放出的氢气越多,故D错误.【题型】选择题【难度】一般3。

《镁和铝》综合练习如皋市职教中心、金城高中高三对口(3)班 姓名:_________【例题精选】例1、向MgSO 4和Al 2(SO 4)3的混合溶液中, 逐滴加入NaOH 溶液。
下列图象中, 能正确表示上述反应的是(横坐标表示加入NaOH 溶液的体积, 纵坐标表示反应生成沉淀的质量)解析: (1)本题考查知识点为镁盐、铝盐的性质及氢氧化镁、氢氧化铝性质, 涉及到的离子反应为()Mg 2OH Mg oH 22+-+=↓ Mg(OH)2 + NaOH ()Al 3OH Al OH 33+-+=↓()Al OH OH AlO 2H O 322+=+--因此反应最终结果沉淀不为“O ”所以敏捷判断A 、B 不为此题答案。
(2)从(1)可以分析得出, 此混合物与NaOH 溶液反应过程中必有沉淀减少过程(氢氧化铝溶于NaOH 溶液中)最终有Mg(OH)2↓。
∴C 不正确, D 为此题正确答案。
答案: D例2、下列叙述中, 可以用来判断金属性强弱的是 A .一个金属原子失去电子的多少B .1摩金属与酸反应放出氢气的多少C .金属最高价氧化物对应水化物的碱性强弱D .金属原子失电子的难易程度解析: (1)从金属共性: 金属原子易失电子被氧化, 在化学反应中金属单质表现出还原性可做还原剂。
因而各种金属原子参加化学反应时失去电子的难易程度既表明金属还原性强弱即金属性强弱。
金属原子越易失电子, 该金属还原性越强, 金属性越强。
所以D 为正确选项。
金属性强弱(还原性强弱)与失电子数目无关, 所以A 、B 不为本题答案。
(2)再从金属性强弱的另一事实, 即金属性越强该金属最高价氧化物对应水化物碱性越强不难得出C 为此题正确答案。
答案: C 、D 例3、将下列各组物质, 分别按等物质的量混合后加水溶解, 有沉淀生成的是 A .Na 2CO 3、NaAlO 2、NaOHB .AlCl 3、K 2SO 4、HClC .CaCl 2、Na 2CO 3、NaOHD .AlCl 3、Ba(OH)2、HNO 3解析: (1)本题解答关键知识点为离子反应的有关知识, 只需分析等摩有关物质溶于水后, 提供有关离子能否相互反应生成沉淀, 如有沉淀生成即为本题答案。

专题金属镁、铝图像训练1.下列图象均为实验过程中产生沉淀的物质的量(Y)与加入试剂的量(X)之间的关系图,其中正确的是()A.向AlCl3溶液中逐滴加入NaOH溶液至过量且边滴边振荡B.向NaAlO2溶液中逐滴滴加稀盐酸至过量且边滴边振荡C.向NH4Al(SO4)2溶液中逐滴加入NaOH溶液直至过量D.向含等物质的量浓度的NaOH、Ba(OH)2、NaAlO2的混合溶液中通入二氧化碳至过量2.下列反应中,相关示意图错误的是()将二氧化硫通入到一定量的饱和氯水中将盐酸滴入到NaHCO3和Na2CO3的混合溶液中C D将铜粉加入到一定量的浓硝酸中将铁粉加入到一定量的氯化铁溶液中3.用NaHCO3溶液处理NaAlO2溶液(由Al2O3过量NaOH溶液反应制得),测得溶液pH和Al(OH)3生成的量随加入NaHCO3溶液体积的变化情况如图所示。
下列说法正确的是()A.Al(OH)3的生成是因为NaHCO3促进了NaAlO2的水解B.b点和c点溶液所含微粒种类不同C.NaHCO3溶液的物质的量浓度为1.0 mol·L-1D.d点时:c(Na+)=c(CO2-3)+c(HCO-3)+c(H2CO3)4.在200 mL含Mg2+、Al3+、NH+4、H+、Cl-的溶液中,逐滴加入5 mol·L-1 NaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)的关系如图所示。
下列叙述不正确的是()A.x-y=0.01 molB.原溶液中c(Cl-)=0.75 mol·L-1C.原溶液的pH=1D.原溶液中n(Mg2+)∶n(Al3+)=5∶15.有一块镁铝合金,其中镁与铝的质量比是8∶9。
加入足量稀H2SO4使其完全溶解后,再加入NaOH溶液,生成沉淀的质量随NaOH溶液体积变化的曲线如下图,其中正确的是()6.如图所示是向MgCl2和AlCl3的混合溶液中加入一定量NaOH溶液,紧接着再加入一定量稀盐酸,生成沉淀的物质的量y与加入溶液的体积x的关系图。
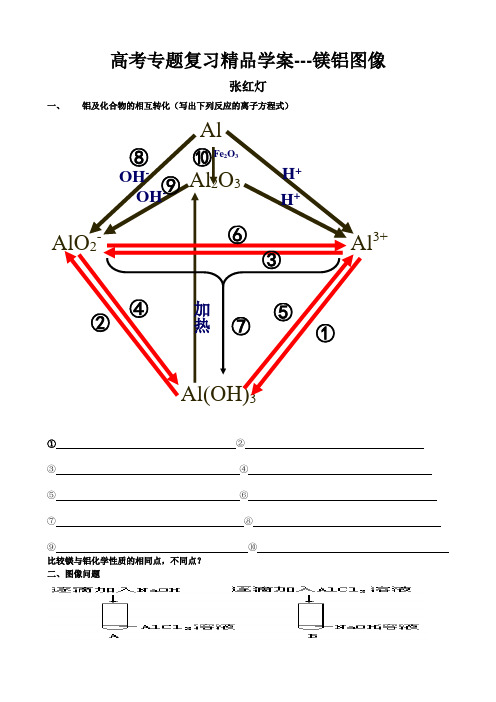
高考专题复习精品学案---镁铝图像张红灯一、 铝及化合物的相互转化(写出下列反应的离子方程式)① ②③ ④⑤ ⑥⑦ ⑧⑨ ⑩ 比较镁与铝化学性质的相同点,不同点?二、图像问题3+A图现象:B图现象:图像:图像:练习1.画出下列各反应中生成沉淀的物质的量(纵坐标)随所加入或滴入的反应物的物质的(横坐标)的变化曲线。
C、在偏铝酸钠溶液中滴加盐酸;D、在盐酸中滴加NaAlO2溶液E、往等物质的量的HCl 、AlCl3、MgCl2、NH4Cl混合溶液中加入NaOH溶液至过量F、在明矾溶液中加入氢氧化钡溶液。
练习2. 只用胶头滴管和试管通过两试剂的互滴,能区别的下列溶液A.NaAlO2和Al2(SO4)3 B.NaHCO3和Ca(OH)2 C.AlCl3和氨水 D.HCl和Na2CO3练习3.向含1 mol HCl和l mol MgSO4的混合溶液中加入1 mol/L的Ba(OH)2溶液,产生沉淀的物质的量(n)与加入Ba(OH)2溶液体积(V)间的关系图正确的是()4.图中横坐标为加入反应物的物质的量,纵坐标为产生沉淀的物质的量。
下列反应对应的曲线错误的是A.向NaAlO2溶液中滴入HCl至过量B.向澄清石灰水中通入CO2至过量C.向含有盐酸的AlCl3溶液中滴入NaOH溶液至过量D.向含有等物质的量的Ca(OH)2、KOH的混合溶液中通入CO2至沉淀消失练习5.在50 mL b mol·L-1的AlCl3溶液中加入50 mL a mol·L-1 NaOH溶液。
(1)当a≤3b时,生成Al(OH)3沉淀的物质的量为___________。
(2)当a、b满足____________条件时,无沉淀产生。
(3)当a、b满足____________条件时,先有沉淀生成,后又有部分沉淀溶解,此时Al(OH)3的质量_ __g。
练习6.向20 mL 2 mol·L-1的AlCl3溶液中,加入30 mL烧碱溶液,充分反应后,得0.78 g沉淀,求烧碱溶液的物质的量浓度是?练习7.将0.1 mol的镁、铝混合物溶于100 mL 2 mol·L-1 H2SO4溶液中,然后再滴加1 mol·L-1 NaOH溶液。
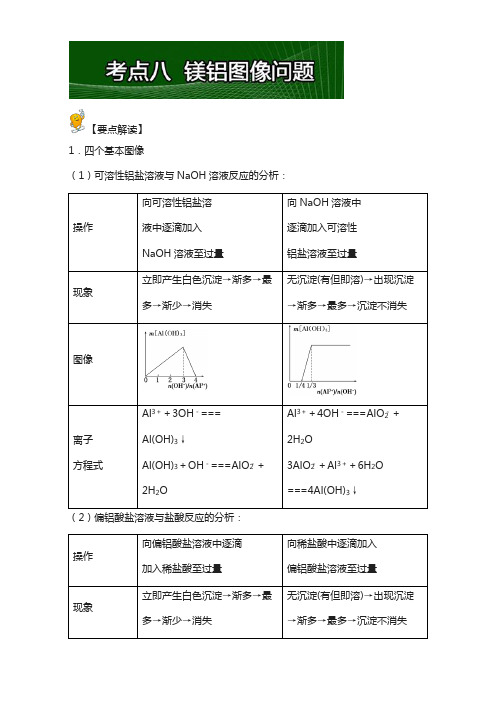
【要点解读】1.四个基本图像(1)可溶性铝盐溶液与NaOH溶液反应的分析:(1)向AlCl 3溶液中逐滴加入氨水或NaAlO 2溶液至过量,图像如图1所示。
(2)向NaAlO 2溶液中逐滴加入AlCl 3溶液或通入CO 2至过量,图像如图2所示。
图1 图2(3)向MgCl 2、AlCl 3和盐酸的混合溶液(即将Mg 、Al 溶于过量盐酸所得的溶液)中逐滴滴入NaOH 溶液至过量,图像如图3所示。
(4)向MgCl 2、AlCl 3混合溶液中先加入NaOH 溶液,后加入盐酸(NaOH 与盐酸的物质的量浓度相等),沉淀图像如图4所示。
图3 图4 【重难点指数】★★★★【重难点考向】关于铝的化合物的图像分析【典型例题1】下列曲线图(纵坐标为沉淀的量,横坐标为加入物质的量)与对应的选项相符合的是( )A .向1 L 浓度均为0.1 mol ·L -1的Ba(OH)2、NaAlO 2混合溶液中加入0.1 mol ·L-1的稀H 2SO 4B .向1 L 浓度分别为0.1 mol ·L -1和0.3 mol ·L -1的AlCl 3、NH 4Cl 的混合溶液中加入0.1 mol ·L -1的稀NaOH 溶液C.向烧碱溶液中滴加明矾溶液D.向AlCl3溶液中滴加过量氨水【答案】A【解析】A项,Ba(OH)2和NaAlO2的混合液中加入H2SO4,发生的反应依次为Ba2++2OH-+2H++SO2-4===BaSO4↓+2H2O、AlO-2+H++H2O===Al(OH)3↓、Al(OH)3+3H+===Al3++3H2O,所以加1 L H2SO4时,Ba(OH)2反应完,再加0.5 L H2SO4时AlO-2参加反应,再加1.5 L H2SO4时,Al(OH)3全部溶解,A正确;B项,向1 L浓度分别为0.1 mol·L-1和0.3 mol·L-1的AlCl3、NH4Cl的混合溶液中加入0.1mol·L-1的NaOH溶液,发生的反应依次是Al3++3OH-===Al(OH)3↓、OH-+NH+4===NH3·H2O、Al(OH)3+OH-===AlO-2+2H2O,所以沉淀Al3+和溶解Al(OH)3所用NaOH的量之比为3∶1,而图像上看到的是1∶1,B错误;C项,向烧碱溶液中(3)明晰Al3+溶液中加碱(OH图A中,n(H+)∶n(Al3+)=2∶1。
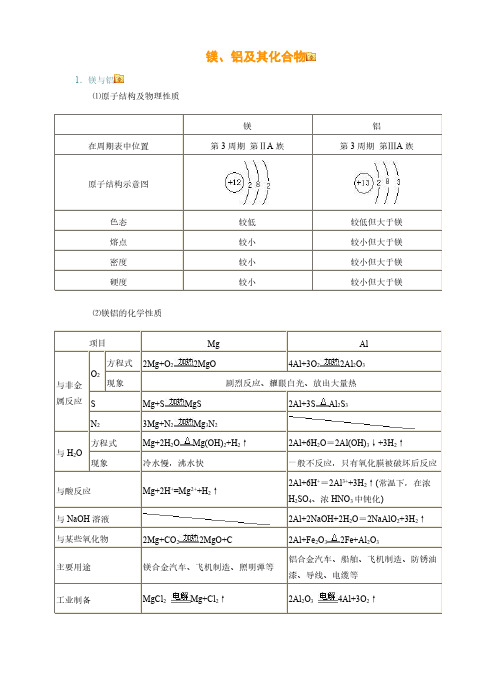
镁、铝及其化合物1.镁与铝⑴原子结构及物理性质镁铝在周期表中位置第3周期第ⅡA 族第3周期第ⅢA 族原子结构示意图色态较低较低但大于镁熔点较小较小但大于镁密度较小较小但大于镁硬度较小较小但大于镁⑵镁铝的化学性质项目Mg Al 与非金属反应O 2方程式2Mg+O 22MgO4Al+3O 22Al 2O 3现象剧烈反应、耀眼白光、放出大量热SMg+S MgS 2Al+3SAl 2S 3N 23Mg+N 2Mg 3N 2与H 2O方程式Mg+2H 2OMg(OH)2+H 2↑2Al+6H 2O =2Al(OH)3↓+3H 2↑现象冷水慢,沸水快一般不反应,只有氧化膜被破坏后反应与酸反应Mg+2H +=Mg 2++H 2↑2Al+6H +=2Al 3++3H 2↑(常温下,在浓H 2SO 4、浓HNO 3中钝化)与NaOH 溶液2Al+2NaOH+2H 2O =2NaAlO 2+3H 2↑与某些氧化物2Mg+CO 22MgO+C 2Al+Fe 2O 32Fe+Al 2O 3主要用途镁合金汽车、飞机制造、照明弹等铝合金汽车、船舶、飞机制造、防锈油漆、导线、电缆等工业制备MgCl 2Mg+Cl 2↑2Al 2O 34Al+3O 2↑2.镁和铝氧化物的对比氧化物MgO Al 2O 3属类碱性氧化物两性氧化物色态白色粉末、熔点高白色粉末、熔点高化学性质H 2OMgO+H 2O =Mg(OH)2↓(反应缓慢进行)不溶解也不反应酸液MgO+2H +=Mg 2++H 2OAl 2O 3+6H +=2Al 3++3H 2O NaOH 溶液不溶解也不反应Al 2O 3+2NaOH =2NaAlO 2+H 2O 重要用途制造耐火、耐高温材料制造耐火、耐高温器材,冶炼铝3.镁和铝的氢氧化物氢氧化物Mg(OH)2Al(OH)3属类碱两性氢氧化物色态白色固体白色固体溶解性难溶难溶电离方程式Mg(OH)2Mg 2++2OH-H 2O+AlO 2-+H +Al(OH)3Al 3++3OH-与HCl 等酸溶液Mg(OH)2+2HCl=MgCl 2+2H 2O (可溶于NH 4Cl 等强酸弱碱盐)Al(OH)3+3HCl =AlCl 3+3H 2O 与NaOH 溶液不反应Al(OH)3+NaOH=NaAlO 2+2H 2O 热不稳定性Mg(OH)2MgO+H 2O2Al(OH)3Al 2O 3+3H 2O实验室制法可溶性镁盐加NaOH 溶液Mg 2++2OH -=Mg(OH)2↓可溶性铝盐加氨水Al 3++3NH 3·H 2O =Al(OH)3↓+3NH +44.铝及其化合物间相互转化、铝三角及相关图象实验操作实验现象图象离子方程式①向可溶性铝盐溶液中滴加NaOH 溶液至过量先生成沉淀又溶解Al 3++3OH -=Al(OH)3↓;Al(OH)3+OH -=AlO 2-+2H 2O②向可溶性铝盐溶液中滴加稀氨水至过量出现白色沉淀Al 3++3NH 3·H 2O =Al(OH)3↓+3NH 4+③向NaOH 溶液中滴加可溶性铝盐溶液至过量开始无明显变化,一段时间后出现沉淀Al 3++4OH -=AlO 2-+2H 2O ;3AlO 2-+Al 3++6H 2O =4Al(OH)3↓④向可溶性偏铝酸盐溶液中滴加盐酸至过量先沉淀又溶解H ++AlO 2-+H 2O =Al(OH)3↓;Al(OH)3+3H +=Al 3++3H 2O⑤向可溶性偏铝酸盐溶液中逐渐通入CO 2气体至过量先无明显变化,后出现沉淀AlO -2+2H 2O+CO 2(过量)=Al(OH)3↓+HCO -32AlO 2-+3H 2O+CO 2(少量)=Al(OH)3↓+CO 2-3⑥向盐酸中滴加可溶性偏铝酸盐溶液至过量出现白色沉淀4H ++AlO 2-=Al 3++2H 2O ;3AlO 2-+Al 3++6H 2O =4Al(OH)3↓知识拓展:⑴Al(OH3)的两性:H2O+AlO2-+H+Al(OH)3Al3++3OH-酸式电离碱式电离当向Al(OH)3中加入酸溶液,平衡向碱式电离方向移动,使Al(OH)3溶解。
第11讲金属镁、铝及及其化合物一镁、铝单质的性质1.镁、铝的结构和存在形态2.镁、铝的物理性质镁、铝都是银白色、有金属光泽的固体,密度较小,硬度较低,均具有良好的延展性、导电性和导热性等。
3.铝的化学性质特别强调:1.常温下,能用铝制容器盛放浓硫酸、浓硝酸的原因是二者能使铝发生“钝化”,而不是铝与浓硫酸、浓硝酸不反应。
2.能与铝反应产生氢气的溶液可能呈强酸性也可能呈强碱性。
4.对比掌握镁的化学性质特别强调:1.Mg在CO2中能够燃烧,所以活泼金属镁着火不能用干粉灭火器和泡沫灭火器灭火。
2.镁也可在氮气中燃烧,生成氮化镁(Mg3N2),氮化镁能与水剧烈反应生成Mg(OH)2沉淀并放出氨气。
5.从海水中提取镁(1)工艺流程(2)基本步骤及主要反应特别强调:1.由MgCl2·6H2O得到无水MgCl2,必须在HCl气流中加热,以防MgCl2水解。
2.因镁在高温下能与O2、N2、CO2等气体发生反应,故工业电解MgCl2得到的镁,应在H2氛围中冷却。
3.Mg在空气中燃烧得到的固体物质主要为MgO和少量Mg3N2及C的混合物。
4.Mg(OH)2为难溶于水的白色沉淀,故常用NaOH溶液检验Mg2+的存在。
5.由于Mg(OH)2的溶解度比MgCO3的小,故水垢的主要成分中含有的是Mg(OH)2,而非MgCO3。
6.镁的用途(1)镁合金用于制造火箭、导弹和飞机的部件;(2)镁制造信号弹和焰火;(3)MgO作耐火材料。
课堂检测011.科学家发明的透明坚硬镁铝氧化物新型材料,可以用作显示器和手机屏幕,下列关于镁、铝的说法正确的是()A.镁铝制品在空气中能稳定存在是因为铝不活泼B.浓HNO3、浓H2SO4能用铝制器皿盛装是因为铝与浓HNO3、浓H2SO4不反应C.镁、铝均能与NaOH溶液反应D.铝与Fe2O3发生铝热反应是利用了Al的还原性比Fe强答案:D2.小明家中收藏着一件清末的铝制品佛像,该佛像至今仍保存完好。
高三专题:有关镁、铝、铁的典型图像、推断、实验题1、在Al2(SO4)3和MgSO4的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如下图所示,则原混合液中Al2(SO4)3与MgSO4的物质的量浓度之比为A、6:1B、3:1C、2:1D、1:22、某溶液中可能含有Fe2+、Mg2+、Cu2+、NH4+、Al3+中的一种或几种。
当加入一种淡黄色固体并加热溶液时,有刺激性气体放出和白色沉淀生成,加入淡黄色固体的物质的量(横坐标)与析出沉淀和产生气体的物质的量(纵坐标)的关系,如下图所示。
请填写下列空白:⑴在该溶液中含有的离子是:,它们的物质的量浓度之比为:。
⑵所加的淡黄色固体是(化学式)。
3、将0.1 mol的镁、铝混合物溶于100 mL 2mol/LH2SO 4溶液中,然后再滴加1 mol/L NaOH溶液。
请回答:⑴若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如下图所示。
当V1=160mL时,则金属粉末中n(Mg)= mol,V2= mL。
⑵若在滴加NaOH溶液过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积V(NaOH) mL。
⑶若混合物仍为0.1 mol,其中Mg粉的物质的量分数为a,用100 mL 2 mol/L的硫酸溶解此混合物后,再加入450 mL 1mol/L的NaOH溶液,所得沉淀中无Al(OH)3。
满足此条件的a的取值范围是:。
4、将一定量混合均匀的铁粉与硫粉在隔绝空气的条件下共热,充分反应后冷却至室温,得到固体A。
将质量为m的固体A加入到300 mL 2 mol/L盐酸中使之完全溶解。
测得室温下加入固体A的质量与收集到气体体积(已换算成标准状况)的关系如右图所示(假设所得氢硫酸溶液饱和前无硫化氢气体逸出)。
已知:①加入固体A的质量m≤3.2 g时,收集到的气体为H2;②当m>3.2 g时,收集到的气体为H2和H2S的混合气体。
镁铝图像及计算一.选择题1.下列说法在一定条件下可以实现的是()①酸性氧化物与碱发生反应②弱酸与盐溶液反应可以生成强酸③没有水生成,也没有沉淀和气体生成的复分解反应④两种酸溶液充分反应后的溶液体系为中性⑤有单质参加的非氧化还原反应⑥两种氧化物反应的产物有气体A.①②③④⑤⑥B.②④⑤⑥C.①②③⑤D.③④⑤⑥2.下列液体中,不会出现丁达尔效应的分散系是 ( )①鸡蛋白溶液②水③淀粉溶液④硫酸钠溶液⑤沸水中滴入饱和FeCl3溶液⑥肥皂水⑦碘溶于酒精配成碘酒A.②④B.①③ C.⑤⑥ D.④⑦3“银针验毒”在我国有上千年历史,银针主要用于检验是否有含硫元素的有毒物质。
其反应原理之一为:Ag+2H2S+O2→Ag2S+H2O。
当银针变色后,将其置于盛有食盐水的铝制容器中一段时间后便可复原。
以下说法不正确的是( )A.上述验毒反应的氧化产物和还原产物的物质的量之比为1∶1B.银针复原发生的反应可能为:3Ag2S+2Al=6Ag+Al2S3C.当银针变黑时,所检验的物质有毒D.银针验毒时,Ag被氧化4.近年来,科学家正在探索利用铝粉作为新能源的可能性,以期铝能成为一种石油的取代物。
假如铝作为一种普遍使用的新型能源被开发利用,关于其有利因素的下列说法,你认为哪项是错误的A.铝质轻,便于运输、贮存,且安全B.铝燃烧时放出的热量大,且燃烧后产物对环境的污染容易得到有效的控制C.在地球上,铝矿资源比较丰富D.现代电冶铝的工业技术已为铝作为新能源奠定了重要基础5.已知室温下,Al(OH)3的Ksp或溶解度远大于Fe(OH)3。
向浓度均为0.1mol/L的Fe(NO3)3和Al(NO3)3混合溶液中,逐滴加入NaOH溶液。
下列示意图表示生成Al(OH)3的物质的量与加入NaOH溶液的体积的关系,合理的是()。
A: B: C: D:6.在给定条件下,下列选项所示的物质间转化均能实现的是A.B.C.D.7.向甲溶液中滴加(或通入)乙溶液(或气体),生成沉淀的质量与加入乙的关系符合下图的是()A.向硫酸铝溶液中通入氨气B.向NaAlO2溶液中滴加盐酸C.向澄清石灰水中通CO2 D.向硫酸铝溶液中滴加氢氧化钠溶液8.向100mL0.1mol.L﹣1的AlCl3溶液中,加入1mol.L﹣1的NaOH溶液VmL后,再滴加1mol.L﹣1盐酸.滴加盐酸的体积(横坐标)与生成沉淀的质量(纵坐标)如下图所示的关系,则加入的NaOH溶液的体积为()A.10mL B.30mL C.40mL D.50mL9.Zn(OH)2是两性氢氧化物,和强酸反应时生成Zn2+,跟强碱反应时生成ZnO22-.现有三份等物质的量浓度、等体积的MgCl2、ZnCl2、AlCl3溶液(配制时均加入少量盐酸),现将一定浓度的NaOH溶液,分别滴入三种溶液中至过量,NaOH溶液的体积x(mL)与生成沉淀的物质的量y(mol)的关系如下图所示,则与MgCl2、ZnCl2、AlCl3三种溶液一一对应的正确图象是()A.③②①B.③②④C.③⑤① D.③⑤④10.某溶液中可能含有H+、NH+4、Mg2+、Al3+、Fe3+、CO2-3、SO2-4、NO-3中的几种。
镁铝图像专题
1、将溶液(或气体)X,逐渐加入(或通入)到一定量溶液Y中,产生沉淀的量与加入X的量的关系如下图,符合题意的一组物质是()
A B C D
X
Ba Cl2HCl
N
H3
HCl
Y
Na
2CO3
NaAlO2
A
lCl3
AgNO3
2、现有AlCl3和MgSO4混合溶液,向其中不断加入NaOH溶液,得到沉淀的量与加入NaOH溶液的体积如图所示,原溶液中Cl-与SO42-的物质的量之比为( )
A.1 :3 B.2 :3
C.6 :1 D.3 :1
3、某1 L混合溶液中,溶质X、Y的浓度都为0.1 mol·L-l,向混合溶液中滴加某溶液Z(0.1molL-l 氢氧化钠或硫酸溶液),所得沉淀的物质的量如图所示,则X、Y、Z分别是()
A.硫酸铝、硫酸铁、氢氧化钠
B.硫酸铝、硫酸镁、氢氧化钠
C.偏铝酸钠、氢氧化钡、硫酸
D.偏铝酸钠、氯化钡、硫酸
4、下图中横坐标为加入反应物的物质的量,纵坐标为产生沉淀的物质的量。
下列反应对应的曲线错误的是()
A.向NaAlO2溶液中滴入HCl至过量
B.向澄清石灰水中通入CO2至过量
C.向含有盐酸的AlCl3溶液中滴入NaOH溶液至过量
D.向含有等物质的量的Ca(OH)2、KOH的混合溶液
中通入CO2至沉淀消失
5、准确称取6.0 g铝土矿样品(含Fe2O3),加入100 mL稀硫酸中,充分反应后向滤液中加入10 mol·L -1NaOH溶液,产生沉淀的质量和加入NaOH溶液体积之间的关系如右图所示。
则所用硫酸物质的量浓度为()
A.1.75 mo l·L-1 B .3.50 mol·L-1
m(沉淀)/g
沉淀的物
质的量
0 0.4 0.5 V(NaOH)
C.0.85 mol·L-1 D.无法确定
6、如图4-9至图4-15所示,横坐标表示通入气体或加入试剂的体积,纵坐标表示产生沉淀的物质的量。
适合下列各种情况的分别填入该题后(填图的字母代码)。
①石灰水中通入二氧化
碳。
②氯化铝溶液中滴入NaOH溶液。
③偏铝酸钠溶液中加入稀盐酸。
④盐酸和氯化铝混合溶液中逐滴加入氢氧化钠溶液。
⑤向MgCl2和AlCl3混合液中加入过量的NaOH溶液。
⑥向MgCl2和AlCl3混合液中先加NaOH溶液后加HCl溶液。
⑦向AlCl3溶液中加氨水。
⑧向NaAlO2溶液中通入CO2气体。
⑨向KAl2(SO4)3中滴加Ba(OH)2。
⑩向Al2(SO4)3中滴加NaAlO2溶液。
7、把由NaOH、 AlCl3 、MgCl2 3种固体组成的混合物溶于足量的
水中,有0.58g白色沉淀析出,向所得的浊液中,逐滴加入0.5mol/L
的盐酸,加入盐酸的体积和生成沉淀的质量如图4-16所示:
(1).混合物中NaOH的质量是 g;
AlCl3的质量是 g;
MgCl2的质量是 g。
(2).P点所表示盐酸加入体积是 mL。
8、向 20 mL曾加过盐酸的氯化铝溶液中逐滴加入2 mol/L的NaOH
溶液,生成沉淀的质量与加入NaOH溶液体积的关系如下图所示求:
(1).原溶液中,;
(2).B点为______mL.
9、将某质量的镁铝合金溶解在500 mL盐酸中,然后取出 10 mL溶液用1 mol/L的氢氧化钠溶液滴定,产生的沉淀量W g与所加氢氧化钠溶液V mL的关系如下图所示.求:
(1).合金中镁和铝的物质的量之比;
(2).盐酸的物质的量浓度(没反应后溶液体积不变).
镁铝图像专题
1.将溶液(或气体)X,逐渐加入(或通入)到一定量溶液Y中,产生沉淀的量与加入X的量的关系如下图,符合题意的一组物质是()
A B C D
X
H2
S
HCl
N
H3
NH3·H
2
O
Y
Na
2
SO4
Na[Al(O
H)4]
A
lCl3
AgNO3
2.现有AlCl3和MgSO4混合溶液,向其中不断加入NaOH溶液,得到沉淀的量与加入NaOH溶液的体积如图所示,原溶液中Cl-与SO42-的物质的量之比为( )
A.1 :3 B.2 :3
C.6 :1 D.3 :1
3.某1 L混合溶液中,溶质X、Y的浓度都为0.1 mol·L-l,向混合溶液中滴加某溶液Z(0.1molL-l氢氧化钠或硫酸溶液),所得沉淀的物质的量如图所示,则X、Y、Z分别是()
A.硫酸铝、硫酸铁、氢氧化钠
B.硫酸铝、硫酸镁、氢氧化钠
沉淀的物
质的量
0 0.4 0.5 V(NaOH)
C .偏铝酸钠、氢氧化钡、硫酸
D .偏铝酸钠、氯化钡 、 硫酸
4. Mg 2+和Al 3+的混和溶液中逐滴加入NaOH 溶液,形成沉淀的情况出现两种图示。
图1为小杨同学绘制,图2是小周根据实验结果绘制,查阅沉淀生成和Al(OH)3溶解的pH 情况如表。
下列说法正确的是( )
A. 据图1计算得n(Mg 2+): n(Al 3+)=2:1
B. 小周实验中,OA 段生成两种沉淀
C. 图2中OA 段表示仅生成Al(OH)3
沉淀,AB
段仅生成 Mg(OH)2
D. 结合表中数据和图2分析,AB 段可能发生:Mg 2++2AlO 2—+4H 2O =2Al(OH)3↓+Mg(OH)2↓
5.下图中横坐标为加入反应物的物质的量,纵坐标为产生沉淀的物质的量。
下列反应对应的曲线错误的是( )
A .向NaAlO 2溶液中滴入HCl 至过量
B .向澄清石灰水中通入CO 2至过量
C .向含有盐酸的AlCl 3溶液中滴入NaOH 溶液至过量
D .向含有等物质的量的Ca(OH)2、KOH 的混合溶液 中通入CO 2至沉淀消失
6.准确称取6.0 g 铝土矿样品(含Fe 2O 3),加入100 mL 稀硫酸中,充分反应后向滤液中加入10 mol·L -1NaOH 溶液,产生沉淀的质量和加入NaOH 溶液体积之间的
关系如
右图所示。
则所用硫酸物质的量浓度为( )
A .1.75 mol·L -1
B .3.50 mol·L -1
C .0.85 mol·L -1
D .无法确定
7.如图4-9至图4-15所示,横坐标表示通入气体或加入试剂的体积,纵坐标表示产生沉淀的物质的量。
适合下列
各种情
况的分别填入该题
后(填图的字母代码)。
①石灰水中通入二氧化碳 F 。
图1 图2
A O
1 2 3 4 5 6 1 2 3 4 5 6 m (沉淀)/g
②氯化铝溶液中滴入NaOH溶液 B。
③偏铝酸钠溶液中加入稀盐酸 A 。
④盐酸和氯化铝混合溶液中逐滴加入氢氧化钠溶液C。
⑤向MgCl2和AlCl3混合液中加入过量的NaOH溶液 D。
⑥向MgCl2和AlCl3混合液中先加NaOH溶液后加HCl溶液G。
⑦向AlCl3溶液中加氨水E。
⑧向NaAlO2溶液中通入CO2气体E。
⑨向KAl2(SO4)3中滴加Ba(OH)2 D 。
⑩向Al2(SO4)3中滴加NaAlO2溶液 E 。
8.把由NaOH、 AlCl3 、MgCl2 3种固体组成的混合物溶于足量的水中,有0.58g白色沉淀析出,向所得的浊液中,逐滴加入0.5mol/L的盐酸,加入盐酸的体积和生成沉淀的质量如图4-16所示:
(1)混合物中NaOH的质量是2.6 g;AlCl3的质量是1.335 g;MgCl2的质量是 0.95 g。
(2)P点所表示盐酸加入体积是 130 mL。
9.向 20 mL曾加过盐酸的氯化铝溶液中逐滴加入2 mol/L的NaOH溶液,
生成沉淀的质量与加入NaOH溶液体积的关系如下图所示求:
1)原溶液中C(Al3+)= 5 mol/L ,C(Cl-)= 2
mol/L ;
2)B点为_25_____mL.
10.将某质量的镁铝合金溶解在500 mL盐酸中,然后取出 10 mL溶液用1 mol/L的氢氧化钠溶液滴定,产生的沉淀量W g与所加氢氧化钠溶液V mL的关系如下图所示.求:
1)合金中镁和铝的物质的量之比;3:2
2)盐酸的物质的量浓度(没反应后溶液体积不变).
1.4mol/L。