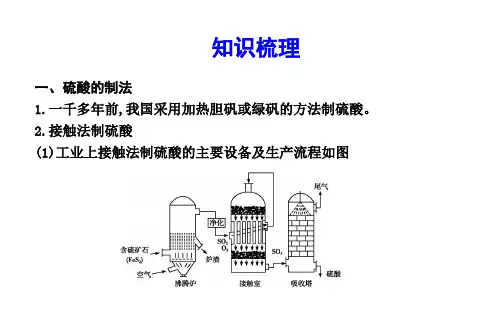
苏教版必修1 专题4第1单元 含硫化合物的性质和应用(第2课时) 课件(41张)
- 格式:ppt
- 大小:1.68 MB
- 文档页数:16







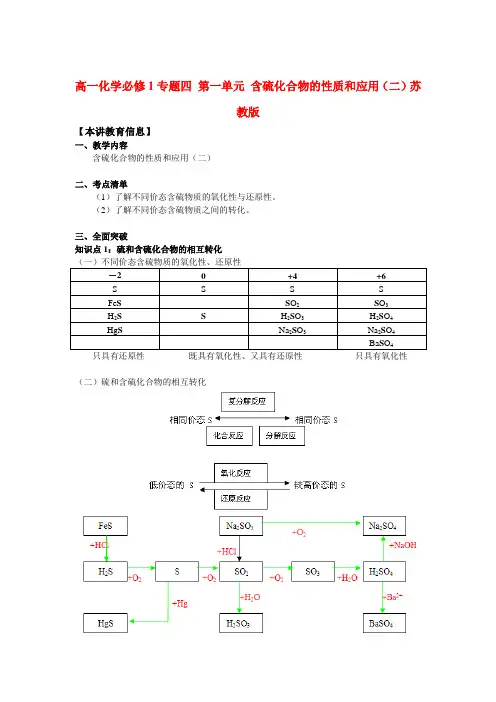
高一化学必修1专题四第一单元含硫化合物的性质和应用(二)苏教版【本讲教育信息】一、教学内容含硫化合物的性质和应用(二)二、考点清单(1)了解不同价态含硫物质的氧化性与还原性。
(2)了解不同价态含硫物质之间的转化。
三、全面突破知识点1:硫和含硫化合物的相互转化只具有还原性既具有氧化性、又具有还原性只具有氧化性(二)硫和含硫化合物的相互转化1. 硫的性质(1)硫单质的物理性质:单质硫是黄色固体,俗称硫磺,难溶于水,微溶于酒精,易溶于二硫化碳(CS2),熔点112.8℃,沸点444.6℃。
自然界中的火山喷口和岩石夹缝中有游离态的硫;自然界中也存在许多化合态的硫。
硫粉对某些疾病有防治作用。
(2)硫的化学性质:①可燃性:S + O2点燃SO2②与氢气反应:H2 + S△H2S ;③与金属反应:2Na + S == Na2S,Fe + S △FeS,2Cu + S△Cu2S;④与碱溶液反应:3S + 6NaOH(浓)加热2Na2S + Na2SO3 + 3H2O(用于实验室中清洗有S残留的仪器);⑤与浓硫酸反应:S + 2H2SO4(浓)△3SO2↑+ 2H2O。
2. 硫化氢的性质(1)硫化氢的物理性质:硫化氢是有臭鸡蛋味的有毒气体,能溶于水,常温常压以1:2.6溶于水。
(2)硫化氢的化学性质:①可燃性:O2不足2H2S + O2点燃2S + 2H2O,O2足量2H2S + 3O2点燃2SO2 + 2H2O .②受热分解:H2S △H2 + S.③和碱反应:H2S + 2NaOH == Na2S + 2H2O,H2S + NaOH == NaHS + H2O.Na2S + H2S == 2NaHS.H2S溶于水得氢硫酸溶液,是二元弱酸,易挥发,具有强还原性。
④强还原性:如:2H2S + SO2 == 3S + 2H2O,H2S + Cl2 == S + 2HCl(Br2、I2也同样发生类似的反应),H2S + 2FeCl3 == 2FeCl2 + S↓+ 2HCl,H2S + H2SO4(浓)== S↓+ SO2 + 2H2O等反应。