元素与物质的分类
- 格式:ppt
- 大小:1.22 MB
- 文档页数:41


2.1元素与物质分类考点1 元素与物质的关系1.根据元素组成对物质分类(1)元素具有相同核电荷数的一类原子的总称。
(2)元素组成物质元素――→组成⎩⎪⎨⎪⎧单质:同种元素组成的纯净物化合物:不同种元素组成的纯净物(3)纯净物与混合物①纯净物:由同种单质或化合物组成的物质。
②混合物:由几种不同的单质或化合物组成的物质。
③纯净物和混合物的区别纯净物 混合物 有固定的组成和结构 无固定的组成和结构 有一定的熔、沸点 无一定的熔、沸点 保持一种物质的性质保持原有物质各自的性质2.游离态与化合态元素以单质形式存在时,称为元素的游离态;元素以化合物形式存在时,称为元素的化合态。
3.“价-类”二维图主要表明氢化物、单质、氧化物、酸、碱、盐等类别的物质考点2 物质的分类与物质的性质1.酸性氧化物与碱性氧化物(1)酸性氧化物.(大多数非金属氧化物,如:SO2、SO3、CO2、Mn2O7)能与碱反应生成盐和水的氧化物叫酸性氧化物(注意只生成盐和水,不变价)。
注意:①酸性氧化物都能跟强碱反应,生成盐和水②大多数酸性氧化物能跟水化合生成酸(SiO2除外),不是全部。
③大多数酸性氧化物都可由非金属与O2化合生成点燃例如:①2NaOH + CO2 === Na2CO3 + H2O ②CO2 + H2O === H2CO3③C + O2CO2(2)碱性氧化物.(大多数金属氧化物,如:CaO、MgO、CuO、Fe2O3)能与酸反应生成盐和水的氧化物叫碱性氧化物。
CaO、Fe2O3等大多数金属氧化物都是碱性氧化物(3)两性氧化物.既能与碱反应生成盐又能与酸反应生成盐和水的氧化物叫两性氧化物。
如Al2O3。
【注意】正确理解几个“一定”“不一定”(1)碱性氧化物一定是金属氧化物,但金属氧化物不一定是碱性氧化物,如Mn2O7为酸性氧化物。
(2)酸性氧化物不一定是非金属氧化物,如Mn2O7;非金属氧化物也不一定是酸性氧化物,如CO、NO。
第1节 元素与物质的分类一。
教材分析 (一)知识脉络学生在初中化学中已经认识了几种具体物质的性质和单质、酸、碱、盐、氧化物的一般性质,但他们只是从单个物质的角度认识物质的性质,尚未从一类物质的角度认识物质的性质,更未建立起元素与物质的关系。
因此,通过元素与物质的关系的研究,引导学生以元素的观点认识物质;通过研究用不同的标准对物质进行分类,使学生建立分类的观点。
在分类的基础上,研究纯净物—-单质、氧化物、酸、碱、盐之间的相互关系;在学生原有的认知结构中已存在溶液、浊液等混合物的观点,进而引进一种新的混合物——胶体,建立分散系的概念,丰富学生对混合物的认识,并使学生了解胶体的一般性质,学会从粒度大小的角度对混合物进行分类。
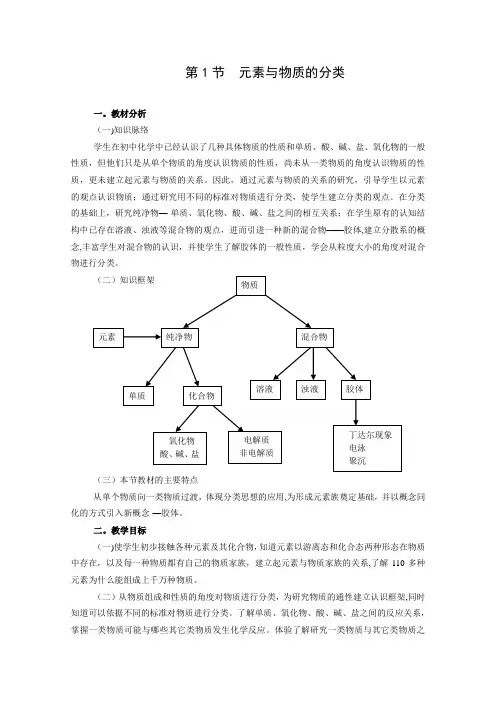
(二)知识框架(三)本节教材的主要特点从单个物质向一类物质过渡,体现分类思想的应用,为形成元素族奠定基础,并以概念同化的方式引入新概念-—胶体。
二。
教学目标(一)使学生初步接触各种元素及其化合物,知道元素以游离态和化合态两种形态在物质中存在,以及每一种物质都有自己的物质家族,建立起元素与物质家族的关系,了解110多种元素为什么能组成上千万种物质。
(二)从物质组成和性质的角度对物质进行分类,为研究物质的通性建立认识框架,同时知道可以依据不同的标准对物质进行分类。
了解单质、氧化物、酸、碱、盐之间的反应关系,掌握一类物质可能与哪些其它类物质发生化学反应。
体验了解研究一类物质与其它类物质之物质元素纯净物混合物单质化合物溶液浊液胶体氧化物酸、碱、盐电解质非电解质丁达尔现象 电泳 聚沉间反应的关系的过程方法.(三)知道胶体是一种重要的分散系,了解胶体的丁达尔现象、电泳、聚沉等特性,能够列举生活中胶体的实例,了解胶体性质的简单应用.三.教学重点(一)知识与技能:元素与物质的关系;胶体的性质.(二)过程与方法:探讨各类物质的通性及其相互反应关系,学会如何以元素为核心认识物质,从多角度依据不同标准对物质进行分类并体验分类的重要意义。




【重点难点】重点:物质的分类及胶体的概念、性质。
难点:物质的分类,单质、氧化物、酸、碱和盐之间的相互关系。
【知识讲解】一、元素与物质的关系:1、元素组成物质:自然界中形形色色的物质都是由元素组成的,由元素组成的物质可能是单质,也可能是化合物。
2、元素在物质中的存在形态元素在物质中的存在形态有两种:游离态和化合态。
(1)游离态:元素以单质存在的形态。
例如:氧气中的氧元素就是以游离态存在。
(2)化合态:元素以化合物存在的形态。
例如:NaOH、Na2CO3中的氧元素就是以化合态存在。
元素的游离态、化合态可以相互转化,如O2与C反应生成CO或CO2,游离态的氧元素变成了化合态氧元素,又如KClO3加热制O2,化合态的氧元素又变成了游离态氧元素。
3、物质种类繁多的原因:(1)同种元素可形成不同的单质。
氧元素能形成O2、O3两种不同单质;碳元素形成金刚石、石墨、C60、C70等多种单质;磷元素能形白磷、红磷等单质。
(2)不同种类的元素形成不同种类的化合物。
大的方面可以分为氧化物、酸、碱、盐,而每种类别物质又可以再细分。
以后还要对物质进行详细分类。
(3)元素种类相同时,也可以组成不同的化合物。
如氮元素、氧元素可以组成N2O、NO、N2O3、NO2、N2O4、N2O5 等多种氧化物,主要就是氮元素的化合价不同,组成了不同种类的氧化物。
另外,有机物中还要出现同分异构体(分子式相同而结构不同的物质)。
以上这些原因都决定了元素种类虽然不多,但可以组成多种多样的物质。
二、物质的分类1、物质分类的方法依据不同的分类标准,可以对物质进行不同的分类。
例如:依据物质中所含物质种类的多少,可以把物质分为混合物和纯净物。
混合物是由两种或多种物质混合而成的物质,纯净物则是由一种物质组成的物质。
对于纯净物,依据所含元素种类的多少,可以划分为单质和化合物,由同种元素组成的纯净物叫单质,由不同种元素组成的纯净物叫化合物。
单质可以再分为金属单质、非金属单质、稀有气体单质。



元素与物质的分类教案第一章:物质的分类1.1 教学目标让学生了解和掌握物质的分类方法。
使学生理解纯净物和混合物的区别。
让学生掌握元素、化合物和物质之间的关系。
1.2 教学内容物质分类的基本概念:纯净物、混合物、元素、化合物。
物质分类的方法和原则。
物质分类的实际应用。
1.3 教学重点和难点物质分类的基本概念的理解和应用。
物质分类方法的掌握。
物质分类原则的理解。
1.4 教学方法和手段采用讲授法,讲解物质分类的基本概念、方法和原则。
使用案例分析法,分析物质分类的实际应用。
使用多媒体手段,展示物质分类的图像和实例。
1.5 教学步骤引入物质分类的概念,讲解纯净物和混合物的区别。
讲解元素的定义和特点,介绍元素周期表。
讲解化合物的定义和特点,介绍化合物的组成和性质。
通过实例分析,展示物质分类的方法和原则的应用。
总结物质分类的知识点,进行复习和巩固。
第二章:元素的概念和特点2.1 教学目标让学生了解和掌握元素的概念和特点。
使学生能够识别和记忆元素的符号和名称。
让学生了解元素在物质中的存在和作用。
2.2 教学内容元素的概念和定义。
元素的特点和性质。
元素周期表的结构和应用。
2.3 教学重点和难点元素的概念和特点的理解和应用。
元素符号的记忆和识别。
元素周期表的结构和应用的理解。
2.4 教学方法和手段采用讲授法,讲解元素的概念和特点。
使用案例分析法,分析元素的存在和作用。
使用多媒体手段,展示元素周期表的图像和实例。
2.5 教学步骤引入元素的概念,讲解元素的定义和特点。
讲解元素符号的表示方法,进行符号的记忆和识别练习。
介绍元素周期表的结构和应用,讲解周期表的排列规律。
通过实例分析,展示元素的存在和作用。
总结元素的知识点,进行复习和巩固。
第三章:化合物的组成和性质3.1 教学目标让学生了解和掌握化合物的组成和性质。
使学生能够识别和记忆化合物的名称和化学式。
让学生了解化合物在物质中的存在和作用。
3.2 教学内容化合物的组成和定义。

化学元素与物质的分类化学元素是组成物质的基本单位,而物质是由不同元素的组合构成的。
根据元素和物质的特征和性质,可以将其进行不同的分类。
首先,我们可以根据元素的性质将其进行分类。
元素可以分为金属元素、非金属元素和半金属元素。
金属元素具有以下特点:导电性好、热导性好、金属光泽、具有延展性和韧性、高熔点和高密度等。
常见的金属元素有铁、铜、铝、银、金等。
非金属元素具有以下特点:导电性差、热导性差、大部分是气体或者在常温下是固体,脆性较大。
常见的非金属元素有氧、氮、氢、碳、硫等。
半金属元素具有金属和非金属的一些性质。
半金属元素可以是半导体材料,具有介于导电体和绝缘体之间的导电性。
常见的半金属元素有硅、锗、硼等。
其次,根据物质的组成和特性,我们可以将物质进行二元分法分类、化合物分类、混合物分类。
二元分法是指将物质分为无机物和有机物。
无机物是指不含有碳元素的物质,如水、盐等。
有机物是指含有碳元素的物质,如石油、木材等。
化合物是由两种或两种以上的元素通过化学反应结合而成的物质。
根据元素的不同,化合物可以分为无机化合物和有机化合物。
无机化合物主要是由非金属元素和金属元素结合而成的,如氧化物、硫化物等。
有机化合物是由碳元素和其他元素结合而成的,如醇、酮、酸等。
混合物是由两种或两种以上的物质通过物理方法混合而成的物质。
根据其组成和特性的不同,混合物可以分为均相混合物和非均相混合物。
均相混合物是指组成物质的物种均匀分布在整个混合物中,如盐水、空气等。
非均相混合物是指组成物质的物种不均匀地分布在混合物中,如混合油、混凝土等。
此外,我们还可以根据物质的物理状态将其进行分类。
根据物质的不同状态,物质可以分为固体、液体和气体。
固体具有一定的形状和体积,其分子间相互吸引力较大,分子振动范围较小。
液体具有固定的体积,但没有固定的形状,其分子间相互吸引力较小,分子振动范围较大。
气体没有固定的体积和形状,分子间相互吸引力非常小,分子振动范围很大。