专题:铁三角的转化及应用
- 格式:docx
- 大小:319.79 KB
- 文档页数:10


铁三角的转化及应用教学设计
河北定州中学高三化学组马睿
一、考情学情分析
近几年来各地高考对铁的化合物考察非常重视,总体考查上侧重在工艺流程或实验题中,铁的化合物之间的相互转化及应用。
对学生而言,新授课已经结束,学生已经具备了较完备的知识结构,分析问题也更加深刻,讨论也能更加有效的实施。
通过一轮复习,让学生实现对知识掌握系统化。
二、教学目标
1.知识与技能①以二价铁与三价铁与铁的转化为例,理解变价金属元素的氧化还原反应②掌握二价铁三价铁的离子共存问题③掌握铁的化合物在工艺流程中的应用
2.过程与方法①要求学生规范解答过程②提高综合分析问题的能力
3.情感态度与价值观通过分析物质制备的流程过程,使学生关注与化学有关的社会热点问题,认识环境保护和资源合理开发的重要性。
三、教学重难点
铁三角的相互转化及应用。
四、教学方法
讲练结合、归纳总结
五、教学过程
思考,回答两
【思考】哪些离子不与二价铁,三价铁大量共存【总结】不与二价铁,三价铁大量共存的离子【板书】二.二价铁三价铁的离子共存
【投影】补充
六、板书设计
铁三角的转化及应用
一.铁三角的转化
二.二价铁三价铁的离子共存
三.铁三角中的计算
四.铁三角在工艺流程中的应用。

铁三角转化及应用铁三角是一个经济学上的概念,指代三个旨在维护自身利益的角色:政府、企业和工会。
为了实现某些目标,这三方面通常会密切合作。
然而,这种紧密的合作常常会导致利益共享的问题,以及对消费者和其他利益相关者的剥夺。
在这个概念中,政府通常会通过制定政策来监管企业和工会的活动。
企业则会利用政府的支持,为自己谋取更多的利益并保护自己免于竞争。
工会则通过与政府和企业合作,获取更好的工资和福利,并确保劳动者得到公正的待遇。
铁三角可以定义为一个由政府、企业和工会组成的利益集团,他们会通过合作来影响政策制定过程,并谋求自己的利益。
虽然这种合作对于某些方面有利,但对于社会福利和公正有害。
铁三角的存在导致了很多问题。
它们通常不关注消费者的利益,而是旨在实现自己的目标。
政府和企业的合作可以导致政府政策的不公正,而工会则可能会在劳资谈判中获得更高的工资和福利,这最终会导致生产成本的上升。
铁三角的存在也就意味着利益的过度保护,这样可能会导致消费者的需要和利益被忽视。
铁三角还认为政府应该为他们服务,这意味着政府资源的过度使用,并削弱了公共服务和社会基础设施。
然而,铁三角也可以有一些优点。
政府可以通过与企业和工会合作来更好地监管企业的活动,确保企业的行为符合法律规定。
工会也能够确保劳动者得到合理的待遇和福利。
企业则可以更好地了解政策制定过程,以便更好地谋求自己的利益。
铁三角的最大问题在于,他们通常会通过利用彼此之间的势力来谋求自己的利益,以及在政策制定过程中剥夺其他利益相关者的权益。
为了解决这一问题,我们需要寻找其他形式的合作,以更好地实现公共利益和社会公正。
我们可以使用其他的办法来代替铁三角。
例如,政策制定者应该以全社会的利益为先,而非铁三角内部的利益。
政府应该与企业和工会的民间组织进行对话,以更好地理解公民的需要和合法要求。
在劳资谈判中,应着眼于结果的良好表现,而不是颠覆现有的社会协议。
企业也需要公正的机制,来确保消费者得到高质量的产品和服务。
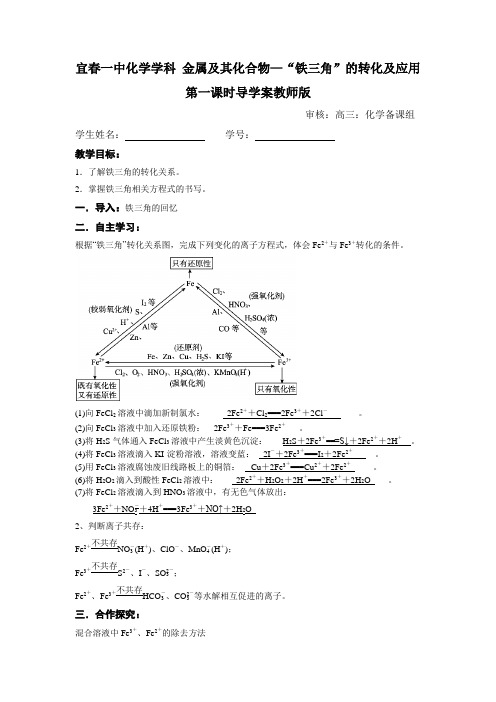
宜春一中化学学科金属及其化合物—“铁三角”的转化及应用第一课时导学案教师版审核:高三:化学备课组学生姓名:学号:教学目标:1.了解铁三角的转化关系。
2.掌握铁三角相关方程式的书写。
一.导入:铁三角的回忆二.自主学习:根据“铁三角”转化关系图,完成下列变化的离子方程式,体会Fe2+与Fe3+转化的条件。
(1)向FeCl2溶液中滴加新制氯水:_____2Fe2++Cl2===2Fe3++2Cl-_______。
(2)向FeCl3溶液中加入还原铁粉:__2Fe3++Fe===3Fe2+___。
(3)将H2S气体通入FeCl3溶液中产生淡黄色沉淀:___ H2S+2Fe3+===S↓+2Fe2++2H+__。
(4)将FeCl3溶液滴入KI-淀粉溶液,溶液变蓝:__2I-+2Fe+===I2+2Fe+_____。
(5)用FeCl3溶液腐蚀废旧线路板上的铜箔:__ Cu+2Fe===Cu+2Fe_____。
(6)将H2O2滴入到酸性FeCl2溶液中:____2Fe2++H2O2+2H+===2Fe3++2H2O____。
(7)将FeCl2溶液滴入到HNO3溶液中,有无色气体放出:____3Fe2++NO-3+4H+===3Fe3++NO↑+2H2O_____2、判断离子共存:Fe2+不共存NO-3(H+)、ClO-、MnO-4(H+);Fe3+不共存S2-、I-、SO2-3;Fe2+、Fe3+不共存HCO-3、CO2-3等水解相互促进的离子。
三.合作探究:混合溶液中Fe3+、Fe2+的除去方法(1)除去Mg 2+中混有的Fe 3+的方法 向混合溶液中加入Mg 、MgO 、MgCO 3、Mg(OH)2中之一,与Fe 3+水解产生的H +反应,促进Fe 3+的水解,将Fe 3+转化为Fe(OH)3沉淀而除去。
(2)除去Cu 2+中混有的Fe 3+的方法 向混合溶液中加入CuO 、CuCO 3、Cu(OH)2、Cu 2(OH)2CO 3中之一,与Fe 3+水解产生的H +反应,促进Fe 3+的水解,将Fe 3+转化为Fe(OH)3沉淀而除去。


“铁三角”转化及应用一、铁三角书写下列反应的方程式,是离子反应的写离子方程式。
(1)Fe 和CuSO 4溶液Fe +Cu 2+===Cu +Fe 2+; (2)Zn 和FeSO 4溶液反应Zn +Fe 2+===Fe +Zn 2+;(3)CO 和Fe 2O 3高温下反应3CO +Fe 2O 3=====高温2Fe +3CO 2;(4)Al 和Fe 2O 3高温下反应2Al +Fe 2O 3=====高温Al 2O 3+2Fe ;(5)FeCl 2溶液和Cl 2反应2Fe 2++Cl 2===2Fe 3++2Cl -;(6)FeCl 2溶液和H 2O 2反应2Fe 2++H 2O 2+2H +===2Fe 3++2H 2O ;(7)FeCl 2溶液和O 2反应4Fe 2++O 2+4H +===4Fe 3++2H 2O ;(8)FeCl3溶液和Cu反应2Fe3++Cu===2Fe2++Cu2+;(9)FeCl3溶液和H2S反应2Fe3++H2S===S↓+2Fe2++2H+;(10)FeCl3溶液和KI反应2Fe3++2I-===2Fe2++I2;(11)FeCl2和稀HNO3反应3Fe2++4H++NO-3===3Fe3++NO↑+2H2O。
1.怎样保存含Fe2+、Fe3+的溶液?提示:(1)含Fe2+的溶液:加入少量铁粉(或铁钉、铁屑),防止Fe2+被氧化;加入少量相应的酸,防止Fe2+水解[Fe(NO3)2例外]。
(2)含Fe3+的溶液:加入少量相应的酸,防止Fe3+水解。
2.怎样用FeCl3溶液制备无水FeCl3?提示:在HCl气流中加热浓缩FeCl3溶液。
3.如何除去酸性MgCl2溶液中的Fe2+?提示:先加H2O2把Fe2+氧化为Fe3+,然后加入MgO[或Mg(OH)2或MgCO3]调节溶液的pH,使Fe3+完全水解生成Fe(OH)3沉淀,然后过滤除去。
4.向FeSO4溶液中加入Na2O2固体,有什么现象?试写出反应的离子方程式。
“铁三角”的转化关系及应用“铁三角”的转化关系深度思考Fe3+1.用离子方程式实现下列转化:Fe2+①Cl2、②NO-3(H+)③Fe、④Cu①2Fe2++Cl2===2Fe3++2Cl-;②3Fe2++4H++NO-3===3Fe3++2H2O+NO↑;③2Fe3++Fe===3Fe2+;④Cu+2Fe3+===Cu2++2Fe2+。
2.如何除去括号中的杂质(1)Fe2+(Fe3+):加过量铁粉,过滤;(2)FeCl3(FeCl2):加氯水或H2O2;(3)FeCl2(CuCl2):加过量铁粉,过滤;(4)Fe(Al):加过量强碱溶液,过滤;(5)Fe2O3(Al2O3、SiO2):加过量强碱溶液过滤。
3.(1)Fe2O3加入到足量的氢碘酸中,发生反应的离子方程式(用两个表示)为______________,________________________________________________________________________。
(2)Fe(OH)3加入到足量的氢碘酸中,发生反应的离子方程式(用一个表示)为__________。
答案(1)Fe2O3+6H+===2Fe3++3H2O2Fe3++2I-===I2+2Fe2+(2)2Fe(OH)3+6H++2I-===2Fe2++I2+6H2O题组一Fe2+与Fe3+的转化及应用1.下列试剂中,不能使Fe2+转化为Fe3+的是()①氯气②NaCl溶液③KMnO4溶液④稀硝酸⑤盐酸⑥NaNO3溶液A.①②③B.①③④C.②④⑤D.②⑤⑥答案D解析要实现Fe2+转化为Fe3+,必须加强氧化性物质,②NaCl、⑤HCl均没有强氧化性,⑥NO-3在酸性条件下才表现强氧化性。
2.在FeCl3、CuCl2混合溶液中,加入一定量的铁屑,反应完全后将固体滤出,下列说法中正确的是() A.若滤出的固体中只有铜,则溶液中一定含有的阳离子是Fe2+,一定不含Cu2+B.若滤出的固体中只有铜,则溶液中一定含有的阳离子是Fe2+,可能含Cu2+和Fe3+C.若滤出的固体中只有铜,则溶液中一定含有的阳离子是Fe3+和Fe2+,一定不含Cu2+D.若滤出的固体中含有铁和铜,则溶液中一定含有的阳离子是Fe2+,一定不含Cu2+和Fe3+答案D解析氧化性Fe3+>Cu2+>Fe2+,加入铁粉后有固体剩余,Fe3+一定不存在;若剩余固体全部都是Cu,溶液中还可能有Cu2+,也可能恰好被完全置换;若剩余固体是Cu和Fe,则溶液中不可能有Cu2+。
考点7 铁三角的应用【考点定位】本考点考查铁三角的应用,明确铁三角之间的转化关系与反应条件,准确理解Fe3+与Fe2+之间的转化与鉴别,特别是能准确发现铁及其化合物推断题的突破口。
【精确解读】“铁三角”的转化关系1.Fe只具有还原性,可以被氧化剂氧化(1)与弱氧化剂反应Fe能被S、Fe3+、Cu2+、H+等较弱氧化剂氧化为Fe2+,如:Fe+S FeS,Fe+2Fe3+=3Fe2+。
(2)与强氧化剂反应Fe能被Cl2、HNO3等强氧化剂氧化为Fe3+,如:2Fe+3Cl22FeCl3。
2.Fe2+既具有氧化性又具有还原性(1)与氧化剂反应当Fe2+遇到强氧化剂(如Cl2、HNO3、KMnO4)时,被氧化为Fe3+,如:2Fe2++Cl2=2Fe3++2Cl-(2)与还原剂反应当Fe2+遇到C、Al、Zn、CO等还原剂时,可以被还原为Fe,如:Fe2++Zn=Zn2++Fe,FeO+CO Fe +CO23.Fe3+具有较强氧化性,可被还原为Fe2+或Fe(1)Fe3+被C、CO、Al等还原为Fe,如Fe2O3+3CO2Fe+3CO2,Fe2O3+2Al2Fe+Al2O3(2)Fe3+被Fe、Cu、I-等还原为Fe2+,如2Fe3++Cu=2Fe2++Cu2+【精细剖析】1.不同价态的铁及铁的化合物在相互转化时,注意所用氧化剂和还原剂的强弱不同。
2.亚铁盐保存时,为了防止被氧化为铁盐,通常在溶液中加少量还原铁粉或铁钉。
3.铁及其化合物推断突破口(1)特征颜色及变化:①Fe2+溶液:浅绿色;Fe3+溶液:棕黄色;Fe(OH)3胶体:红褐色;Fe(OH)3:红褐色;Fe2O3:红棕色;FeO和Fe3O4:黑色;②Fe2+溶液中加NaOH溶液:白色沉淀→灰绿色→红褐色;③Fe3+溶液中加KSCN溶液变红色。
(2)特征价态变化:铁为常见的变价金属。
4.常见的不能与Fe2+、Fe3+大量共存的离子(1)Fe3+与HCO-3、AlO-2、CO2-3、ClO-等离子相互促进水解不能大量共存。
考点2“铁三角”的转化关系及综合应用1.“铁三角”中的转化关系完成下列变化的离子方程式,体会Fe2+与Fe3+转化的条件。
(1)将H2S气体通入FeCl3溶液中产生淡黄色沉淀:H2S+2Fe3+===2Fe2++2H++S↓。
(2)用FeCl3溶液腐蚀废旧线路板上的铜箔:2Fe3++Cu===2Fe2++Cu2+。
(3)将H2O2滴入到酸性FeCl2溶液中:2Fe2++H2O2+2H+===2Fe3++2H2O。
(4)将稀H2SO4滴入到Fe(NO3)2溶液中:3Fe2++NO错误!+4H+===3Fe3++NO↑+2H2O。
(5)将FeSO4滴入到酸性KMnO4溶液中:5Fe2++MnO错误!+8H+===5Fe3++Mn2++4H2O。
2.“铁三角”的重要应用(1)判断离子共存Fe2+与NO错误!(H+)、ClO-、MnO错误!(H+)不能大量共存。
Fe3+与S2-、I-、SO错误!不共存。
Fe2+、Fe3+与HCO错误!、CO错误!、AlO错误!等因发生相互促进的水解反应而不能大量共存。
(2)除杂(3)盐溶液的配制与保存判断正误,正确的画“√”,错误的画“×”.(1)下列物质的转化在给定条件下能实现:Fe2O3错误!FeCl3(aq)错误!无水FeCl3。
(×)(2)氢氧化铁与HI溶液仅发生中和反应。
(×)(3)1 mol FeI2与足量氯气反应时转移的电子数为2N A.(×)1.下列试剂中,不能使Fe2+转化为Fe3+的是()①氯气②NaCl溶液③KMnO4溶液④稀硝酸⑤盐酸⑥NaNO3溶液A.①②③ B.①③④ C.②④⑤ D.②⑤⑥答案D解析②NaCl无氧化性,⑤中的盐酸与Fe2+不反应;⑥中的NO 错误!不在酸性条件下,能与Fe2+共存。
2.下列除杂的操作不正确的是( )A.MgCl2溶液中混有少量FeCl3:加入足量MgCO3充分反应后过滤B FeCl2溶液中混有少量FeCl3:加入过量铁粉充分反应后过滤C.CuCl2溶液中混有少量FeCl3:加入NaOH溶液充分反应后过滤D.CuCl2溶液中混有少量FeCl2:先加入H2O2将Fe2+氧化成Fe3+,再加入CuO充分反应后过滤答案C解析FeCl3溶液中存在水解平衡:FeCl3+3H2O Fe(OH)3+3HCl,加入MgCO3与H+反应,上述平衡右移,使Fe3+转化成Fe(OH)3而除去,A正确;加入过量铁粉,FeCl3与Fe反应生成FeCl2而达到除杂的目的,B正确;先用H2O2将Fe2+氧化成Fe3+,再利用FeCl3的水解,加入的CuO与H+反应将Fe3+转化成Fe(OH)3而除去,D 正确;C项中加入NaOH溶液,Cu2+、Fe3+均转化成氢氧化物沉淀,不符合除杂要求。
专题(4)铁三角的转化核心知识点一:一、“铁三角”1. Fe、Fe2+和Fe3+之间相互转化从Fe、Fe2+和Fe3+的结构可知:Fe只有还原性,Fe3+通常只有氧化性,Fe2+既具有氧化性又具有还原性。
上述微粒通过跟一定的氧化剂或还原剂发生氧化还原反应,才能实现不同价态的铁相互转化,如下图(常称为铁三角):(1)Fe→Fe2+或Fe3+①与弱氧化剂反应生成Fe2+与S、Fe3+、Cu2+、H+等弱氧化剂反应生成+2价的铁,例如:Fe+2Fe3+=3 Fe2+Fe+ Cu2+= Cu+ Fe2+Fe+2 H+= Fe2++ H2↑②与强氧化剂反应生成Fe3+与Cl2、Br2、HNO3(浓、稀)等强氧化剂反应生成+3价的铁,例如:2Fe+3Cl22FeCl3Fe+4HNO3(稀)=Fe(NO3)3+NO↑+2H2O(2)Fe2+→Fe3+或Fe①与氧化剂反应生成Fe3+与Cl2、HNO3(浓、稀)等强氧化剂反应生成+3价的铁,例如:2Fe2++Cl2=2Fe3++2Cl-②与还原剂反应生成Fe与C、Al、Zn、CO、S2-等还原剂反应生成铁单质,例如:Fe2++ Zn= Zn2+ + Fe(3)Fe3+→Fe或Fe2+①与还原剂反应生成Fe与C、Al、CO等还原剂反应生成铁单质,例如:Fe2O3+3CO2Fe+3CO2②与还原剂反应生成Fe2+与Fe、Cu、I-、S2-等还原剂反应生成Fe2+,例如:2Fe3++ Cu= 2Fe2+ + Cu2+注意:Fe3+、Fe2+、Fe的相互转化,可以应用于试剂的保存、配制和除杂,如配制硫酸亚铁溶液时加入少量的铁粉以防止Fe2+被氧化。
2. “铁三角”的应用:(1)判断离子共存:Fe2+与(H+)、ClO−、(H+),Fe3+与S2−、I−、HS−、在溶液中因发生氧化还原反应而不能大量共存。
(2)除杂方法(括号内为杂质):Fe2+(Fe3+):加过量铁粉,过滤;FeCl3(FeCl2):加氯水或H2O2;FeCl2(CuCl2):加过量铁粉,过滤;Fe(Al)、Fe2O3(Al2O3、SiO2):加过量强碱溶液,过滤;(3)盐溶液的保存:亚铁盐溶液——加入少量铁屑以防止Fe2+被氧化。
铁盐溶液——加入少量相应的酸溶液以防止Fe3+水解。
核心知识点二:二、Fe2+和Fe3+的检验方法1. 直接观察颜色Fe2+的溶液→浅绿色;Fe3+的溶液→棕黄色2. 用KSCN溶液和氯水(1)流程Fe2+:加入KSCN溶液,无明显现象,加入氯水,溶液变为红色。
Fe3+:加入KSCN溶液,溶液变为红色。
(2)有关离子方程式Fe3++3SCN- =Fe(SCN)3(红色)2Fe2++Cl2=2Fe3++2Cl-3. 用NaOH溶液(1)流程Fe2+:加入氢氧化钠溶液,先生成白色沉淀,变为灰绿色,变为红褐色沉淀。
Fe3+:加入氢氧化钠溶液,生成红褐色沉淀。
(2)有关离子方程式Fe3++3OH-= Fe(OH)3↓(红褐色沉淀)Fe2++2OH-= Fe(OH)2↓(白色沉淀)Fe(OH)2+O2+2H2O=4 Fe(OH)34. 利用Fe3+的氧化性(1)Fe2+的溶液+ Cu片→无明显现象;Fe3+的溶液+ Cu片→Cu片溶解,溶液变成蓝绿色;有关离子方程式:2Fe3++ Cu= 2Fe2+ + Cu2+。
(2)Fe2+的溶液+淀粉碘化钾试纸→试纸不变色;Fe3+的溶液+淀粉碘化钾试纸→试纸变蓝;有关离子方程式:2Fe3++ I-= 2Fe2+ + I25. 利用Fe2+的还原性(1)Fe2+的溶液+ 酸性KMnO4溶液→溶液紫红色褪去Fe3+的溶液+酸性KMnO4溶液→溶液不变色(2)Fe2+的溶液+ 氯水→溶液为棕黄色Fe3+的溶液+氯水→无明显现象离子方程式:2Fe2++Cl2=2Fe3++2Cl-注意:以上方法中以KSCN溶液鉴别最常用6. 利用Fe2+与K3[Fe(CN)6]反应(1)Fe2+与K3[Fe(CN)6]反应生成蓝色沉淀。
(2)Fe3+与K3[Fe(CN)6]不反应。
核心知识点一:1. 下列能大量共存于溶液中的一组离子是()A. Fe3+、K+、SCN-、SO42-B. Fe3+、Fe2+、H+、S2-C. Mg2+、Fe2+、OH-、NO3-D. Na+、Fe3+、NO3-、Cl-【答案】D【解析】Fe3+与SCN-发生反应,不能大量共存的,A项错误;Fe3+、Fe2+、与S2-均发生反应,不能大量共存,B项错误;Mg2+、Fe2+和OH-反应生成沉淀,不能大量共存,C项错误。
【考点】离子共存2. 要除去FeCl2溶液中的少量FeCl3可行的办法()A. 滴入KSCN溶液B. 通入Cl2C. 加入铜粉D. 加入铁粉【答案】D【解析】滴入KSCN溶液,不能除去Fe3+,且引入了K+、SCN-等,A项错误;通入氯气,发生反应2Fe2++Cl2=2Fe3++2Cl-,不能除去Fe3+,B项错误;加入铜粉,发生反应Cu+2Fe3+=2Fe2++Cu2+,可以除去Fe3+,但引入了Cu2+,C项错误;加入铁粉,发生反应Fe+2Fe3+=3Fe2+,可以除去Fe3+,且没有引入新杂质,D项正确。
已知A为淡黄色固体,T、R为两种常见的用途很广的金属单质,D是具有磁性的黑色晶体,C是无色无味的气体,H是白色沉淀,且在潮湿空气中迅速变为灰绿色,最终变为红褐色固体.(1)写出下列物质的化学式:A:D:R:.(2)按要求写下列反应方程式:H在潮湿空气中变成M的化学方程式:;D与盐酸反应的离子方程式:。
(3)检验气体C的方法:。
【答案】(1)Na2O2;Fe3O4;Al;4Fe(OH)2+O2+2H2O=4 Fe(OH)3;Fe3O4+8H+=Fe2++2Fe3++4H2O;用带火星的木条伸入试管口,若带火星的木条复燃,说明有氧气生成。
【解析】A为淡黄色固体,且A能和水反应生成无色无味气体C,则A是Na2O2,C 是O2、B是NaOH;D是具有磁性的黑色晶体,则D是Fe3O4,金属T在氧气中燃烧生成四氧化三铁,则T是Fe,四氧化三铁与足量的盐酸、足量的Fe反应得到E,E与B(NaOH)反应得到白色沉淀H,则E为FeCl2,H是Fe(OH)2,H在潮湿的空气中得到M为Fe(OH)3,M与HCl反应生成W是FeCl3,金属R和氧气反应生成氧化物Q,R与Q都能和NaOH 溶液反应生成N,则R是Al、Q是Al2O3、N是NaAlO2。
(1)通过以上分析知,A是Na2O2,D是Fe3O4,R是Al(2)H在潮湿空气中变成M的化学方程式:4Fe(OH)2+O2+2H2O=4 Fe(OH)3,D 与盐酸反应的离子方程式:Fe3O4+8H+=Fe2++2Fe3++4H2O,(3)检验气体C(氧气)的方法:用带火星的木条伸入试管口,若带火星的木条复燃,说明有氧气生成。
【考点】物质的转化核心知识点二:证明某溶液中含有Fe2+而不含有Fe3+的实验方法()①先滴加氯水,再滴加KSCN溶液后显红色;②先滴加KSCN溶液,不显红色,再滴加氯水后显红色;③滴加NaOH溶液,先产生白色絮状沉淀,迅速变成灰绿色,最后呈红褐色;④滴加KSCN溶液,不显红色A. ①②B. ②③C. ③④D. ①④【答案】B【解析】先滴加氯水,再滴加KSCN溶液后显红色,只能证明加氯水后的溶液中含有Fe3+,无法确定加氯水前的溶液中是否含有Fe2+、Fe3+,①不正确;先滴加KSCN溶液,不显红色,证明不含有Fe3+,再滴加氯水后显红色,证明滴加氯水前的溶液中含有Fe2+,②正确;滴加NaOH溶液,产生白色絮状沉淀,迅速变成灰绿色,最后呈红褐色,这是Fe2+的特征反应现象,能证明原溶液中含有Fe2+而不含有Fe3+,③正确;滴加KSCN溶液,不显红色,只能证明原溶液中不含有Fe3+,不能证明含有Fe2+,④不正确为了检验某未知溶液中是否含有Fe2+,一位同学设计了以下实验方案:向一支装有该未知溶液的试管中先通入Cl2,再滴加KSCN溶液,溶液呈红色,证明该未知溶液中含有Fe2+。
回答以下问题:(1)你认为此方案是否合理—————————(填“合理”或“不合理”),若不合理,要检验Fe2+应如何操作——————————————————————————————(若填“合理”,则此空可不答)。
(2)现向一支装有FeCl2溶液的试管中滴加NaOH溶液,可观察到的现象是,有关反应的化学方程式为—————————。
————————————————————————(3)实验室在保存FeCl2溶液时为了防止FeCl2变质,常向其中加入铁粉,其原因是(用离子方程式表示)。
———————【答案】(1)不合理先滴加KSCN溶液,无明显现象,再通入Cl2,溶液变红色,则原未知溶液中含有Fe2+(2)出现白色絮状沉淀,迅速变成灰绿色,最终变成红褐色FeCl2+2NaOH=Fe(OH)2↓+2NaCl 4Fe(OH)2+O2+2H2O=4Fe(OH)3(3)2Fe3+ +Fe=3Fe2+【解析】(1)若先向溶液中通入Cl2,再滴加KSCN溶液,溶液呈红色,说明通入Cl2后的溶液中含有Fe3+,不能证明原未知溶液中含有Fe2+,若为含Fe3+不含Fe2+的溶液,现象与上述实验完全相同,故应先滴加KSCN,若无明显的现象,再通入Cl2,溶液变红色,证明原未知溶液中含有Fe2+。
(2)向FeCl2溶液中滴加NaOH溶液,生成Fe(OH)2白色絮状沉淀,因Fe(OH)2易被溶解在溶液中的O2氧化为Fe(OH)3,故生成物会迅速变为灰绿色,最终变为红褐色的Fe(OH)3。
【考点】铁盐、亚铁盐的转化(答题时间:25分钟)一、选择题1. 下列除杂的操作不正确的是A. MgCl2溶液中混有少量FeCl3:加入足量镁充分反应后过滤B. FeCl2溶液中混有少量FeCl3:加入过量铁粉充分反应后过滤C. CuCl2溶液中混有少量FeCl3:加入足量锌粉充分反应后过滤D. CaCl2溶液中混有少量FeCl2:先加入H2O2将Fe2+氧化成Fe3+,再加入CaCO3充分反应后过滤2. 硫酸亚铁易被氧化而变质。
为检验某补血剂中硫酸亚铁是否变质,可向该补血剂配成的溶液中加入A. 硝酸和硝酸银溶液B. 盐酸酸化的BaCl2溶液C. KSCN溶液D. 硝酸酸化的Ba(NO3)23. 铁屑溶于过量稀硫酸,过滤后向滤液中加入过量氨水,有白色沉淀生成,过滤,在空气中加热沉淀至质量不再发生变化为止,得到红棕色残渣,上述沉淀和残渣分别是A. Fe(OH)3Fe2O3B. Fe(OH)2Fe2O3C. Fe(OH)2Fe(OH)3D. Fe(OH)2Fe3O44. 将1.12 g铁粉加入25 mL 2 mol·L-1的氯化铁溶液中,充分反应后,其结果是A. 铁粉有剩余,溶液呈浅绿色,Cl-基本保持不变B. Fe2+和Fe3+物质的量之比为5∶1C. 往溶液中滴入无色KSCN溶液,显红色D. 氧化产物和还原产物的物质的量之比为2∶55. A、B、C三种物质中均含有同一种元素M,它们之间有如图所示的转化关系。