得电子能力
Si < P < S < Cl
原子序数 元素符号 单质和水 (或酸)反 应情况 非金属单质 与氢气反应
11 Na
冷水 剧烈
12 Mg
热水 较快 盐酸 剧烈
13 Al
盐酸 较快
14 Si
15 P
16 S
17 Cl
18 Ar
高 温
磷蒸气 与 H2 能 反应
须 加 热
光照或 点燃爆 炸化合
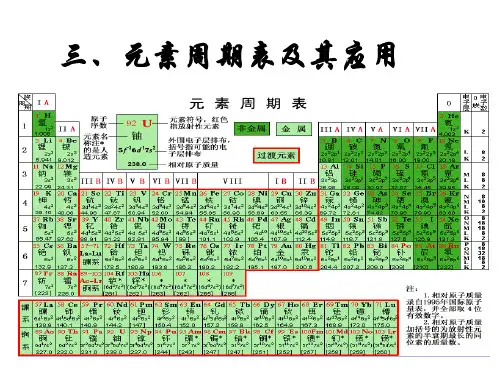
最高价氧化 NaOH Mg(OH)2 Al(OH)3 H4SiO4 H3PO4 H2SO4 HClO4 物对应水化 强碱 中强碱 两性氢 弱酸 中强 强酸 最强 物的酸碱性 氧化物 酸 酸 得失电子能 力递变
酸 性
得 电 子 能 力
F
2,7
冷暗处 爆炸
HF
强
无
无
强
强
Cl 2,8,7
Br 2,8,18,7 I
点燃或 光照
HCl
HBr HI
弱
Cl2O7 HClO4
Br2O7 HBrO4 I2O7 HIO4
弱 弱
高温
2,8,18,18, 高温,缓 慢, 7
可逆
元素最高价氧化物对应水化物的酸碱性
酸性逐渐增强
H Li K Rb Cs Be Ca Sr Ba B Al Ga In C Si Ge Sn N P As Sb O S Se Te Po F Cl Br I At Na Mg
失电子能力逐渐减弱,得电子能力逐渐增强
稀 有 气 体 元 素
观察 思考:
1。根据钾元素在元素周期表中的位置预测金 属钾的性质,并与金属钠的性质进行比较。 2。观察金属钠和金属钾与水反应的情况,为 你的预测收集证据。