难溶强电解质的沉淀溶解平衡
- 格式:pdf
- 大小:141.76 KB
- 文档页数:3

《难溶电解质的沉淀溶解平衡》讲义一、难溶电解质的沉淀溶解平衡的概念在一定温度下,当难溶电解质溶于水形成饱和溶液时,溶解速率和沉淀速率相等的状态,称为难溶电解质的沉淀溶解平衡。
例如,我们常见的 AgCl 固体在水中存在这样的平衡:AgCl(s) ⇌Ag+(aq) + Cl(aq) 。
此时,Ag+和 Cl不断结合生成 AgCl 沉淀,同时AgCl 也在不断溶解成 Ag+和 Cl,当这两个过程的速率相等时,就达到了沉淀溶解平衡。
需要注意的是,沉淀溶解平衡是一种动态平衡,溶解和沉淀仍在不断进行,只是速率相等。
二、影响沉淀溶解平衡的因素1、内因物质本身的性质是决定沉淀溶解平衡的重要因素。
不同的难溶电解质,它们在相同条件下的溶解度和溶解程度是不同的。
2、外因(1)温度一般来说,大多数难溶电解质的溶解过程是吸热的,升高温度,平衡向溶解方向移动,溶解度增大;反之,降低温度,平衡向沉淀方向移动,溶解度减小。
(2)浓度对于反应离子的浓度,通过加水稀释,平衡向溶解方向移动;若增大离子浓度,平衡向沉淀方向移动。
(3)同离子效应在难溶电解质的饱和溶液中,加入含有相同离子的强电解质,会使平衡向沉淀方向移动,溶解度减小。
例如,在 AgCl 的饱和溶液中加入 NaCl 固体,由于溶液中 Cl浓度增大,平衡向生成 AgCl 沉淀的方向移动。
(4)盐效应在难溶电解质的饱和溶液中,加入不含相同离子的强电解质,会使溶解度增大。
这是因为加入的强电解质增大了溶液中的离子强度,使得离子间的相互作用增强,从而促进了难溶电解质的溶解。
三、沉淀溶解平衡的应用1、沉淀的生成若要使溶液中的离子生成沉淀,可以通过调节溶液的 pH 值、加入沉淀剂等方法,使离子浓度的乘积大于溶度积(Ksp),从而产生沉淀。
例如,向含有 Cu2+的溶液中加入 Na2S 溶液,由于 CuS 的溶度积很小,当 Cu2+和 S2-的浓度乘积超过 CuS 的溶度积时,就会生成 CuS 沉淀。



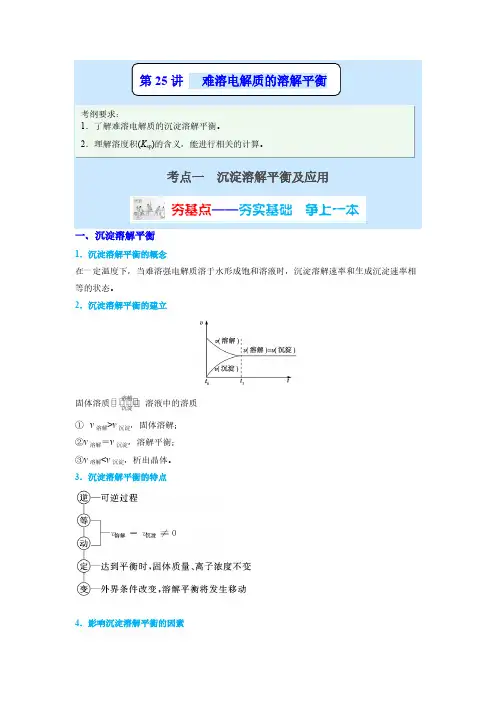
4.影响沉淀溶解平衡的因素(1)内因难溶电解质本身的性质,这是决定因素。
(2)外因①浓度:加水稀释,平衡向沉淀溶解的方向移动;②温度:绝大多数难溶盐的溶解是吸热过程,升高温度,平衡向沉淀溶解的方向移动;③同离子效应:向平衡体系中加入难溶物溶解产生的离子,平衡向生成沉淀的方向移动;④其他:向平衡体系中加入可与体系中某些离子反应生成更难溶或更难电离或气体的离子时,平衡向沉淀溶解的方向移动。
二、沉淀溶解平衡的应用1.沉淀的生成当溶液中离子积(Q c )大于溶度积(K sp )时有沉淀生成。
①调节pH 法:如除去NH 4Cl 溶液中的FeCl 3杂质,可加入氨水调节pH 至4左右,离子方程式为Fe 3++3NH 3·H 2O===Fe(OH)3↓+3NH 。
+4②沉淀剂法:如用H 2S 沉淀Cu 2+,离子方程式为Cu 2++H 2S===CuS↓+2H +。
2.沉淀的溶解当溶液中离子积(Q c )小于溶度积(K sp )时,沉淀可以溶解。
①酸溶解:用离子方程式表示CaCO 3溶于盐酸:CaCO 3+2H +===Ca 2++CO 2↑+H 2O 。
②碱溶解法如Al 2O 3溶于NaOH 溶液,离子方程式为:Al 2O 3+2OH -===2AlO +H 2O -2③盐溶解:用离子方程式表示Mg(OH)2溶于NH 4Cl 溶液:Mg(OH)2+2NH===Mg 2++2NH 3·H 2O 。
+4④配位溶解:用离子方程式表示AgCl 溶于氨水:AgCl +2NH 3·H 2O===[Ag(NH 3)2]++Cl -+2H 2O 。
⑤氧化还原溶解:如不溶于盐酸的硫化物Ag 2S 溶于稀HNO 3。
3.沉淀的转化通常,一种沉淀可以转化为更难溶的沉淀,两种难溶物的溶解能力差别越大,这种转化的趋势就越大。
①实质:沉淀溶解平衡的移动。
②实例:AgNO 3溶液AgCl AgBr ,则K sp (AgCl)>K sp (AgBr)。






难溶强电解质的沉淀溶解平衡
目的与要求:
1、掌握难溶强电解质的沉淀溶解平衡及溶度积。
2、掌握溶度积与溶解度的关系。
3、熟悉溶度积规则,学会应用溶度积规则来判断沉淀的生成和溶解。
重点:难溶强电解质的沉淀溶解平衡及溶度积规则 难点:1、溶度积与离子积的区别与联系
2、应用溶度积规则来判断沉淀的生成和溶解
基本内容:
一、溶度积和溶度积规则
Question :在含有AgCl 固体的溶液中,是否存在Ag +和Cl -
离子??
Solution :AgCl (s )
Ag +(aq )+Cl -(aq )
[AgCl]
]
Cl ][Ag [-+=
K K sp = [Ag +][Cl -]
1、溶度积常数(solubility product constant ,K sp ) 任意A a B b 型难溶电解质: A a B b (s )
a A n+(aq )+bB m-(aq )
K sp = [A n+]a [ B m-]b
Exercises :写出Fe(OH)3、Ag 2CrO 4的K sp 表达式
Questions :n 298K 时,AgCl 的溶解度s = 1.33×10-5mol ·L -1,其溶度积K sp =?
o 298K 时,AgBr 的溶解度s = 7.33×10-7mol ·L -1,其溶度积K sp =? p 298K 时,Ag 2CrO 4的溶解度s = 6.54×10-5mol ·L -1,其溶度积K sp =?
结论:) 同类型的难溶电解质,溶度积K sp 愈大,溶解度s 也愈大
) 不同类型的难溶电解质,不能直接根据溶度积K sp 来比较其溶解度s
的大小
2、溶度积K sp 与溶解度s 的相互换算关系:
推导: AB 、AB 2(or A 2B )、AB 3型难溶电解质的溶度积K sp 与溶解度s 的关系
结论:
3、离子积(ion product,I p)I p = c(A n+)a ·c ( B m-)b Example:AgCl溶液的离子积表达式:I p = c(Ag+)·c(Cl-)
Ag2CrO4溶液的离子积表达式:I p = c(Ag+)2·c(CrO42-) Question:离子积I p与溶度积K sp有何区别??
Solution:
K sp I p
表达式
K sp = [A n+]a [ B m-]b
平衡态时,离子平衡浓
度幂次方的乘积
I p = c(A n+)a·c ( B m-)b
任意状态下,离子浓度
幂次方的乘积
T一定时,同一难
溶电解质
常数数值不恒定
结论:K sp是I p在平衡状态时的特例
Question:引入离子积I p的意义何在??
4、溶度积规则
)I p=K sp溶液为饱和溶液,处于沉淀-溶解动态平衡,既无沉淀析出,又无沉淀溶解;
)I p<K sp 溶液处于不饱和状态,溶液中无沉淀析出。
若继续加入难溶电解质,难溶电解质将不断溶解直至溶液饱和;
)I p>K sp 溶液处于过饱和状态,沉淀将从溶液中析出直至溶液饱和。
Question:如何判断沉淀的生成和溶解??
Solution:溶度积规则
二、沉淀平衡的移动
1、沉淀的生成
条件:I p>K sp
)加入沉淀剂
Example:P46 例3-17
)同离子效应
)盐效应
)分级沉淀(fractional precipitate):先达到I p>K sp状态的物质先沉淀2、沉淀的溶解
条件:I p<K sp
)生成弱电解质
Example:Mg(OH)2Mg2+ + 2OH-
+
2H+(2NH4+)
2H2O(2NH3·H2O)
)生成微溶的气体逸出
Example:CaCO3Ca2+ + CO32-
+
H+
HCO3- +H+H2CO3CO2↑+ H2O )发生氧化还原反应
Example:PbS Pb2-2-
S↓+ NO↑
)生成配离子
Example:AgCl Cl- + Ag+
+
2NH3
[Ag(NH3)2]+。