07_第七章 热力学一般关系式
- 格式:ppt
- 大小:454.50 KB
- 文档页数:27

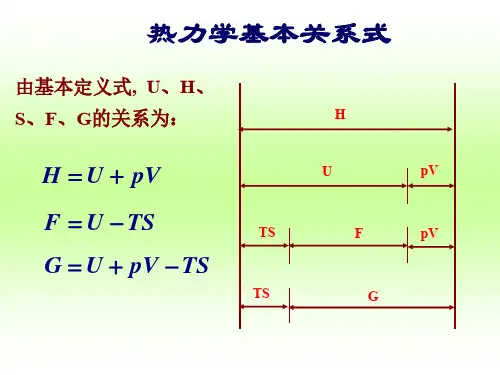
第二部分工质的热力性质六热力学函数的一般关系式由热力学基本定律引出的一些基本热力学状态函数(如内能U、熵S)及其为某一研究方便而设的组合函数(如焓H、自由能F、自由焓G等)许多都是不可测量,必须将它们与可测量(如压力p、体积V、温度T等)联系起来,否则我们将得不到实际的结果,解决不了诸如上一章讲的最大功计算等一些具体的问题。
这就需要发展热力学的数学理论以将热力学基本定律应用到各种具体问题中去。
热力学函数一般关系式 全微分性质+基本热力学关系式6.1 状态函数的数学特性对于状态参数,当我们强调它们与独立变量的函数关系时,常称它们为状态函数。
从数学上说,状态函数必定具有全微分性质。
这一数学特性十分重要,利用它可导出一系列很有实用价值的热力学关系式。
下面我们扼要介绍全微分的一些基本定理。
设函数),(y x f z =具有全微分性质dy y z dx x z dz xy ⎪⎪⎭⎫ ⎝⎛∂∂+⎪⎭⎫ ⎝⎛∂∂= (6-1) 则必然有(1) 互易关系令式(6-1)中),(y x M x z y=⎪⎪⎭⎫ ⎝⎛∂∂, ),(y x N y z x =⎪⎪⎭⎫ ⎝⎛∂∂ 则 y x x N y M ⎪⎪⎭⎫ ⎝⎛∂∂=⎪⎪⎭⎫ ⎝⎛∂∂ (6-2)互易关系与⎰=0dz 等价。
它不仅是全微分的必要条件,而且是充分条件。
因此,可反过来检验某一物理量是否具有全微分。
(2) 循环关系当保持z 不变,即0=dz 时,由式(6-1),得0=⎪⎪⎭⎫ ⎝⎛∂∂+⎪⎭⎫ ⎝⎛∂∂z xz y dy y z dx x z则 xy z y z x z x y ⎪⎪⎭⎫ ⎝⎛∂∂⎪⎪⎭⎫ ⎝⎛∂∂-=⎪⎪⎭⎫ ⎝⎛∂∂ 故有 1-=⎪⎪⎭⎫ ⎝⎛∂∂⎪⎪⎭⎫ ⎝⎛∂∂⎪⎪⎭⎫ ⎝⎛∂∂y z x z x x y y z (6-3)此式的功能是:若能直接求得两个偏导数,便可确定第三个偏导数。
结果也很容易记忆,只需将三个变量依上、下、外次序,即))()((xzy yxz zyx 循环就行了。

第二部分工质的热力性质热力学函数的一般关系式由热力学基本定律引出的一些基本热力学状态函数(如能U、熵S)及其为某一研究方便而设的组合函数(如焓H、自由能F、自由焓G等)许多都是不可测量,必须将它们与可测量(如压力p、体积V、温度T等)联系起来,否则我们将得不到实际的结果,解决不了诸如上一章讲的最大功计算等一些具体的问题。
这就需要发展热力学的数学理论以将热力学基本定律应用到各种具体问题中去。
热力学函数一般关系式全微分性质+基本热力学关系式6.1状态函数的数学特性对于状态参数,当我们强调它们与独立变量的函数关系时,常称它们为状态函数。
从数学上说,状态函数必定具有全微分性质。
这一数学特性十分重要,利用它可导出一系列很有实用价值的热力学关系式。
下面我们扼要介绍全微分的一些基本定理设函数z f (x,y)具有全微分性质则必然有(1)互易关系令式(6-1 )中N(x,y)(6-2)互易关系与…dz 0等价。
它不仅是全微分的必要条件,而且是充分条件。
因此,可反过来检验某一物理量是否具有全微分。
(2)循环关系当保持z不变,即dz0时,由式(6-1),得zdx z zdy z 0dz dx dyx(6-1 ) M (x, y)故有 此式的功能是:若能直接求得两个偏导数,便可确定第三个 偏导数。
结果也很容易记忆,只需将三个变量依上、下、外 次序,即(zyx)(yxz)(xzy)循环就行了。
(3)变换关系两边同除以dx ,得立变量时,函数z(x,)对x 的偏导数。
上面的关系可用于它们 之间的变换。
这一关系式对于热力学公式的推导十分重要。
(4)链式关系按照函数求导法则,可有下述关系:式中: x y 是函数z (x,y)对x 的偏导数;:是以O')为独xxyy x x(6-3 ) 将式(6-1 )用于某第四个变量 不变的情况,可有dzz —dx z —dyz_z z y(6-4)(6-5 )(6-5a )这是在同一参数(如y)保持不变时,一些参数(z,x,,)循环求导所得偏导数间的关系。




第一章热力学第一定律一、基本概念系统与环境,状态与状态函数,广度性质与强度性质,过程与途径,热与功,内能与焓。
二、基本定律热力学第一定律:ΔU=Q+W。
焦耳实验:ΔU=f(T) ; ΔH=f(T)三、基本关系式1、体积功的计算δW= -p e d V恒外压过程:W= -p eΔV可逆过程:W=nRT2、热效应、焓等容热:Q V=ΔU(封闭系统不作其他功)等压热:Q p=ΔH(封闭系统不作其他功)焓的定义:H=U+pV; d H=d U+d (pV)焓与温度的关系:ΔH=3、等压热容与等容热容热容定义:;定压热容与定容热容的关系:热容与温度的关系:C p=a+bT+c’T2四、第一定律的应用1、理想气体状态变化等温过程:ΔU=0 ; ΔH=0 ; W=-Q=p e d V等容过程:W=0 ; Q=ΔU= ; ΔH=等压过程:W=-p eΔV ; Q=ΔH= ; ΔU=可逆绝热过程:Q=0 ; 利用p1V1γ=p2V2γ求出T2,W=ΔU=;ΔH=不可逆绝热过程:Q=0 ;利用C V(T2-T1)=-p e(V2-V1)求出T2,W=ΔU=;ΔH=2、相变化可逆相变化:ΔH=Q=nΔ_H;W=-p(V2-V1)=-pV g=-nRT;ΔU=Q+W3、热化学物质的标准态;热化学方程式;盖斯定律;标准摩尔生成焓。
摩尔反应热的求算:反应热与温度的关系—基尔霍夫定律:。
第二章热力学第二定律一、基本概念自发过程与非自发过程二、热力学第二定律1、热力学第二定律的经典表述克劳修斯,开尔文,奥斯瓦尔德。
实质:热功转换的不可逆性.2、热力学第二定律的数学表达式(克劳修斯不等式)“="可逆;“>"不可逆三、熵1、熵的导出:卡若循环与卡诺定理2、熵的定义:3、熵的物理意义:系统混乱度的量度.4、绝对熵:热力学第三定律5、熵变的计算(1)理想气体等温过程:(2)理想气体等压过程:(3)理想气体等容过程:(4)理想气体pTV都改变的过程:(5)可逆相变化过程:(6)化学反应过程:四、赫姆霍兹函数和吉布斯函数1、定义:A=U-TS;G=H—TS等温变化:ΔA=ΔU—TΔS;ΔG=ΔH—TΔS2、应用:不做其他功时,ΔA T,V≤0 ;自发、平衡ΔG T,V≤0 ;自发、平衡3、热力学基本关系式d A=—S d T—V d p;d G=—S d T+p d V4、ΔA和ΔG的求算(1)理想气体等温过程用公式:ΔA=ΔU-TΔS;ΔG=ΔH-TΔS用基本关系式:d A=-S d T-V d p;d G=-S d T+p d V(2)可逆相变过程ΔA=ΔU—TΔS=W=-nRT;ΔG=0 (3)化学反应过程的ΔG标准熵法:ΔG=ΔH—TΔS标准生成吉布斯函数法:(4)ΔG与温度的关系ΔG=ΔH-TΔS ,设ΔH、ΔS不遂温度变化。