结肠癌的病理
- 格式:docx
- 大小:10.85 KB
- 文档页数:1


病理(一)大体形态分型1.肿块型结肠癌2.浸润型结肠癌3.溃疡型结肠癌1.肿块型(菜花型、软癌)肿瘤向肠腔内生长、瘤体较大,呈半球状或球状隆起,易溃烂出血并继发感染、坏死。
该型多数分化较高,侵润性小,生长较慢,好发于右半结肠。
2.侵润型(缩窄型、硬癌)肿瘤环绕肠壁侵润,有显著的纤维组织反应,沿粘膜下生长,质地较硬,易引起肠腔狭窄和梗阻。
该型细胞分化程度较低,恶性程度高,出现转移早。
好发右半结肠以远的大肠。
3.溃疡型肿瘤向肠壁深层生长并向肠壁外侵润,早期即可出现溃疡,边缘隆起,底部深陷,易发生出血、感染,并易穿透肠壁。
细胞分化程度低,转移早。
是结肠癌中最常见的类型,好发于左半结肠、直肠。
(二)组织学分型1.腺癌大多数结肠癌是腺癌,约占四分之三,腺癌细胞可辨认,排列成腺管状或腺泡状,按其分化程度可分为三级,Ⅲ级分化最差,细胞排列为片状或索条状。
2.粘液癌癌细胞分泌粘液,在细胞内可将细胞核挤到一边(状似戒指,有称作印戒细胞癌),在细胞外可见间质内有粘液以及纤维组织反应,癌细胞在片状粘液中似小岛状。
分化低,予后较腺癌差。
3.未分化癌癌细胞小,形状与排列不规则,易侵入小血管及淋巴管,侵润明显。
分化很低,愈后最差。
(三)临床分期Ⅰ期(Dukes A期):癌局限于肠壁内A0期:癌局限于粘膜A1期:癌局限于粘膜下层A2期:癌侵及肠壁肌层未穿透浆膜Ⅱ期(Dukes B期):癌侵润至肠壁外Ⅲ期(Dukes C期):伴有淋巴腺转移C1期:近处淋巴转移(肠旁)C2期:远处淋巴转移(系膜)Ⅳ期(Dukes D期):已有远脏转移(四)扩散转移1.大肠癌扩散的特点一般沿肠管横轴呈环状侵润,并向肠壁深层发展,沿纵轴上下扩散较慢,且累及肠段一般不超过10公分。
癌侵及浆膜后,常与周围组织、邻近脏器及腹膜粘连。
2.结肠癌的淋巴转移淋巴转移一般依下列顺序由近而远扩散,但也有不依顺序的跨越转移。
(1)结肠淋巴结位肠壁脂肪垂内。
(2)结肠旁淋巴结位邻近结肠壁的系膜内。

结肠癌的病理学特点和手术预后分析结肠癌是一种常见的恶性肿瘤,其病理学特点和手术预后分析对于临床诊断和治疗都具有重要意义。
1. 病理学特点1.1 组织学类型结肠癌可以分为以下几种组织学类型:•腺癌:最常见的结肠癌类型,由肠腺上皮恶性变异而来。
•黏液癌:腺癌中黏液分泌增多的一种亚型。
•腺鳞癌:同时具有腺癌和鳞癌的特点,较为罕见。
•腺肌癌:同时具有腺癌和平滑肌肉瘤的特点,较为罕见。
1.2 肿瘤分级和分期结肠癌根据肿瘤的组织学特点进行分级,包括以下几个级别:•G1级:肿瘤分化良好,与正常肠腺上皮相似。
•G2级:肿瘤分化中等,介于G1级和G3级之间。
•G3级:肿瘤分化差,与正常肠腺上皮相差较大。
结肠癌的分期是根据肿瘤的深度侵袭和淋巴结转移情况进行分类,常采用国际TNM分期系统。
TNM分期包括:•T分期:根据肿瘤侵袭的深度分为T1、T2、T3、T4四个级别。
•N分期:根据淋巴结转移情况分为N0、N1、N2三个级别。
•M分期:根据远处转移情况分为M0和M1两个级别。
1.3 分子病理学特点近年来,对于结肠癌的分子病理学特点的研究也逐渐增多,主要包括以下几个方面:•基因突变:结肠癌中常见的基因突变包括KRAS、BRAF、PIK3CA等。
•DNA甲基化:DNA甲基化是结肠癌进程中的常见表观遗传变化。
•微卫星不稳定性(MSI):约15%的结肠癌患者具有微卫星不稳定性,这与DNA修复基因的突变有关。
2. 手术预后分析手术是结肠癌治疗的主要方法之一,手术预后分析对于判断患者的生存及疾病复发的风险具有重要意义。
2.1 术前因素•年龄:年轻患者通常预后更好。
•性别:男性患者相比女性患者预后较差。
•肿瘤位置:左结肠癌相比右结肠癌预后较好。
•TNM分期:早期癌(I、II期)预后较好,晚期癌(III、IV期)预后较差。
2.2 术中因素•手术方式:开放手术和腹腔镜手术的预后相当。
•淋巴结清扫数量:淋巴结清扫数目越多,预后越好。
•手术切缘:切缘阳性的预后相对较差。

结直肠癌浆膜受累(pT4a)病理诊断的研究进展摘要:结直肠癌临床中发生率较高,疾病早发现早治疗与患者疾病预后有重要相关性。
病理诊断作为临床疾病诊断的金标准,对患者疾病治疗方案的制定有积极作用。
浆膜受累(pT4a)是结直肠癌病理诊断重要依据,基于此,文章重点对浆膜受累(pT4a)病理诊断在结直肠癌诊断中相关内容进行综述,具体如下。
关键词:结直肠癌;浆膜受累;pT4a;病理诊断;进展研究作为消化系统常见的恶性肿瘤,结直肠癌临床中发病率较高,如果不能及时诊段与治疗,极易导致患者病情进展出现死亡。
疾病分期诊断中通常依据患者肿瘤浸润以及肿瘤周围脏器影响,将其分为pTis、pT1、pT2、pT3、pT4a和pT4b,其中pT3和 pT4a作为疾病诊断重要依据,能够反映患者的肿瘤是否存在转移,对于疾病诊断与疾病预后有重要关联。
1浆膜受累(pT4a)病理诊断价值浆膜组织作为体腔壁和转折包裹内脏器官表面的薄膜,属于结直肠重要组成,在临床研究中发现结直肠癌患者是否出现浆膜受累是影响其预后的关键,与淋巴结节转移以及肿瘤浸润指标相比更加具有优越性。
而且针对结直肠癌疾病的预后,通常不同分期情况结果不同,Ⅱ期 pT3结直肠癌患者的生存率较Ⅲ期 pT4结直肠癌患者低,这种情况下需要进行精准的pT3/pT4a分期[1]。
临床中针对浆膜穿透组织的表现主要为肿瘤细胞随着增殖导致突破间皮细胞层,但是受到间皮细胞层脱落以及出现反应等因素影响,导致浆膜解剖学结果存在一定差异[2]。
关于形态学研究提出肿瘤穿透脏腹膜或直接侵入其他结构或器官,这一观念作为pT4定义对于结直肠癌疾病诊断提供了新思路。
在临床研究中发现如果肿瘤组织在生长中距离浆膜层不超过1mm情况,通常存在反应性改变,这种情况往往提示结直肠癌患者存在腹膜受累。
随着结直肠癌病理诊断的逐渐深入研究,关于pT4a定义内容更加细化更加科学,以肿瘤穿透脏腹膜为主,但是这种情况依然无法有效界定pT3和 pT4a。
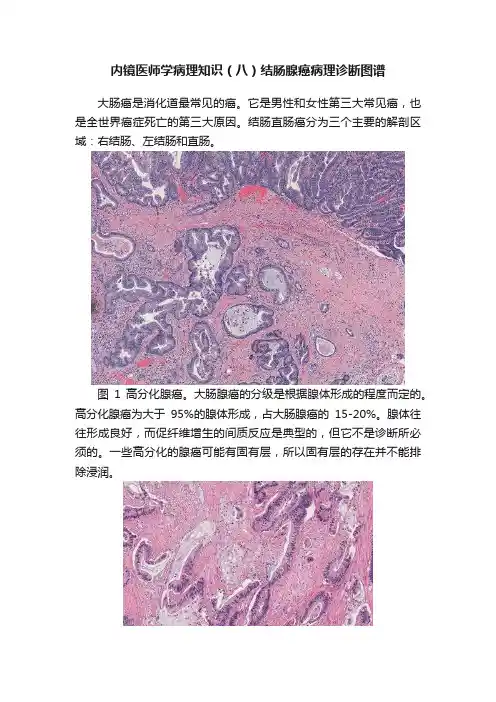
内镜医师学病理知识(八)结肠腺癌病理诊断图谱大肠癌是消化道最常见的癌。
它是男性和女性第三大常见癌,也是全世界癌症死亡的第三大原因。
结肠直肠癌分为三个主要的解剖区域:右结肠、左结肠和直肠。
图1 高分化腺癌。
大肠腺癌的分级是根据腺体形成的程度而定的。
高分化腺癌为大于95%的腺体形成,占大肠腺癌的15-20%。
腺体往往形成良好,而促纤维增生的间质反应是典型的,但它不是诊断所必须的。
一些高分化的腺癌可能有固有层,所以固有层的存在并不能排除浸润。
图2 中分化腺癌。
中分化腺癌是最常见的结直肠腺癌,占所有病例的60%至70%。
肿瘤累及50-95%的腺体,腺体往往比高分化腺癌的腺体组织更紊乱,并常充满坏死的碎片(“脏性坏死”)。
图3 中分化腺癌伴脏性坏死。
结直肠癌常见腔内坏死(本例所示)。
中分化腺癌典型的腺体分化程度和细胞异型性。
图4 中分化结肠腺癌。
大多数浸润性结直肠腺癌都与促结缔组织增生性间质反应有关(本例所示)。
有些低异型度大肠腺癌也有例外,特别是与炎症性肠病相关的低异型度管状腺癌。
图5 中分化腺癌,本例腺体紧密地排列在一起,但是肿瘤仍然>50%的腺体形成,应该被认为是中分化腺癌。
图6 低分化腺癌。
低分化腺癌的腺体形成<50%。
大约15-20%的大肠腺癌分化较差。
肿瘤可以由肿瘤细胞、浸润巢或单个浸润细胞组成。
低分化腺癌预后较差。
本例肿瘤是以单个细胞的形式浸润的。
图7 低分化腺癌。
分化差的腺癌也可能以不规则岛的形式浸润。
在本例中,肿瘤岛被包埋在结缔组织增生间质中,仅形成局灶性腺体。
图8 低分化腺癌。
低分化腺癌也可以形成肿瘤生长的实性区域。
本例肿瘤显示明显的细胞异型性与拉长的肿瘤细胞。
本例细胞异型性的程度通常大于中分化腺癌,支持低分化腺癌。
图9 胶样(黏液)腺癌。
黏液腺癌约占大肠腺癌的10%。
肿瘤由黏液池和恶性上皮组成;超过50%的肿瘤必须有粘液样结构才能被认为是黏液腺癌。
大多数黏液腺癌是微卫星稳定的(MSS),但黏液腺癌比传统腺癌有更高的微卫星不稳定性(MSI-H)。

结肠癌,分子病理学
结肠癌是一种常见的恶性肿瘤,分子病理学主要研究结肠癌的分子机制及其与肿瘤发展、预后相关的分子指标。
在分子病理学研究中,常用的方法包括基因突变检测、基因表达谱分析、蛋白质表达分析等。
通过这些方法,可以发现结肠癌中与肿瘤发生、生长、转移相关的分子变化。
其中,最常见的基因突变是肿瘤抑制基因APC的突变。
APC 基因突变可以导致绝大多数结肠癌的发生。
此外,还有一些其他基因的突变也与结肠癌的发生相关,如KRAS、BRAF、PIK3CA等。
这些基因的突变会导致细胞异常增殖、凋亡抑制等,从而促进结肠癌的发生。
通过基因表达谱分析,可以发现一些与结肠癌发展和预后相关的分子指标。
比如,肿瘤抑制基因P53的表达水平在结肠癌患者中常常下调,与预后不佳相关。
另外,一些微小RNA分子的表达变化也与结肠癌的发展相关,如miR-21的过表达与预后不佳有关。
蛋白质表达分析可以帮助了解结肠癌细胞的功能变化。
通过检测一些与肿瘤生长、转移相关的蛋白质,可以提供治疗上的靶点以及预后指标。
比如,癌胚抗原(CEA)是结肠癌常见的标志物,用于评估治疗效果和预测预后。
综上所述,结肠癌的分子病理学研究可以深入了解该疾病的发
展机制,有助于发现新的治疗靶点和预测指标,为个体化治疗提供更多选择。

肠道早癌病理报告1. 引言本文档是对一例肠道早期癌症患者进行病理学评估的报告,旨在提供关于该患者病变性质和病变程度的详细描述。
2. 患者信息•性别:男性•年龄:58岁•主诉:腹痛、便血3. 临床表现患者主要表现为腹痛和便血,症状持续2个月。
没有明显的全身不适,食欲尚可。
4. 病理学评估4.1 标本信息病理标本是通过结肠镜检查获得的活检组织,标本大小为1.5 cm × 1.5 cm。
标本加工后制成石蜡切片,厚度为5 um,染色方法采用血液常规染色。
4.2 组织学特征显微镜下观察,切片中呈现的组织形态特征如下:•肠道黏膜结构显示正常,黏膜表面光滑,没有溃疡或出血。
•淋巴组织结构无明显异常。
•黏膜下层的腺体结构简单而完整,无明显扩张或变异。
4.3 组织学分级根据国际统一癌症TNM分期系统,对患者的肿瘤进行了分级。
•T分期:Tis,肿瘤仅限于黏膜内。
•N分期:N0,没有淋巴结转移。
•M分期:M0,没有远处转移。
此外,根据细胞异型性和增生指数,对肿瘤的分级如下:•腺癌分级:G1,肿瘤细胞具备良好分化特征。
4.4 病理诊断根据上述观察和评估结果,综合判断患者的病变性质和程度,得出以下病理诊断结果:•肠道早期癌症(腺癌)•分级:Tis N0 M0,G1分级5. 诊疗建议根据患者的病理诊断结果,建议进行以下诊疗措施:•肠道早期癌症通常可以通过内镜下切除肿瘤达到治愈的目的,建议患者进行手术治疗。
•定期随访和监测,以便及时发现和处理任何复发或转移情况。
6. 结论综上所述,本文档对一例肠道早期癌症患者进行了病理学评估和诊断,并提供了相应的诊疗建议。
早期发现和治疗肠道癌症对预后具有重要意义,希望患者能够尽早接受治疗并定期进行随访。

结肠癌的病理分析结肠癌的病理分析结肠癌,又称大肠癌,是一种常见的恶性肿瘤,主要发生在结肠的黏膜层,具有高度的致命性。
本文将深入探讨结肠癌的病理分析,包括疾病的病理特征、发病机制、诊断方法、治疗策略以及预防措施。
**疾病的病理特征**结肠癌的病理特征在肿瘤组织的水平上表现为一系列异常的生物学现象。
这些特征包括以下几个方面:1. **肿瘤组织结构:** 结肠癌通常起源于结肠的内膜层,最初以息肉状或溃疡状病变出现。
随着肿瘤的生长,它逐渐扩展并侵犯到肠壁的不同层次,包括黏膜、黏膜下层、肌层和浆膜层。
2. **细胞异常:** 结肠癌的细胞呈现出明显的异质性,包括不规则的核形态、细胞核分裂增多和核浓缩等特征。
这些异常细胞在肿瘤组织中不断分裂和扩散。
3. **浸润和转移:** 结肠癌倾向于浸润邻近的正常组织,最终可以侵犯到邻近的淋巴结和远处器官,形成转移病灶。
4. **血供和坏死:** 结肠癌肿瘤内的血供不规则,导致一部分肿瘤组织发生坏死,这可能使肿瘤治疗更加困难。
**发病机制**结肠癌的发病机制涉及多个复杂的分子和细胞事件。
以下是一些关键的发病机制:1. **基因突变:** 结肠癌通常涉及一系列基因的突变,包括APC、KRAS、TP53 等。
这些突变导致细胞失控分裂和增殖,从而形成肿瘤。
2. **遗传因素:** 遗传因素在结肠癌的发病中起到重要作用。
家族性遗传性息肉病(Familial Adenomatous Polyposis,FAP)和Lynch 综合征等遗传疾病与结肠癌的风险密切相关。
3. **炎症:** 慢性结肠炎,如溃疡性结肠炎和克罗恩病,增加了患结肠癌的风险。
炎症可导致黏膜损伤和细胞增殖。
4. **饮食和生活方式:** 高脂饮食、低纤维摄入、肥胖、吸烟和过度饮酒等生活方式因素与结肠癌风险升高有关。
**诊断方法**及早诊断结肠癌对于提高治疗成功率至关重要。
以下是常用的结肠癌诊断方法:1. **结肠镜检查:** 结肠镜检查是最常用的诊断方法之一。

结肠癌1、恶性息肉定义:息肉中有癌细胞浸润穿透粘膜肌层到达粘膜下层(pT1),pTis不属于恶性息肉。
预后良好组织学特征:1或2级分化,无血管、淋巴管浸润,切缘阴性。
如果带蒂或广基息肉,镜下切除后标本破碎或切缘未能评估或具有预后不良的组织学特征,建议行结肠切除和区域淋巴清扫。
2、AJCC建议至少需检出12枚淋巴结才能准确判断为II期结肠癌。
可切除的结肠癌首选的手术方式是结肠切除加区域淋巴结整块清扫。
3、KRAS第2外显子的12(最常见)和13密码子突变者不能从EGFR抗体靶向治疗中获益,即野生型使用靶向治疗。
KRAS突变为结直肠癌发生中的早期事件,故其突变状态在原发灶与转移灶表现出高度的一致性。
所有诊断为IV期的转移性患者均应行肿瘤组织基因测序。
4、如KARS无突变,检测BRAF(PCR扩增或直接DNA测序分析)。
BRAF V600E突变者预后差,野生型OS20+个月,突变者10+个月,不能从EGFR抗体靶向治疗中获益。
5、可切除原发灶与肝、肺转移灶应行根治性切除,可同期或分期切除,可分次切除。
6、FOLFOX或CapeOX治疗3个月后或出现严重的神经毒性(>3度)时应考虑停用OXA,并用5-FU类+贝伐维持至肿瘤进展,可再用OXA。
7、初始治疗使用西妥昔单抗或帕尼单抗治疗,二线不应再用;两药一种治疗失败后不建议使用另一种。
8、西妥昔单抗适于与含伊立替康的方案联用,若不能耐受伊立替康可单药西妥昔单抗。
9、II期中高危及III期需行辅化,除非临床试验贝伐、C225、帕尼单抗或伊立替康不应用。
10、术后辅化:身体允许情况下越早越好,超过3个月不再行放化疗高危II期(T3-4N0M0)及III期(T1-4N1-2M0)应予术后辅化。
高危因素:具有不良预后因素包括T4、组织学分化差(3或4级)、血管淋巴管浸润、肠梗阻、局部穿孔的T3、肿瘤太近切缘、切缘不可评价或切缘阳性、标本检出淋巴结过少(少于12枚)。

肠癌,即结肠癌或直肠癌,的分级标准通常依据肿瘤的侵袭性、扩散程度和患者的预后等因素来确定。
最常用的分级系统之一是TNM分期系统,由肿瘤(T)、淋巴结(N)和远处转移(M)三个参数组成。
此外,病理分级也是评估肠癌恶性程度的重要指标,它根据肿瘤细胞的异型性和分裂象的数量来分级。
以下是TNM分期系统和病理分级的基本概述:
1. TNM分期系统:
T(肿瘤大小和扩散):Tis代表原位癌,T1表示肿瘤限于肠壁内,T2表示肿瘤穿透肠壁但未侵犯邻近组织,T3表示肿瘤侵犯邻近组织,T4表示肿瘤已经侵犯浆膜或具有远处转移的迹象。
N(淋巴结转移):N0表示无淋巴结转移,N1表示有淋巴结转移,N2表示远处淋巴结转移。
M(远处转移):M0表示无远处转移,M1表示有远处转移。
根据TNM分期的组合,可以确定癌症的阶段,从而指导治疗决策和预后评估。
2. 病理分级:
G1(低级别):细胞异型性小,分裂象少。
G2(中级别):细胞异型性中等,分裂象数量适中。
G3(高级别):细胞异型性大,分裂象多。
病理分级有助于预测癌症的侵袭性和患者的预后。
3. AJCC分期:
美国癌症联合委员会(AJCC)提供了详细的TNM分期定义,并根据这些定义制定了肠癌的staging 系统。
这个系统是国际上广泛接受的,用于指导临床治疗和预后评估。
肠癌的分级和分期对于选择适当的治疗方案和评估患者的预后至关重要。
治疗计划通常包括手术、化疗、放疗和/或靶向治疗,这些方案会根据癌症的分级和分期进行调整。
定期随访和监测也是肠癌治疗的重要组成部分。

结肠癌的病理分析结肠癌是一种常见的恶性肿瘤,其发病率在全球范围内呈上升趋势。
了解结肠癌的病理对于诊断、治疗和预后评估都具有重要意义。
一、结肠癌的发病部位结肠癌可以发生在结肠的任何部位,但常见的部位包括直肠、乙状结肠、降结肠、横结肠和升结肠。
不同部位的结肠癌在症状、治疗和预后方面可能会有所差异。
二、结肠癌的大体形态1、隆起型肿瘤向肠腔内突出,呈息肉状或菜花状。
这种类型的肿瘤通常在早期就会引起症状,如便血、排便习惯改变等。
2、溃疡型肿瘤表面形成溃疡,边缘不规则,底部凹凸不平。
这种类型的结肠癌容易引起肠道出血和感染。
3、浸润型肿瘤沿着肠壁浸润生长,导致肠壁增厚、管腔狭窄。
浸润型结肠癌往往在晚期才被发现,预后相对较差。
三、结肠癌的组织学类型1、腺癌这是结肠癌最常见的组织学类型,约占 90%以上。
腺癌又可以分为管状腺癌、乳头状腺癌和黏液腺癌等亚型。
2、未分化癌这种类型的癌细胞分化程度低,恶性程度高,预后较差。
3、鳞状细胞癌较为少见,通常发生在直肠与肛管交界处。
四、结肠癌的分级结肠癌的分级主要根据肿瘤细胞的分化程度来确定,通常分为高分化、中分化和低分化。
高分化的肿瘤细胞与正常细胞相似,恶性程度较低;低分化的肿瘤细胞异形性明显,恶性程度高。
五、结肠癌的转移途径1、淋巴转移是结肠癌最常见的转移途径。
癌细胞首先转移到肠壁旁的淋巴结,然后依次转移到肠系膜血管周围淋巴结、肠系膜根部淋巴结,最终可转移到腹主动脉旁淋巴结。
2、血行转移癌细胞可通过血液循环转移到肝脏、肺、骨等远处器官。
3、直接浸润肿瘤可以直接浸润到周围的组织和器官,如膀胱、子宫、输尿管等。
4、种植转移癌细胞脱落到腹腔内,可在腹膜、大网膜等部位形成种植转移灶。
六、结肠癌的临床病理分期目前常用的结肠癌分期系统是 TNM 分期,其中 T 代表原发肿瘤的大小和浸润深度,N 代表区域淋巴结转移情况,M 代表远处转移情况。
1、Ⅰ期肿瘤局限于黏膜层或黏膜下层,无淋巴结转移和远处转移。
结直肠癌黏液腺癌临床病理及治疗进展2024(全文)结直肠癌(colorectal cancer,CRC)是全球范围内的一种常见恶性肿瘤,流行病学数据表明全球CRC总体发病率已经升至第三位,也是癌症相关死亡的第二大原因[1]。
在CRC中,黏液腺癌(mucinous carcinoma,MC)是非特异性腺癌(adenocarcinoma not otherwise specified,AC)中一个独特的组织亚型,其特点是细胞外黏液占肿瘤体积50%以上。
一、黏液腺癌临床病理特征统计数据表明,MC发病率具备一定地域差异,MC的发病率从亚洲国家的3.9%到欧美国家的10%~13.6%不等[2]。
通过对发病部位的研究发现,MC在近端结肠的发病率显著高于直肠或远端结肠。
针对相同部位肿瘤进行分层分析后发现,MC常发现于疾病进展期[3]。
对这一现象有两种假说。
其一可能与MC中黏液蛋白物理特性相关,MC中黏液蛋白基因MUC2的过度表达和抑癌基因转录因子HATH1沉默密切相关,与AC中的表达趋势相反[4]。
染色体不稳定可能是MC疾病快速进展的另一种机制,相对于AC,MC出现微卫星不稳定性(microsatellite instability,MSI)频率更高。
高MSI发生率在Lynch综合征患者中也可以观察到,这表明MC与AC可能具备不同的致癌途径[5]。
MC与AC的转移模式存在明显差异,AC常见远处转移器官为肝脏,而MC更容易出现腹膜转移,且MC术后淋巴结阳性率高于AC。
转移模式差异的原因目前认为与黏液组分密切相关[6]。
正常黏液与肠道微生物构成了菌群生物膜。
MC中菌群生物膜的失调导致肠道上皮通透性增强,黏液组分会由肠道向腹腔内移动,导致肿瘤的腹膜转移及对邻近脏器侵犯[7]。
另外,菌群生物膜将诱导肠道炎症反应。
炎症反应导致大量细胞因子的产生,如TNF-α、IL-22,研究表明此类细胞因子促进肿瘤细胞的黏液分泌。
例如,TNF-α处理的结肠癌细胞ATOH1蛋白的稳定性增强,进而促进黏液分泌。
结肠癌病病理学结肠癌是一种常见的消化系统肿瘤,发病率日益增高。
其发生与肠黏膜上皮细胞失去正常生长控制机制有关。
本文将介绍结肠癌的病理学特点,包括肿瘤的形态学特征、分化程度、浸润方式、组织学类型、分期和分级等方面的内容。
一、肿瘤的形态学特征结肠癌多呈实性,表面呈现凹凸不平,富有弹性的白色肿块。
常见的肿瘤形态包括伞状生长、腺状生长、泡状生长和乳头状生长。
肿瘤的大小和浸润深度有很大的差异,早期肿瘤一般小于2cm,表浅生长,超过2cm的肿瘤多数呈现侵袭性生长,形态不规则。
二、分化程度结肠癌分化程度是指肿瘤组织与原发癌组织之间的相似程度。
根据肿瘤细胞来源,结肠癌通常分为腺癌、黏液癌、乳头状癌、粘液癌、未分化癌等。
腺癌是最常见的类型,分为高分化、中分化和低分化三种程度,高分化腺癌相对较为良性,低分化腺癌侵袭性较强。
三、浸润方式结肠癌的浸润方式包括切向浸润、纵向浸润和淋巴结转移三种方式。
沿大肠壁浸润是结肠癌的主要浸润方式,也是导致结肠癌近端切除术后复发的主要原因。
浸润深度、横向扩散和纵向溢出直接影响了预后的情况。
四、组织学类型结肠癌可以分为不同的组织学类型,如腺癌、黏液癌、乳头状癌等,组织学类型也是影响预后的一个关键因素之一。
黏液癌是一种具有较强浸润能力的恶性肿瘤,通常不易通过常规的病灶活检来发现。
乳头状癌通常是一种相对较小的、表面呈现光滑的肿瘤,早期往往没有症状,发现较为困难。
五、分期和分级结肠癌的分期是根据肿瘤的大小、侵袭深度、淋巴结转移情况等来确定肿瘤的严重程度和预后情况。
根据TNM分期标准,将结肠癌分为0-IV期。
0期为早期癌,肿瘤只局限于肠壁上皮内,不侵犯肌层;I期、II期属于肿瘤侵犯肌层和浆膜,但未侵犯淋巴结;III期、IV期属于肿瘤侵犯淋巴结和远处器官。
分级是根据肿瘤细胞分化程度和浸润深度等因素,将肿瘤分为I-IV级,分级越高代表预后越差。
结语在结肠癌的诊治中,病理学检查是一项重要的工具,通过结肠癌病理学特点的分析,能够更好地了解肿瘤的病情,并且为确定治疗方案和制定预后提供了重要数据依据。
结肠类癌(结肠嗜铬细胞瘤,结肠嗜银细胞瘤,结肠无功能性神经内分泌肿瘤)【病因】(一)发病原因目前没有相关内容描述。
(二)发病机制1.病理生理在结肠类癌中68%位于右半结肠,其中盲肠占50%。
右半结肠与阑尾、空回肠同起源于中肠,其类癌细胞类型65%属亲银性(a rgentaffin),35%属嗜银性(argyrophil)。
亲银和嗜银细胞区别是:前者分泌5-HT,而嗜银细胞则分泌另一些功能性的活性物质。
因而源于中肠的右半结肠类癌在病程晚期或伴有肝转移时可产生类癌综合征,这是由于类癌亲银细胞的5-HT分泌量超过了机体对之降解能力所致,此时血5-HT水平高于正常,在体内5-HT被分解后,24h尿5-羟吲哚乙酸(5-HIAA)量也随之增高。
源于后肠的左半结肠和直肠类癌细胞系非亲银性,不分泌5-HT,故晚期直肠类癌即使伴有肝转移也不产生类癌综合征。
(1)组织学起源:结肠类癌的组织发生,多数学者认为来自内胚层的Kulchitsky细胞。
按Williams和Sandler分法,结肠类癌归属于来源于后肠的亚群。
随着结肠类癌报道逐年增多,其发生部位似乎也超出了内胚层上皮的分布部位,加之瘤细胞胞质内的神经内分泌颗粒存在,以及部分瘤细胞能产生具有功能性的5-羟色胺(这种物质与正常中枢神经系统的神经递质5-羟色胺的功能无异),因此近期的资料更支持结肠类癌起源于神经内胚层,属神经内分泌肿瘤。
(2)肉眼形态:结肠类癌多位于黏膜深部,呈球形或扁豆形,向肠腔呈结节状或息肉状突起,广基无蒂,少数有蒂形成。
体积较小,直径一般在1.5cm以下,偶见大于数厘米者。
瘤体质较硬,边界清楚,表面有正常黏膜覆盖,少数可出现溃疡,形成脐凹样外观。
切面呈灰黄色或白色,界线清楚。
部分病例仅表现为黏膜下局限性增厚,或呈广基息肉状向肠腔隆起。
结肠类癌可见多发,肿瘤表面覆盖的黏膜一般完好,黏膜溃疡或出血较腺癌少见。
直肠类癌多发现象少见,其瘤体直径常小于1cm,可活动,大于1cm肿瘤常突入肠腔形成蕈状肿物,伴溃疡,偶尔发生肠管狭窄,以结节状和息肉状多见。
结肠癌组织学分级结肠癌是一种常见的消化道恶性肿瘤,其组织学分级是评估肿瘤细胞的分化程度和恶性程度的重要指标。
结肠癌的组织学分级可以帮助医生确定患者的预后和治疗方案。
本文将从不同的组织学分级角度来介绍结肠癌的特点和临床意义。
一、低分化结肠癌低分化结肠癌是一种恶性程度较高的肿瘤,其组织学特点是肿瘤细胞形态不规则,细胞核大而深染,核分裂像增多,细胞质少而嗜酸性。
低分化结肠癌的肿瘤细胞分化程度低,失去了正常结肠细胞的特征,肿瘤细胞的生长能力强,浸润能力强,易发生远处转移。
患者一般预后差,生存期较短,治疗难度大,手术切除后容易复发。
二、中分化结肠癌中分化结肠癌是指肿瘤细胞形态和组织学特点介于低分化和高分化之间的肿瘤。
其肿瘤细胞形态较规则,细胞核较大,核分裂像较少,细胞质较多,细胞排列比较紧密。
中分化结肠癌的恶性程度较低,生长能力和浸润能力相对较弱,预后相对较好,治疗效果较为满意。
三、高分化结肠癌高分化结肠癌是一种恶性程度较低的肿瘤,其组织学特点是肿瘤细胞形态较规则,细胞核较小,核分裂像较少,细胞质较多。
高分化结肠癌的肿瘤细胞分化程度较高,保留了一定的正常结肠细胞特征,生长能力和浸润能力相对较弱,预后相对较好,治疗效果较为满意。
组织学分级对结肠癌的预后和治疗方案有重要的指导作用。
低分化结肠癌的患者预后较差,治疗难度大,手术切除后易复发,需要采取综合治疗措施,如手术切除、放疗和化疗等。
中分化结肠癌的患者预后相对较好,手术切除后病情稳定,一般不需要辅助治疗。
高分化结肠癌的患者预后良好,手术切除后病情稳定,治疗效果较好,一般不需要进一步治疗。
组织学分级还可以帮助医生确定结肠癌的分期,从而指导后续治疗。
根据肿瘤的组织学分级、淋巴结转移情况和远处转移情况,可以将结肠癌分为不同的分期,如Ⅰ期、Ⅱ期、Ⅲ期和Ⅳ期。
不同分期的结肠癌治疗方案和预后也有所不同。
因此,组织学分级在结肠癌的诊断和治疗中具有重要的临床意义。
结肠癌的组织学分级是评估其恶性程度和预后的重要指标。