甘草在中、美、日、欧四国药典的比较
- 格式:docx
- 大小:25.81 KB
- 文档页数:4

姓名:徐涛学号:14211020462 专业:中药生物技术学《中国药典》、《美国药典》、《欧洲药典》比较1、各国药典概况1.1 历史沿革《中国药典》英文名称Pharmacopoeia of The People’s Republic of China;简称Ch .P。
1950年4月,成立了第一届中国药典编纂委员会,药典委员会分设名词、化学药、制剂、植物药、生物制品、动物药、药理、剂量8个小组,第一版《中国药典》于1953年由卫生部编印发行。
1957年出版《中国药典》1953年增补本。
1953年药典共收载药品531中,其中化学药215种,植物药与油脂类65种,动物药13种,抗生素2种,生物制品25种,各类制剂211种。
1965年1月26日卫生部颁布《中国药典》1963年版(第二版)发行通知和实施办法。
本版药典收载药品1310种,分一、二部,各有凡例和有关的目录,一部收载中医常用的中药材446种和中药成方制剂197;二部收载化学药品667种。
此外,一部记载药品的“功能主治”,二部增加了药品的“作用与用途”。
1979年10月4日卫生部颁布《中国药典》1977年版(第三版),自1980年1月1日起执行。
本版药典共收载药品1925种,其中一部收载中草药材(包括少数民族药材)、中草药提取物、植物油脂以及单味药材制剂等882种,成方制剂(包括少数民族药成方)270种,共1152种;二部收载化学药品、生物制品等773种。
1985年9月出版《中国药典》1985年版(第四版),1986年4月1日起执行。
本版收载药品1489种,其中一部收载中药材、植物油脂及单味制剂506种,成方制剂207种,共713种,二部收载化学药品、生物制品等776种。
1990年12月3日卫生部颁布《中国药典》1990年版(第五版),自1991年7月1日起执行。
1990年版的第一、第二增补本先后于1992、1993年出版,英文版于1993年7月出版。

:徐涛学号:专业:中药生物技术学《中国药典》、《美国药典》、《欧洲药典》比较1、各国药典概况1.1 历史沿革《中国药典》英文名称Pharmacopoeia of The People’s Republic of China;简称Ch .P。
1950年4月,成立了第一届中国药典编纂委员会,药典委员会分设名词、化学药、制剂、植物药、生物制品、动物药、药理、剂量8个小组,第一版《中国药典》于1953年由卫生部编印发行。
1957年出版《中国药典》1953年增补本。
1953年药典共收载药品531中,其中化学药215种,植物药与油脂类65种,动物药13种,抗生素2种,生物制品25种,各类制剂211种。
1965年1月26日卫生部颁布《中国药典》1963年版(第二版)发行通知和实施办法。
本版药典收载药品1310种,分一、二部,各有凡例和有关的目录,一部收载中医常用的中药材446种和中药成方制剂197;二部收载化学药品667种。
此外,一部记载药品的“功能主治”,二部增加了药品的“作用与用途”。
1979年10月4日卫生部颁布《中国药典》1977年版(第三版),自1980年1月1日起执行。
本版药典共收载药品1925种,其中一部收载中草药材(包括少数民族药材)、中草药提取物、植物油脂以及单味药材制剂等882种,成方制剂(包括少数民族药成方)270种,共1152种;二部收载化学药品、生物制品等773种。
1985年9月出版《中国药典》1985年版(第四版),1986年4月1日起执行。
本版收载药品1489种,其中一部收载中药材、植物油脂及单味制剂506种,成方制剂207种,共713种,二部收载化学药品、生物制品等776种。
1990年12月3日卫生部颁布《中国药典》1990年版(第五版),自1991年7月1日起执行。
1990年版的第一、第二增补本先后于1992、1993年出版,英文版于1993年7月出版。
本版共收载药品1751种,一部收载784种,其中中药材、植物油脂等509种,中药成方及单味制剂275种;二部收载化学制品、生物制品等967种。
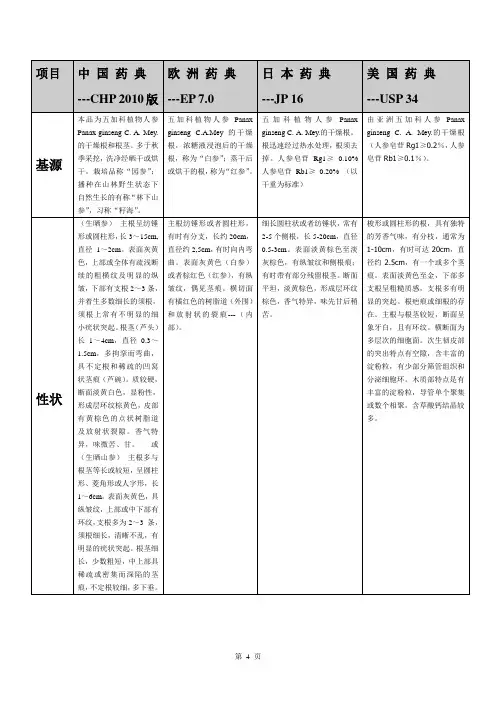
项目中国药典---CHP 2010版欧洲药典---EP 7.0日本药典---JP 16美国药典---USP 34基源本品为五加科植物人参Panax ginseng C. A. Mey.的干燥根和根茎。
多于秋季采挖,洗净经晒干或烘干。
栽培品称“园参”;播种在山林野生状态下自然生长的有称“林下山参”,习称“籽海”。
五加科植物人参Panaxginseng C.A.Mey 的干燥根,浓糖液浸泡后的干燥根,称为“白参”;蒸干后或烘干的根,称为“红参”。
五加科植物人参Panaxginseng C. A. Mey.的干燥根。
根迅速经过热水处理,根须去掉。
人参皂苷Rg1≥0.10%人参皂苷Rb1≥0.20% (以干重为标准)由亚洲五加科人参Panaxginseng C. A. Mey.的干燥根(人参皂苷Rg1≥0.2%,人参皂苷Rb1≥0.1%)。
性状(生晒参)主根呈纺锤形或圆柱形,长3~15cm,直径1~2cm。
表面灰黄色,上部或全体有疏浅断续的粗横纹及明显的纵皱,下部有支根2~3条,并着生多数细长的须根,须根上常有不明显的细小疣状突起。
根茎(芦头)长1~4cm,直径0.3~1.5cm,多拘挛而弯曲,具不定根和稀疏的凹窝状茎痕(芦碗)。
质较硬,断面淡黄白色,显粉性,形成层环纹棕黄色,皮部有黄棕色的点状树脂道及放射状裂隙。
香气特异,味微苦、甘。
或(生晒山参)主根多与根茎等长或较短,呈圆柱形、菱角形或人字形,长1~6cm。
表面灰黄色,具纵皱纹,上部或中下部有环纹,支根多为2~3 条,须根细长,清晰不乱,有明显的疣状突起。
根茎细长,少数粗短,中上部具稀疏或密集而深陷的茎痕,不定根较细,多下垂。
主根纺锤形或者圆柱形,有时有分支,长约20cm,直径约2,5cm,有时向内弯曲。
表面灰黄色(白参)或者棕红色(红参),有纵皱纹,偶见茎痕。
横切面有橘红色的树脂道(外围)和放射状的裂痕---(内部)。
细长圆柱状或者纺锤状,常有2-5个侧根,长5-20cm,直径0.5-3cm。

甘草四国药典比较班级:51 学号:1045114 姓名:陈多清一、质量标准比较1.中国药典(CHP2010)来源:本品为豆科植物甘草Radix Glycyrrhiza uralensis Fisch.、胀果甘草Glycyrrhiza in flataBat.或光果甘草Glycyrrhiza glabra L.的干燥根及根茎。
春、秋二季采挖,除去须根,晒干。
性状:1)根呈圆柱形,长25~100cm,直径0.6~3.5cm。
外皮松紧不一。
表面红棕色或灰棕色,具显著的纵皱纹、沟纹、皮孔及稀疏的细根痕。
质坚实,断面略显纤维性,黄白色,粉性,形成层环明显,射线放射状,有的有裂隙。
根茎呈圆柱形,表面有芽痕,断面中部有髓。
气微,味甜而特殊。
2)胀果甘草根及根茎木质粗壮,有的分枝,外皮粗糙,多灰棕色或灰褐色。
质坚硬,木质纤维多,粉性小。
根茎不定芽多而粗大。
3)光果甘草根及根茎质地较坚实,有的分枝,外皮不粗糙,多灰棕色,皮孔细而不明显。
鉴别:1)本品横切面:木栓层为数列棕色细胞。
栓内层较窄。
韧皮部射线宽广,多弯曲,常现裂隙;纤维多成束,非木化或微木化,周围薄壁细胞常含草酸钙方晶;筛管群常因压缩而变形。
束内形成层明显。
木质部射线宽3~5列细胞;导管较多,直径约至160μm;木纤维成束,周围薄壁细胞亦含草酸钙方晶。
根中心无髓;根茎中心有髓粉末淡棕黄色。
纤维成束,直径8~14μm,壁厚,微木化,周围薄壁细胞含草酸钙方晶,形成晶纤维。
草酸钙方晶多见。
具缘纹孔导管较大,稀有网纹导管。
木栓细胞红棕色,多角形,微木化。
2)取本品粉末1g,加乙醚40ml,加热回流1小时,滤过,药渣加甲醇30ml,加热回流1小时,滤过,滤液蒸干,残渣加水40ml使溶解,用正丁醇提取3次,每次20ml,合并正丁醇液,用水洗涤3次,蒸干,残渣加甲醇5ml使溶解,作为供试品溶液。
另取甘草对照药材1g,同法制成对照药材溶液。
再取甘草酸铵对照品,加甲醇制成每1ml含2mg的溶液,作为对照品溶液。

姓名:徐涛学号:14211020462 专业:中药生物技术学《中国药典》、《美国药典》、《欧洲药典》比较1、各国药典概况1.1 历史沿革《中国药典》英文名称Pharmacopoeia of The People’s Republic of China;简称Ch .P。
1950年4月,成立了第一届中国药典编纂委员会,药典委员会分设名词、化学药、制剂、植物药、生物制品、动物药、药理、剂量8个小组,第一版《中国药典》于1953年由卫生部编印发行。
1957年出版《中国药典》1953年增补本。
1953年药典共收载药品531中,其中化学药215种,植物药与油脂类65种,动物药13种,抗生素2种,生物制品25种,各类制剂211种。
1965年1月26日卫生部颁布《中国药典》1963年版(第二版)发行通知和实施办法。
本版药典收载药品1310种,分一、二部,各有凡例和有关的目录,一部收载中医常用的中药材446种和中药成方制剂197;二部收载化学药品667种。
此外,一部记载药品的“功能主治”,二部增加了药品的“作用与用途”。
1979年10月4日卫生部颁布《中国药典》1977年版(第三版),自1980年1月1日起执行。
本版药典共收载药品1925种,其中一部收载中草药材(包括少数民族药材)、中草药提取物、植物油脂以及单味药材制剂等882种,成方制剂(包括少数民族药成方)270种,共1152种;二部收载化学药品、生物制品等773种。
1985年9月出版《中国药典》1985年版(第四版),1986年4月1日起执行。
本版收载药品1489种,其中一部收载中药材、植物油脂及单味制剂506种,成方制剂207种,共713种,二部收载化学药品、生物制品等776种。
1990年12月3日卫生部颁布《中国药典》1990年版(第五版),自1991年7月1日起执行。
1990年版的第一、第二增补本先后于1992、1993年出版,英文版于1993年7月出版。

甘草与欧洲甘草的区别及正确使用方法甘草与欧洲甘草是两种常见的中草药材,它们虽然都属于甘草科植物,但在药用价值、功效以及使用方法上存在一些区别。
本文将从这些方面对甘草和欧洲甘草进行比较,并介绍正确的使用方法。
一、甘草与欧洲甘草的药用价值及功效区别甘草,学名甘草甘草,是我国常见的中草药之一。
甘草性味甘、平,入心、肺、脾经,具有补气、养阴、调和诸药的作用。
甘草被广泛应用于中医药领域,常用于治疗咳嗽、咽喉肿痛、脾胃虚弱等症状。
此外,甘草还有抗炎、抗过敏、保护肝脏等作用。
欧洲甘草,学名为甘草根,是欧洲地区常见的草本植物。
与甘草相比,欧洲甘草具有较强的镇痛、止咳、退烧等作用。
欧洲甘草根通常被制成草药粉末或提取物,用于制作口服药片、茶剂、口服液等。
二、甘草与欧洲甘草的使用方法区别1. 甘草的使用方法:甘草可以煎煮后直接饮用,也可以制成甘草颗粒、糖浆、糕饼等剂型方便使用。
常见的使用方法有:(1) 煎煮饮用:将甘草切成小块,加入适量水煎煮,煮至水变黄色后,过滤后饮用。
可根据个人需要调整煎煮时间和剂量。
(2) 甘草糖浆:将甘草与蜂蜜或糖浆混合,制成糖浆状,每日饭后可适量食用。
(3) 甘草颗粒:将甘草加工成颗粒状,每日饭后适量服用。
2. 欧洲甘草的使用方法:欧洲甘草通常以药片、茶剂、口服液等形式出现,使用方法如下:(1) 口服药片:根据医生或药师建议,每次口服1-2片,每日2-3次。
可随餐或饭后服用,遵循用药准确剂量。
(2) 茶剂:将欧洲甘草药材用开水冲泡,浸泡5-10分钟后饮用。
每日可饮用2-3次,可根据需要添加蜂蜜或柠檬调味。
(3) 口服液:根据药剂师或医生指导,每次服用剂量。
可直接服用或加入适量温水中稀释后服用。
三、甘草与欧洲甘草的禁忌及注意事项1. 甘草的禁忌及注意事项:(1) 孕妇禁用:甘草具有一定的活血化瘀作用,孕妇应避免使用以防影响胎儿发育。
(2) 高血压患者慎用:甘草可能导致血压升高,高血压患者应在医生指导下使用。

甘草原产地的调查研究报告(一)引言概述:甘草作为一种重要的草药资源,在中医药学中具有广泛的应用。
本文通过对甘草的原产地进行调查研究,旨在深入了解甘草在不同地区的生长环境、药用性状以及采收加工等情况,为甘草的种植和利用提供科学依据。
正文内容:一、甘草的主要分布地及生长环境1. 东亚地区是甘草的主要产地之一2. 中亚、西亚和欧洲地区也有甘草的分布3. 甘草适应能力强,对土壤和气候的要求较为宽松4. 甘草喜阳光,适宜生长的温度和湿度范围二、甘草的药用性状及有效成分1. 甘草的根茎和根皮是主要药用部位2. 甘草的药材外观特征及气味3. 甘草的有效成分主要包括甘草酸、甘草甜素等4. 甘草的药效及主要功效三、甘草的采收与加工1. 甘草采收的适宜时机及方法2. 甘草采收时的注意事项3. 甘草的初步加工方法4. 甘草的深加工及产品开发四、甘草在不同地区的应用情况1. 东亚地区甘草主要用于中药制剂的研究和应用2. 中亚、西亚和欧洲地区甘草的药用用途与发展趋势3. 甘草在食品、保健品和化妆品等行业的应用潜力4. 甘草在国际贸易中的地位和市场需求五、甘草的种植与利用展望1. 甘草的种植技术及育种研究2. 甘草在不同地区的种植规模和产量3. 甘草的利用前景和发展方向4. 甘草种植与利用的政策支持与合作机制总结:通过对甘草原产地的调查研究,我们深入了解了甘草在不同地区的种植环境、药用性状以及采收加工等情况。
这为甘草的种植和利用提供了科学依据,同时也展示了甘草在中医药学和其他领域的广阔应用前景。
未来,我们应进一步加强甘草的研究与合作,促进其产业化发展。

中、美、英、日、欧洲等五大药典中国药典药典简介:药典三部源于《中国生物制品规程》。
自1951 年以来,该规程已有六版颁布执行,分别为1951 年及1952 年修订版、1959 年版、1979 年版、1990 年版及1993 年版(诊断制品类)、1995 年版、2000 年版及2002 年增补本。
2002 年翻译出版了第一部英文版《中国生物制品规程》(2000 年版)。
第八届药典委员会还完成了《中国药典》 2000 年版2002 年增补本、2004 年增补本、《中国药品通用名称》(2005 年版)及《药品红外光谱集》(第三卷)、《临床用药须知》(中成药第一版、化学药第四版)。
2005 年,完成了《中国药典》 2005 年版英文版.药典收载的附录,药典一部为98 个,其中新增12 个、修订48 个,删除1 个;药典二部为137 个,其中新增13 个、修订65个、删除1 个;药典三部为140 个,其中新增62 个、修订78 个,删除1 个。
一、二、三部共同采用的附录分别在各部中予以收载,并进行了协调统一。
为加强国际合作与交流,本届委员会期间,与美国药典委员会联合举办了首届中美药典论坛。
为加强和提高国家标准工作效率与水平,常设机构完成了办公自动化及标准数据库的建设,实现了已颁布标准的计算机网络检索查询与统计分析。
美国药典(USP):下载地址:/药典简介:U.S. Pharmacopeia / National Formulary《美国药典/国家处方集》(简称USP/NF)。
由美国政府所属的美国药典委员会(The United States Pharmacopeial Convention)编辑出版。
USP于1820年出第一版,1950年以后每5年出一次修订版,到2005年已出至第28版。
NF1883年第一版,1980年15版起并入USP,但仍分两部分,前面为USP,后面为NF。
美国药典是美国政府对药品质量标准和检定方法作出的技术规定,也是药品生产、使用、管理、检验的法律依据。

各国药典比较ChP、USP、Ph.Eur.中药/天然药物质量标准比较及评述—以芦荟为例by14211第一部分中美欧药典简介1.中国药典《中华人民共和国药典》,简称《中国药典》。
是由国家药典委员会(原名卫生部药典委员会成立于1950年),根据《中华人民共和国药品管理法》的规定,负责组织编纂《中华人民共和国药典》及制定、修订国家药品标准,是法定的国家药品标准。
由国家食品药品监督管理部门批准颁布实施。
《中华人民共和国药典》(简称《中国药典》)2010年版,分一部、二部和三部,收载品种总计4567种,其中新增1386种。
药典一部收载药材和饮片、植物油脂和提取物、成方制剂和单味制剂等,品种共计2165种,其中新增1019种(包括439个饮片标准)、修订634种;药典二部收载化学药品、抗生素、生化药品、放射性药品以及药用辅料等,品种共计2271种,其中新增330种、修订1500种;药典三部收载生物制品,品种共计131种,其中新增37种、修订94种。
2010版药典收载的附录亦有变化,其中药典一部新增14个、修订47个;药典二部新增15个、修订69个;药典三部新增18个、修订39个。
一、二、三部共同采用的附录分别在各部中予以收载,并尽可能做到统一协调、求同存异。
中国药典包括凡例、正文及附录,是药品研制、生产、经营、使用和监督管理等均应遵循的法定依据。
所有国家药品标准应当符合中国药典凡例及附录的相关要求。
作为我国保证药品质量的法典,本版药典在保持科学性、先进性、规范性和权威性的基础上,着力解决制约药品质量与安全的突出问题,着力提高药品标准质量控制水平,充分借鉴了国际先进技术和经验,客观反映了中国当前医药工业、临床用药及检验技术的水平,必将在提高药品质量过程中起到积极而重要的作用,并将进一步扩大和提升我国药典在国际上的积极影响。
2.美国药典《美国药典/国家处方集》U.S. Pharmacopeia / National Formulary(简称USP/NF)。


甘草的产地分布
甘草也叫国老、甜草、乌拉尔甘草、甜根子,主要分布在中国和俄罗斯西伯利亚地区,喜阴暗潮湿,日照长气温低的干燥气候,多生长在干旱、半干旱的荒漠草原、沙漠边缘和黄土丘陵地带,下面我们就来看一看甘草的产地分布吧!
甘草的产地分布
1、国内产地:甘草主要分布于新疆、内蒙古、宁夏、甘肃、山西朔州野生为主,人工种植甘草主产于新疆、内蒙古、甘肃的河西走廊,陇西的周边,宁夏部分地区。
2、国外产地:在亚洲、欧洲、澳洲、美洲等地都有分布,大都有传统的药用和其他用途。
甘草的产地环境
甘草多生长在干旱、半干旱的沙土、沙漠边缘和黄土丘陵地带,在引黄灌区的田野和河滩地里也易于繁殖,适应性强,抗逆性强。
甘草喜光照充足、降雨量较少、夏季酷热、冬季严寒、昼夜温差大的生态环境,具有喜光、耐旱、耐热、耐盐碱和耐寒的特性,适宜在土层深厚、土质疏松、排水良好的砂质土壤中生长。
甘草的优劣辨别
对于中药市场的检查发现,市场上的甘草存在硫熏、细菌、重金属超标等问题,达不到药用要求,甚至出现伪品,
冒充甘草出售,鉴别甘草要点有以下四点。
1、根圆柱形,红棕色或灰棕色。
2、具纵沟皱及皮孔。
3、质坚实,断面黄白色,形成层环纹明显。
4、气微、具特殊甜味。
而类似品光果甘草则皮孔细而不明显,质坚实,断面裂隙较少,味甜。
胀果甘草则根及根茎粗壮,灰棕色或褐色,质坚硬、少粉性,味甜或带苦。
至于黄甘草、粗毛甘草则根条较细,甜味略差。
刺果甘草、苦甘草则味苦,可资区别。
《美国药典》《欧洲药典》《日本药典》与《中国药典》中中药饮片微生物限度检查及标准的比较研究作者:范一灵李琼琼秦峰刘浩杨美成来源:《中国药房》2020年第22期摘要目的:比較《美国药典》43版(USP43)、《欧洲药典》10.0版(EP10.0)、《日本药典》17版(JP17)与《中国药典》2020年版(ChP2020)中中药饮片微生物限度检查方法及标准的差异,为我国中药饮片相关微生物标准的修订和完善提供参考。
方法:比较USP43、EP10.0、JP17和ChP2020在中药饮片的微生物计数法(包括抽样与取样、菌种和培养基选择、微生物和耐热菌计数等)、控制菌检查(包括样品前处理、增菌、分离、鉴定等)、微生物相关限度标准等方面的差异。
结果与结论:在中药饮片微生物的检查方法上,USP43、EP10.0、JP17都有各自独立的规定,ChP2020则新增了“通则1108”。
在检验项目上,除需氧菌总数、霉菌和酵母菌总数外,ChP2020与EP10.0规定了3种控制菌(耐胆盐革兰阴性菌、大肠埃希菌、沙门菌)的检查方法;在此基础上,JP17补充了金黄色葡萄球菌的检查方法;USP43增加了梭菌的检查方法,并最早提出不可接受微生物风险评估理念;ChP2020还新增了耐热菌计数方法。
在微生物限度标准上,USP 43对中药饮片的分类最为细致,要求较为严格且高于EP10.0、JP17;ChP2020仍未对中药饮片控制菌检查设立统一的限度标准。
虽然,ChP2020对“中药提取物及中药饮片的微生物限度标准”进行了修订,但相较于美国、欧洲和日本药典的规定还不完善。
建议根据我国中药饮片微生物污染和控制现状,逐步完善药典对中药相关产品的微生物检验和限度标准,合理细化相应产品的微生物限度水平。
关键词中药饮片;药典;微生物检查;限度标准;比较研究中图分类号 R921;R927.1 文献标志码 A 文章编号 1001-0408(2020)22-2695-06DOI 10.6039/j.issn.1001-0408.2020.22.02ABSTRACT; ;OBJECTIVE: To compare the difference of microbiological limit test and criteria of TCM decoction pieces among 43 edition of United States Pharmacopeia; (USP43),10.0 edition of European Pharmacopeia; (EP10.0), 17 edition of Japanese Pharmacopeia;(JP17) and 2020 edition of Chinese Pharmacopeia (ChP2020), and to provide refernce for the revision and improvement of microbiological standards for TCM decoction pieces in China. METHODS: The differences in the microbial enumeration tests method (including sampling and sample preparation, selection of bacteria and culture medium, count of microorganisms and heat-resistant bacteria, etc.), tests for specified microorganisms (including sample pretreatment,enrichment, separation and identification, etc.) and microbial related limit criteria were compared among USP43, EP10.0, JP17 and ChP2020. RESULTS & CONCLUSIONS: In terms of microbiological examination of TCM decoction pieces, USP43, EP10.0, JP17 had their own independent provisions. Chp2020 added “general rule 1108”. In terms of inspection items, in addition to the total aerobic bacteria count and total combined yeasts and molds count, ChP2020 and EP10.0 provided three methods for the inspection of control bacteria (bile-resistant Gram-negative bacteria, Escherichia coli, Salmonella). On the basis, JP17 supplemented Staphylococcus aureus test; However, USP43 added Clostridium test method and put forward the concept of objectionable microorganisms risk assessment; ChP2020 also added a new method for counting heat-resistant bacteria. In terms of microbial limit criteria, USP43 was the most detailed in the classification of TCM decoction pieces, which was more strict than EP10.0 and JP17; ChP2020 had not set up a unified limit for the inspection of control bacteria of TCM decoction pieces. ChP2020 revised the “microbial limit standard for TCM extracts and TCM decoction pieces”, but it was notperfect compared with the Pharmacopoeia of the United States, Europe and Japan. It is suggested that according to the current situation of microbial contamination and control of TCM decoction pieces, the microbial limit test and criteria of TCM related products in Pharmacopoeia should be gradually improved, and the microbial limit level of corresponding products should be reasonably refined.KEYWORDS; ;TCM decoction piece; Pharmacopeia; Microbial limit test; Limit criteria; Comparative study中药饮片是由中药材通过炮制加工而成的可直接用于中医临床的产品,其大多源自天然植物、动物或矿物,通常携带有大量微生物[1-2]。
甘草Radix Glycyrrhizae 中、日、美三国药典质量标准的比较前言:随着中国加入WTO,我国药品标准工作在促进我国医药事业发展方面、在国际间药品标准协调方面以发挥越来越重要的作用。
参照国际间药品标准协调工作的进展,结合我国实际,调整我国药品标准制订和修订的策略,对促进我国民族医药工业的发展,增进国际间医药贸易往来将会产生深远的影响。
正文:以甘草为例比较重、日、美三国药典质量标准来源:【中国药典】:本品为豆科植物甘草Radix Glycyrrhiza uralensis Fisch.、胀果甘草Glycyrrhiza in flataBat.或光果甘草Glycyrrhiza glabra L.的干燥根及根茎。
春、秋二季采挖,除去须根,晒干。
【日本药局方】:Glycyrrhiza uralensis Fischer, Glycyrrhiza glabra Linne(Leguminosae)的干燥根。
【美国药典】:Glycyrrhiza glabra L.和G.Uralensis Fischer的根、根茎及匍匐枝。
性状:【中国药典】:根呈圆柱形,长25~100cm,直径0.6~3.5cm。
外皮松紧不一。
表面红棕色或灰棕色,具显著的纵皱纹、沟纹、皮孔及稀疏的细根痕。
质坚实,断面略显纤维性,黄白色,粉性,形成层环明显,射线放射状,有的有裂隙。
根茎呈圆柱形,表面有芽痕,断面中部有髓。
气微,味甜而特殊胀果甘草根及根茎木质粗壮,有的分枝,外皮粗糙,多灰棕色或灰褐色。
质坚硬,木质纤维多,粉性小。
根茎不定芽多而粗大光果甘草根及根茎质地较坚实,有的分枝,外皮不粗糙,多灰棕色,皮孔细而不明显。
【日本药局方】:圆柱形,长1m以上,直径0.5~3.0cm。
表面暗棕色或红棕色,断面略呈纤维性,横切面皮部与木质部界面分明,呈放射状。
气微,味甜。
【美国药典】:呈圆柱形,长约1m,直径0.5~3.0cm,外表深棕色至红棕色,有皮孔。
姓名:徐涛学号:14211020462 专业:中药生物技术学《中国药典》、《美国药典》、《欧洲药典》比较1、各国药典概况1.1 历史沿革《中国药典》英文名称Pharmacopoeia of The People’s Republic of China;简称Ch .P。
1950年4月,成立了第一届中国药典编纂委员会,药典委员会分设名词、化学药、制剂、植物药、生物制品、动物药、药理、剂量8个小组,第一版《中国药典》于1953年由卫生部编印发行。
1957年出版《中国药典》1953年增补本。
1953年药典共收载药品531中,其中化学药215种,植物药与油脂类65种,动物药13种,抗生素2种,生物制品25种,各类制剂211种。
1965年1月26日卫生部颁布《中国药典》1963年版(第二版)发行通知和实施办法。
本版药典收载药品1310种,分一、二部,各有凡例和有关的目录,一部收载中医常用的中药材446种和中药成方制剂197;二部收载化学药品667种。
此外,一部记载药品的“功能主治”,二部增加了药品的“作用与用途”。
1979年10月4日卫生部颁布《中国药典》1977年版(第三版),自1980年1月1日起执行。
本版药典共收载药品1925种,其中一部收载中草药材(包括少数民族药材)、中草药提取物、植物油脂以及单味药材制剂等882种,成方制剂(包括少数民族药成方)270种,共1152种;二部收载化学药品、生物制品等773种。
1985年9月出版《中国药典》1985年版(第四版),1986年4月1日起执行。
本版收载药品1489种,其中一部收载中药材、植物油脂及单味制剂506种,成方制剂207种,共713种,二部收载化学药品、生物制品等776种。
1990年12月3日卫生部颁布《中国药典》1990年版(第五版),自1991年7月1日起执行。
1990年版的第一、第二增补本先后于1992、1993年出版,英文版于1993年7月出版。