β-1,3葡聚糖酶检测试剂盒使用说明
- 格式:pdf
- 大小:86.51 KB
- 文档页数:3

β-1,3葡聚糖酶(β-1,3-GA)活性检测试剂盒说明书可见分光光度法:UPLC-MS-4216:50T/24S试剂名称规格保存条件提取液液体50mL×1瓶2-8℃保存试剂一粉剂×2支2-8℃保存试剂二液体42mL×1瓶2-8℃保存标准品粉剂×1支2-8℃保存溶液的配制:1.试剂一:临用前取1支加1.6mL蒸馏水溶解,用不完的试剂2-8℃保存4周;2.标准品:10mg无水葡萄糖。
临用前加入1mL蒸馏水溶解,配制成10mg/mL葡萄糖溶液备用,2-8℃保存2周。
β-1,3-GA(EC3.2.1.73)主要存在植物中,催化β-1,3-葡萄糖苷键水解。
在植物染病或处于其他逆境条件下,可诱导细胞大量合成β-1,3-GA,因此β-1,3-GA活性测定广泛应用于植物病理和逆境生理研究。
β-1,3-GA水解昆布多糖,内切β-1,3-葡萄糖苷键,产生还原末端,通过测定还原糖生成速率,来计算其酶活性。
Fucoidanβ-1,3-GA Reducing SugarReducing Sugar+3,5-Dinitrosalicylic Acid3-Amino-5-Nitrosalicylate(540nm)注意:实验之前建议选择2-3个预期差异大的样本做预实验。
如果样本吸光值不在测量范围内建议稀释或者增加样本量进行检测。
可见分光光度计、台式离心机、水浴锅/恒温培养箱、可调式移液器、1mL玻璃比色皿、研钵/匀浆器、超声破碎仪、冰和蒸馏水。
一、样本处理(可适当调整待测样本量,具体比例可以参考文献)1.组织:按照组织质量(g):提取液体积(mL)为1:5~10的比例(建议称取约0.1g组织,加入1mL提取液),进行冰浴匀浆。
12000g,4℃离心10min,取上清,置冰上待测。
2.细菌或细胞:收集细菌或细胞到离心管内,离心后弃上清;按照每500万细菌或细胞加入1mL提取液,超声波破碎细菌或细胞(功率200w超声3s,间隔10s,重复30次);12000g4℃离心10min,取上清,置冰上待测。
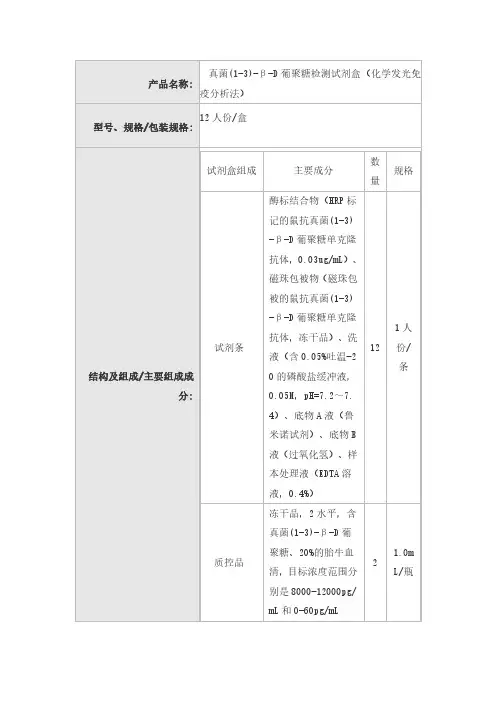
1.1包装规格:12人份/盒1.2主要组成成分:校准曲线:二维码。
质控范围批特异,详见标签。
2.1外观试剂盒完整无破损,试剂盒内各组分齐全、无破损、渗透;盒上印刷的标识以及瓶签、盒签上的字迹清晰完整,易识别。
2.2装量试剂盒的液体试剂净含量应不低于标示量。
2.3溯源性根据GB/T21415规定了校准曲线的溯源过程,溯源至企业工作校准品。
2.4准确度回收率应在80%~120%的范围内。
2.5检出限检出限应不高于40pg/mL。
2.6线性试剂盒在浓度为[50,50000]pg/mL的线性范围内,相关系数(r)应不低于0.9900。
2.7重复性测定高、低两个浓度水平的样本,测定结果的变异系数CV(%)值应不大于10%。
2.8特异性与浓度分别为50ng/mL的曲霉菌半乳甘露聚糖、念珠菌甘露聚糖、革兰阴性菌脂多糖均无交叉反应,检测结果均应不超过检出限。
2.9批间差用3个不同批号的试剂盒分别检测两个浓度水平的样本,3个批次试剂盒之间的批间变异系数CV(%)应不大于15%。
2.10质控品赋值有效性重复测定试剂盒内质控品各3次,每次测定结果均应在质控品测定值允许的范围内。
2.11质控品批内瓶间差取同一批号10支质控冻干品进行检测,所有瓶内重复性检测结果的变异系数CV(%)值应不大于10%。
2.12稳定性2.12.1效期稳定性试剂盒按要求在2℃~8℃放置,有效期12个月,取效期末的试剂盒进行检测,各项指标仍符合2.4~2.8的要求。
2.12.2质控品复溶稳定性质控品溶解后置2℃~8℃保存14天后,取质控品进行检测,结果应符合2.10、2.11的要求。

声明本产品属精密光学仪器,在日常使用中,应严格按照我公司出具的操作流程进行试验操作,并确保工作环境正常。
本试验的操作者必须为经我公司培训合格的微生物实验室检验人员,如需更换操作者,请做好交接工作,确保新的操作者了解仪器特性、熟悉操作流程。
为避免试验结果不准确,请操作者认真阅读操作注意事项及操作流程,并严格遵守。
如有任何疑问,请联系我公司售后服务部。
售后服务部电话:400-811-9958北京金山川科技发展有限公司真菌(1-3)-β-D葡聚糖测定1.目的建立真菌(1-3)-β-D葡聚糖检测标准操作规范,保证实验结果的准确性。
2.授权操作人经培训合格的微生物实验室检验人员。
3.实验原理(1-3)-β-D葡聚糖检测原理:真菌(1-3)-β-D葡聚糖激活酶反应主剂中的G因子后形成凝固蛋白,根据其所引起的浊度变化对真菌(1-3)-β-D葡聚糖浓度进行定量测定。
(1-3) -D-Glucan活化因子G 因子G凝固酶原凝固酶凝固蛋白原凝固蛋白(凝胶)4.产品性能指标4.1 灵敏度最小检出值5pg/ml5.实验组成5.1实验仪器及器具:MB-80微生物快速动态检测系统、洁净工作台、低速离心机、恒温仪, 20~200ul 加样器、100~1000ul加样器、旋涡混合器、定时器。
5.2实验耗材:200ul无热原吸头、1000ul无热原吸头、无热原平底试管、无热原真空采血管。
5.3试剂盒组成:真菌(1-3)-β-D 葡聚糖检测试剂盒(光度法):试剂盒包括反应主剂和样品处理液。
6.工作环境相对湿度:20%~80%;温度控制:10~30℃;电源电压:220V±10%,50Hz±2%。
7.标本采集、处理及保存7.1检测样本:血液、肺泡盥洗液、胸腔积液、腹水、脑脊液、尿液(无菌取中段尿或穿刺尿)7.2采集要求:采样过程要求无菌操作,用专用的无热原真空采血管(肝素类抗凝)。
常规病人早上用药治疗前空腹采血/取样(血透患者透析前采血)。


附1真菌(1-3)—β—D葡聚糖检测标准操作规程1.目的规范真菌(1—3)-β-D葡聚糖检测的操作规程,保证结果准确性。
2.原理实验条件下,来源于某些真菌细胞壁的(1—3)—β—D葡聚糖能够特异性地激活本试剂盒反应试剂的酶促凝集系统,使反应溶液的透光度发生变化。
利用(1—3)—β—D葡聚糖标准品建立β-D—葡聚糖生物效应与透光度变化关系的标准曲线,便可定量地测定人血液的(1—3)- β-D葡聚糖含量.3.试剂真菌(1-3)—β-D葡聚糖检测试剂盒,湛江安度斯生物有限公司。
试剂盒包装规格:20人份/盒。
复溶后的试剂溶液应在10分钟内使用。
若当次试验有剩余,可将剩余的试剂溶液置-20℃以下冷冻保存,一周内使用.不能反复冻融试剂溶液.4.检测设备: LKM动态试管检测仪。
5.实验用具:250 μl无热原吸头、20—200 μl移液器、75℃试管恒温仪、旋涡混合器、塑料试管架、无热原真空采血管(肝素抗凝剂).6.标本采集及送检要求6.1标本采集要求6.1.1采集过程要求无菌操作,用指定的肝素类抗凝、无菌、无β葡聚糖采血管;6.1.2常规住院病人早上用药前空腹采血,血透患者透析前采血。
6.2标本的送检和保存要求标本采集后应在半小时内离心,4小时内检测完。
若当日不能及时检测的标本应将离心后的血浆转移至无β葡聚糖的容器内-20℃以下冷冻保存,一周内使用。
7.实验操作7.1在试验开始前,先开启LKM动态试管检测仪,预热,一段时间后发出哔的一声,试管仪温度达到37℃,待用;7.2取本试剂盒所配的无热原真空采血管取受试者静脉血1~2 ml,以400 g离心10分钟;7.3取富含血小板的血浆100 μl,加到样品稀释瓶中,在旋涡混合器上轻轻混匀,然后插入75℃试管恒温仪中加热10分钟;7.4加热10分钟后,将样品稀释瓶从75℃试管恒温仪中取出,使其降至室温即可,即为1:10稀释的样品供试溶液;7.5取β—G试剂1支,开启;7.6取β-G试剂复溶液1支,开启后用移液器取0。


微生物检验实验室G试验标准操作规程1.目的规范G试验标准操作规程。
1.操作授权人经过培训并通过考核的微生物实验室工作人员。
2.用途:4.原理真菌(1,3)-β-D葡聚糖能特异性激活反应主剂中的G因子、凝固酶原等,发生凝固蛋白原转变的级联反应从而引起吸光度的变化,根据检测气吸光度的变化从而对真菌(1,3)-β-D葡聚糖浓度进行定量,试剂中添加的两性电解质甘氨酸、氨基糖苷类抗生素机表面活性剂可抑制脂多糖对B、C因子的激活,对革兰阴性脂多糖有特异性屏蔽作用。
5.样本要求5.1血清的制备:用一次性无热源真空采血管采静脉血4ml,进行3000rpm/min离心10-15min分得血清2小时内检测。
5.2血清保存:标本需冷藏于2-8℃下不超过24小时避免反复冻融。
产品如果需要运输,则应该冷藏运输。
5.3标本前处理:取上述血清0.1ml,加入0.9ml样品处理液中,混匀后70℃孵育10min,取出后立刻放入冷却槽中冷去5min,即为待测血清样品。
6.操作步骤:取待测血清0.2ml直接加入酶反应主剂中,溶解后使用微量加样器转移至9*65mm标准无热源平底试管中,然后再加入0.1ml反应主剂溶液,混匀后,插入MB-80微生物快速动态检测系统中进行反应,反应结束后检测系统自动计算出待测血清中真菌(1,3)-β-D葡聚糖含量。
注:每批试剂盒由厂家提供参考标准曲线。
定标使用真菌(1,3)-β-D 葡聚糖纯品,纯度>98%。
7.结果判断结果解释:参考值:正常血清真菌(1,3)-β-D葡聚糖值<60pg/ml。
60pg/ml以下,无深部真菌感染(隐球菌、接合菌除外):60-100pg/ml之间,为观察期,应连续检测。
100pg/ml以上,怀疑为深部真菌将感染,建议临床结症状治疗。
8.注意事项8.1、只能检测(1,3)-β-D葡聚糖含量,不能区分真菌种属,不能检测接合菌和隐球菌。
8.2、实验操作应在无菌无热源的环境下,避免微生物细菌污染8.3、无菌无热源的采血管(建议采用BD血清管),保证试验数据的准确。

葡聚糖内-1,3-β-葡糖酶葡聚糖是一种多糖,由许多β-葡萄糖分子组合而成。
这种多糖在自然界广泛分布,包括植物、真菌、细菌和动物中。
葡聚糖在这些生物中具有多种重要功能,如提供结构支持、膜层保护、细胞间信号传递和免疫应答等。
葡聚糖内-1,3-β-葡糖酶(PG)是一种能够降解葡聚糖的酶类。
它可以催化葡聚糖的水解反应,将其分解成低聚糖和单糖。
目前,许多真菌中的PG已被分离和鉴定,其中以酵母菌的PG最为广泛研究。
PG对于细胞生长和分化、细胞壁合成和重组、藻类和真菌的招募、植物抵御病原菌的作用等有重要影响。
PG的生物学功能也被广泛研究和应用于医药和农业领域。
近年来,PG的研究是一个非常热门的课题。
研究人员通过分子生物学和基因工程技术得到了大量的PG基因序列。
同时,PG的表达也受到广泛关注,特别是在微生物发酵、细胞壁结构和医药领域。
在微生物发酵中,PG可以通过控制其基因表达来产生大量低聚糖和单糖。
这些产物对某些工业生产和食品添加剂有广泛的应用,比如说肉制品和面包。
在真菌和植物内,PG对于细胞壁合成和重组起着重要作用。
在细胞壁合成中,PG可以加速和协调细胞壁的合成。
在细胞壁重组中,PG的表达可以加快细胞壁的降解和合成,使细胞获得更好的结构和保护。
在医药领域,PG被广泛研究,用于治疗某些疾病。
例如,PG可以作为免疫调节剂,增强宿主对病原菌的抵御能力。
它也可以用作抗肿瘤药物,破坏肿瘤细胞壁,促进细胞凋亡。
总之,PG在生物界中是起着重要作用的酶类。
它拥有丰富的生物学功能和广泛的应用价值。
我们期待在未来的研究中能够更深入地了解PG的作用机制,扩大它的应用范围,并进一步应用于医药和农业领域。

β-1,3-葡聚糖含量测定方法
β-1,3-葡聚糖(也称为1,3-β-D-葡聚糖或胞外多糖)是一种可溶性聚糖,常用于农业、食品和医药工业。
测定β-1,3-葡聚糖的含量可以通过以下方法之一实现:
1. 紫外可见光谱测定:将葡聚糖溶液经稀酸或酶处理后,通过
测定其在特定波长下的吸收光强度来确定其浓度。
这种方法对于测定
高浓度的β-1,3-葡聚糖样品较为简便。
2. 蒸发法:将葡聚糖溶液加热至葡聚糖变为糊状物,并将其继
续加热蒸发至干燥。
然后称量得到的干燥物的质量,通过质量差来计
算葡聚糖的含量。
这种方法对于测定低浓度的β-1,3-葡聚糖样品较为适用。
3. 原子吸收光谱法:通过将葡聚糖溶解后,在特定条件下使用
原子吸收光谱仪测定其特定金属离子沉淀物的质量,从而计算出含量。
这种方法对于含有特定金属离子的葡聚糖样品测定较为准确。

真菌葡聚糖检测试剂盒(动态显色法)简要操作说明一、试剂与耗材1. 试剂(1)鲎试剂:冻干粉;(2)细菌内毒素检查用水;(3)处理液a;(4)处理液b;(5)缓冲液;(6)葡聚糖标准品。
2. 耗材(1)微板板条;(2)大、小吸头;(3)试管。
二、操作规程1. 配制葡聚糖标准品用细菌内毒素检查用水溶解一瓶葡聚糖标准品,使之成为10000pg/ml的溶液。
置于旋涡混匀器上混匀至少10秒钟以上。
然后分别配制浓度梯度分别为2000/1000/500/250/100/50/25pg/ml的葡聚糖标准品溶液。
2. 配制处理液(1)处理液a和处理液b按1:1比例配制。
先取处理液a加入试管中,再加入处理液b;(2)用封口膜封住管口,存放于2-8°C,配成的处理液必须在30分钟内使用完。
注意:根据样本数按照每个样本/测试需40ul的量进行配制,现配现用。
3. 用血清处理液处理血清样品(1)吸取10ul标准品或样品于微板孔中;(2)各微板孔中分别加入40ul配制好的处理液;(3)放入酶标仪,于37C孵育10分钟。
4. 配制反应主剂和试验操作规程(1)取鲎试剂冻干粉,每支加入标示量一半的细菌内毒素检查用水,再分别加入标示量一半的缓冲液。
若使用多支鲎试剂,可待每支鲎试剂溶解后,将所有鲎试剂溶液合在一起,备用。
(2)待微板达到孵育时间,上述加样的微板孔中分别加入鲎试剂溶液100ul;(3)上机检测,37℃,405/490nm,每分钟读数一次,运行40分钟。
三数据处理1. 计算0到40分钟内所有的点的OD值的平均变化率(如用户的酶标仪的软件可以做到,用户减去490nm的背景干扰)2. 建立标准曲线:V = aC + b,其中:V为OD值的平均变化率,C为葡聚糖的浓度,a为直线斜率,b 为Y轴截距。
3. 当实验数据同时满足如下三个条件时实验才有效:(1)标准曲线的浓度点≥3,标准曲线的相关系数r≥0.980;(2)标准曲线最低点的V值大于阴性对照的V值。
人1-3-β-D葡聚糖(1-3-β-D glucosidase)酶联免疫分析ELISA试剂盒操作步骤本试剂仅供研究使用目的:本试剂盒用于测定人血清,血浆及相关液体样本中1-3-β-D葡聚糖(1-3-β-D glucosidase)含量。
实验原理:本试剂盒应用双抗体夹心法测定标本中人1-3-β-D葡聚糖(1-3-β-D glucosidase)水平。
用纯化的人1-3-β-D葡聚糖(1-3-β-D glucosidase)抗体包被微孔板,制成固相抗体,往包被单抗的微孔中依次加入1-3-β-D葡聚糖(1-3-β-D glucosidase),再与HRP标记的1-3-β-D葡聚糖(1-3-β-D glucosidase)抗体结合,形成抗体-抗原-酶标抗体复合物,经过彻底洗涤后加底物TMB显色。
TMB在HRP酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。
颜色的深浅和样品中的1-3-β-D葡聚糖(1-3-β-D glucosidase)呈正相关。
用酶标仪在450nm波长下测定吸光度(OD值),通过标准曲线计算样品中人1-3-β-D葡聚糖(1-3-β-D glucosidase)浓度。
样本处理及要求:1.血清:室温血液自然凝固10-20分钟,离心20分钟左右(2000-3000转/分)。
仔细收集上清,保存过程中如出现沉淀,应再次离心。
2.血浆:应根据标本的要求选择EDTA、者柠檬酸钠或肝素作为抗凝剂,混合10-20分钟后,离心20分钟左右(2000-3000转/分)。
仔细收集上清,保存过程中如有沉淀形成,应该再次离心。
3.尿液:用无菌管收集,离心20分钟左右(2000-3000转/分)。
仔细收集上清,保存过程中如有沉淀形成,应再次离心。
胸腹水、脑脊液参照实行。
4.细胞培养上清:检测分泌性的成份时,用无菌管收集。
离心20分钟左右(2000-3000转/分)。
仔细收集上清。
检测细胞内的成份时,用PBS(PH7.2-7.4)稀释细胞悬液,细胞浓度达到100万/ml左右。
货号:QS2611 规格:50管/24样β-1,3 葡聚糖酶(β-1,3-glucanase,β-1,3-GA)试剂盒说明书可见分光光度法正式测定前务必取2-3个预期差异较大的样本做预测定测定意义:β-1,3-GA(EC 3.2.1.73)主要存在植物中,催化β-1,3-葡萄糖苷键水解。
在植物染病或处于其他逆境条件下,可诱导细胞大量合成β-1,3-GA,因此β-1,3-GA活性测定广泛应用于植物病理和逆境生理研究。
测定原理:β-1,3-GA水解昆布多糖,内切β-1,3-葡萄糖苷键,产生还原末端,通过测定还原糖生成速率来计算其酶活性。
自备实验用品及仪器:可见分光光度计、台式离心机、水浴锅、可调式移液器、1mL玻璃比色皿、研钵、冰和蒸馏水。
试剂组成和配制:提取液:液体50mL×1瓶,4℃保存;试剂一:粉剂×1瓶,4℃保存;临用前加入3mL蒸馏水,充分溶解待用;用不完的试剂4℃保存;试剂二:液体30mL×1瓶,4℃保存;粗酶液提取:1、细菌或培养细胞:先收集细菌或细胞到离心管内,离心后弃上清;按照细菌或细胞数量(104个):提取液体积(mL)为500~1000:1的比例(建议500万细菌或细胞加入1mL提取液),超声波破碎细菌或细胞(冰浴,功率20%或200W,超声3s,间隔10s,重复30次);12000g 4℃离心10min,取上清,置冰上待测。
2、按照组织质量(g):提取液体积(mL)为1:5~10的比例(建议称取约0.1g组织,加入1mL 提取液),进行冰浴匀浆。
12000g 4℃离心10min,取上清,置冰上待测。
3、血清(浆)样品:直接检测。
测定步骤:1、分光光度计预热30min以上,调节波长至550nm,蒸馏水调零。
A,第1页,共2页如果吸光值大于2,可以用蒸馏水稀释后测定(计算公式乘以相应稀释倍数),ΔA=A测定-A 对照。
每个测定管需设一个对照管。
β-1,3-GA活性计算:1、标准条件下测定回归方程为y = 0.0958x -0.0192;x为标准品浓度(mg/mL),y为吸光值。
血浆真菌葡聚糖检测标准操作规程1. 目的规范使用真菌葡聚糖检测试剂盒(动态浊度法)进行真菌(1,3)-β-D-葡聚糖检测的检验操作程序,保证实验结果的准确性。
2. 适用范围用于人体血浆真菌(1,3)-β-D-葡聚糖定量检测。
3. 责任者经培训合格的微生物实验室检验人员。
4. 适用仪器鲎试验微生物检测仪ELx808IU(全自动酶标仪ELx808)或同等光学检测仪器。
5. 样本要求5.1 标本采集用除葡聚糖肝素钠抗凝真空采血管采集静脉血2ml以上,进行3000rpm离心60s,分离得到富含血小板的血浆样本。
5.2 标本保存和运送样本可立即用于检测。
若不能及时检测,应将血浆转移至无热原试管内,保存于2-8℃待测,保存期为一周;也可保存于-20℃待测,保存期为1个月。
样本应避免反复冻融。
6. 检验方法6.1 仪器设定6.1.1 预热仪器,设置温育温度为37ºC。
6.1.2 设定检测仪器的读板波长为630nm(或厂家提供的其他适用波长),读板时间为120分钟,每1分钟读板一次。
6.2 取0.1ml血浆样本,加入到0.9ml样本处理液中,混匀后70℃保温10分钟,取出后立即放入冰水中冰浴3分钟。
6.3 取处理后的血浆样本混合液0.2 ml加入鲎试剂中,轻轻振摇溶解鲎试剂后移取0.1ml 至反应容器中,放置于检测仪器中检测,反应结束后软件将自动计算出样本真菌(1,3)-β-D-葡聚糖含量。
7. 参考值正常人体血浆中真菌(1,3)-β-D-葡聚糖含量<10pg/ml。
8. 检验结果解释8.1 样本(1,3)-β-D-葡聚糖含量≥10pg/ml时,表明该样本有(1,3)-β-D-葡聚糖存在,但并不表示该样本一定存在真菌活菌。
8.2 样本(1,3)-β-D-葡聚糖含量<10pg/ml时,表示该样本(1,3)-β-D-葡聚糖低于参考值。
9. 检验方法的局限性9.1 本试剂盒只能检测真菌(1,3)-β-D-葡聚糖含量,不能区分真菌种属。
β-1,3-葡聚糖酶活性的测定在植物染病或处于其他逆境条件下,可诱导细胞大量合成β-1,3-葡聚糖酶。
该酶水解昆布多糖,内切β-1,3-葡萄糖苷键,产生还原末端。
可通过测定还原糖表示酶活力。
1.仪器设备恒温水浴、分光光度计、研钵、高速冷冻离心机、透析袋等。
2.操作方法1)试剂配制①铜试剂:称取12g酒石酸钾钠(NaKC4H4O3·4H2O),24g无水碳酸钠,16g碳酸氢钠,分别溶于200ml蒸馏水中后混匀。
另称硫酸铜4g(CuSO4·5H2O)溶于200ml蒸馏水,缓缓加入并搅拌到上述混合液中。
再称取无水硫酸钠180g,溶于其中,置沸水浴20min,冷却后过滤,最后定容至1000ml备用。
此液易出现结晶,应保存在20℃以上。
②砷钼酸试剂:25g钼酸铵[(NH4)6Mo7O24·4H2O]溶于450ml蒸馏水,加入22ml浓H2SO4,充分混匀。
另称取3g砷酸氢二钠(Na2HAsO4·7H2O),溶于25ml蒸馏水后,与上述钼酸铵溶液混合,37℃保温24~48h,贮于棕色瓶备用。
2)标准还原糖测定:将500μg/ml的葡萄糖溶液准确稀释至150μg/ml,用此再稀释成数种不同浓度的葡萄糖溶液。
然后取几支干净试管,分别加入不同浓度的葡萄糖溶液0.5ml,并加0.5ml铜试剂,置沸水浴10min后,自来水冷却。
加入0.5ml砷钼酸试剂,混匀,再加入3.5ml蒸馏水,于分光光度计660nm处测定光密度,并作光密度-还原糖浓度标准曲线。
3)酶蛋白的提取和活力测定①酶蛋白的提取:将植物材料加5倍量0.05mol/L的乙酸钠缓冲液(pH5.0),充分研磨,于15000×g 离心15min后,将上清液置透析袋中,用提取液在4℃下透析过夜。
经离心取上清液,放于冰箱备用。
②酶活力的测定:取0.4ml的1mg/ml昆布多糖(Sigma公司,溶于上述乙酸缓冲液),加入0.1 ml酶液,于37℃保温15min,立即加入0.5ml铜试剂,混匀,并于100℃水浴10min,置冷水中冷却,再加入0.5ml砷钼酸试剂,呈现蓝色后加蒸馏水3.5ml,660nm处比色,对照标准曲线求出样品液中的还原糖量。
真菌(1-3)-β-D葡聚糖检测试剂盒(光度法)适用范围:与本公司生产的微生物快速动态检测系统配套使用,用于体外定量测定人血清中真菌(1-3)-β-D 葡聚糖的含量。
1.1 产品规格GKT-1M:20人份/盒;GKT-5M:50人份/盒;GKT-10M:50人份/盒;GKT-20M:60人份/盒。
1.2 主要组成成分GKT-1MGKT-5MGKT-10MGKT-20M2.1 外观反应主剂为白色冻干粉末,样品处理液为无色透明液体,反应主剂溶解液为无色透明液体。
2.2装量样品处理液为0.9ml/支;GKT-5M反应主剂溶解液0.6ml/支;GKT-10M反应主剂溶解液为1.2ml/支;GKT-20M反应主剂溶解液为2.4ml/支,其中装量不小于标称值。
2.3 准确性试剂盒对真菌(1-3)-b-D葡聚糖的回收率为75%~125%。
2.4 重复性试剂盒重复检测结果的CV(%)值应不大于10%。
2.5线性在浓度1 pg/ml~625 pg/ml范围内,其线性相关系数的绝对值r≥0.980,在1 pg/ml~93.75 pg/ml范围内,绝对偏差为±14.06pg/ml;在93.75pg/ml~625 pg/ml范围内,相对偏差≤15%。
2.6空白检测限真菌(1-3)-b-D葡聚糖浓度的空白检测限为1pg/ml。
2.7反应特征曲线反应主剂的特征反应曲线应为近似直线的反S形。
2.8原始吸光度酶反应主剂以适当水稀释后,在(270±5)nm波长处应有单一吸收峰。
2.9批间差不同批号的试剂盒检测结果的相对偏差应不大于10%。
2.10稳定性试剂盒2-8℃储存有效期36个月,贮存期末的分析性能应符合2.1~2.8的要求。
2.11特异性浓度为100pg/ml革兰阴性菌脂多糖溶液,对(1-3)-b-D葡聚糖检测结果的交叉反应率不大于2%。
真菌(1-3)-β-D葡聚糖测定规范操作1.目的建立真菌(1-3)-β-D葡聚糖检测标准操作规范,保证实验结果的准确性。
2.授权操作人经培训合格的微生物实验室检验人员。
3.实验原理(1-3)-β-D葡聚糖检测原理:真菌(1-3)-β-D葡聚糖激活酶反应主剂中的G因子后形成凝固蛋白,根据其所引起的浊度变化对真菌(1-3)-β-D葡聚糖浓度进行定量测定。
4.产品性能指标4.1 灵敏度10pg/ml4.2 精密度批间CV≤10% 。
4.3 准确性回收率75-125%。
4.4 标准曲线相关系数r绝对值≥0.9805.实验组成5.1实验仪器及器具:MB-80微生物快速动态检测系统、洁净工作台、低速离心机、恒温仪,20~200µl加样器、100~1000µl加样器、旋涡混合器、定时器。
5.2实验耗材:200µl无热原吸头、1000µl无热原吸头、无热原平底试管、无热原真空采血管。
5.3试剂盒组成:真菌(1-3)-β-D 葡聚糖检测试剂盒(光度法):试剂盒包括反应主剂和样品处理液。
6.工作环境相对湿度:20%~80%;温度控制:10~30℃;电源电压:220V±10%,50Hz±2%。
7.标本采集及保存7. 1检测样本:血液、脑脊液、胸腹水、肺泡灌洗液等。
7.2采集要求:采样过程要求无菌操作,用专用的无热原真空采血管(肝素类抗凝)。
常规病人早上用药治疗前采血/取样(血透患者透析前采血)。
7.3样本保存:样本采集后应在3000转/分进行离心,若不能及时检测,应将血浆转移至无热原转移管内,在-20℃冰箱中冷冻保存,一周内使用。
8.操作程序8.1 打开MB-80微生物快速动态检测系统主机、电脑及恒温仪预热30min。
8.2 打开MB-80微生物快速动态检测系统软件,录入病人信息、样本种类及检测项目等信息后点击采集。
8.3 血液前处理过程,无菌操作,用专用无热原真空采血管(肝素类抗凝)抽取静脉血4ml轻轻混匀,按转速3000r/min进行离心1分钟,得到富含血小板血浆。
β-1,3葡聚糖酶检测试剂盒使用说明
分光光度法货号:BC0360
规格:50管/24样
产品内容:
提取液:液体50mL×1瓶,4℃保存;
试剂一:粉剂×1瓶,4℃保存;临用前加入3mL蒸馏水,充分溶解待用;用不完的试剂4℃保存;
试剂二:液体42mL×1瓶,4℃保存;
标准品:粉剂×1支,4℃保存,含10mg无水葡萄糖(干燥失重<0.2%),临用前加入1ml蒸馏水溶解,配制成10mg/ml葡萄糖溶液备用,4℃可保存1周,或者用饱和苯甲酸溶液溶解,可保存更长时间。
标准品准备:将标准品用蒸馏水稀释至1、0.8、0.6、0.4、0.2mg/ml。
产品说明:
β-1,3-GA(EC3.2.1.73)主要存在植物中,催化β-1,3-葡萄糖苷键水解。
在植物染病或处于其他逆境条件下,可诱导细胞大量合成β-1,3-GA,因此β-1,3-GA活性测定广泛应用于植物病理和逆境生理研究。
β-1,3-GA水解昆布多糖,内切β-1,3-葡萄糖苷键,产生还原末端,通过测定还原糖生成速率,来计算其酶活性。
自备仪器和用品:
可见分光光度计、台式离心机、水浴锅、可调式移液器、1mL玻璃比色皿、研钵、冰和蒸馏水。
操作步骤:
粗酶液提取:
按照组织质量(g):提取液体积(mL)为1:5~10的比例(建议称取约0.1g组织,加入1mL 提取液),进行冰浴匀浆。
12000g4℃离心10min,取上清,置冰上待测。
测定步骤:
1、分光光度计预热30min以上,调节波长至540nm,蒸馏水调零。
2、样本测定(在1.5mL EP管中依次加入下列试剂):
试剂名称(μL)测定管对照管标准管(葡萄糖溶液)样本或标准液100100100蒸馏水100100
试剂一100
充分混匀,放入37℃水浴60min。
试剂二600600600
充分混匀,沸水浴5min(盖紧,防止水分散失),流水冷却,540nm处记录各管吸光值A,如果吸光值大于2,可以用蒸馏水稀释后测定(计算公式乘以相应稀释倍数),ΔA=A测定-A对照。
每个测定管需设一个对照管。
β-1,3-GA活性计算:
根据标准管吸光度(x)和浓度(y,mg/ml)建立标准曲线,将ΔA带入公式中计算出样品中产生的还原糖的含量y值(mg/ml)
(1)按蛋白浓度计算
单位的定义:每mg组织蛋白每小时产生1mg还原糖定义为一个酶活性单位。
β-1,3-GA(U/mg prot)=(y×V1)÷(V1×Cpr)=y÷Cpr
(2)按样本鲜重计算
单位的定义:每g组织每小时产生1mg还原糖定义为一个酶活性单位。
β-1,3-GA(U/g鲜重)=(y×V1)÷(W×V1÷V2)=y÷W
(3)按细菌或细胞密度计算
单位的定义:每1万个细胞或细菌每小时产生1mg还原糖定义为一个酶活性单位。
β-1,3-GA(U/g鲜重)=(y×V1)÷(500×V1÷V2)=0.002×y
V1:加入反应体系中样本体积,0.1mL;V2:加入提取液体积,1mL;Cpr:样本蛋白质浓度,mg/mL;W:样本鲜重,g。