CNAS-CL39:2012《医学实验室质量和能力认可准则在临床免疫学检验领域的应用说明》 [2012-09-26]
- 格式:pdf
- 大小:219.92 KB
- 文档页数:11



![CNAS-CL42:2012《医学实验室质量和能力认可准则在临床微生物学检验领域的应用说明[2012-09-26]](https://uimg.taocdn.com/4e9e3f4ae518964bcf847c86.webp)
CNAS-CL42医学实验室质量和能力认可准则在临床微生物学检验领域的应用说明Guidance on the Application of AccreditationCriteria for the MedicalLaboratory Quality and Competence in the Field ofClinical Microbiology中国合格评定国家认可委员会前言本文件由中国合格评定国家认可委员会(CNAS)制定,是CNAS根据临床微生物学检验的特性而对CNAS-CL02:2008《医学实验室质量和能力认可准则》所作的进一步说明,并不增加或减少该准则的要求。
本文件与CNAS-CL02:2008《医学实验室质量和能力认可准则》同时使用。
在结构编排上,本文件章、节的条款号和条款名称均采用CNAS-CL02:2008中章、节条款号和名称,对CNAS-CL02:2008应用说明的具体内容在对应条款后给出。
本文件的附录A为规范性附录。
附录的序号及内容与CNAS-CL02:2008不对应。
本文件为第一次发布。
医学实验室质量和能力认可准则在临床微生物学检验领域的应用说明1 范围本文件规定了CNAS对医学实验室临床微生物学检验领域的认可要求。
临床微生物学检验领域中涉及的病毒血清学检验、基因扩增检验、寄生虫检验等应符合相关专业领域应用说明的要求。
2 规范性引用文件下列文件对于本文件的应用是必不可少的。
凡是注日期的引用文件仅注日期的版本适用于本文件。
凡是不注日期的引用文件,其最新版本(包括修改单)适用于本文件。
CNAS-RL02 能力验证规则3 术语和定义4 管理要求4.1 组织和管理4.1.1 实验室为独立法人单位的,应有医疗机构执业许可;实验室为非独立法人单位的,其所属医疗机构执业证书的诊疗科目中应有医学实验室,自获准执业之日起,开展医学检验工作至少2年。
4.1.5 h) 应至少有1名具有副高以上专业技术职称,从事医学检验工作至少5年以上的人员负责技术管理工作。

CNAS-CL38医学实验室质量和能力认可准则在临床化学检验领域的应用说明Guidance on the Application of Accreditation Criteria for the Medical Laboratory Quality and Competence in the Field of Clinical Chemistry中国合格评定国家认可委员会前言本文件由中国合格评定国家认可委员会(CNAS)制定,是CNAS根据临床化学检验的特点,对CNAS-CL02:2012《医学实验室质量和能力认可准则》所作的进一步说明,并不增加或减少该准则的要求。
本文件与CNAS-CL02:2012《医学实验室质量和能力认可准则》同时使用。
在结构编排上,本文件章、节的条款号和条款名称均采用CNAS-CL02:2012中章、节条款号和名称,对CNAS-CL02:2012应用说明的具体内容在对应条款后给出。
本文件的附录A、B为规范性附录。
附录的序号及内容与CNAS-CL02:2012不对应。
本文件于2012年制定,本次为第3次修订。
医学实验室质量和能力认可准则在临床化学检验领域的应用说明1 范围本文件规定了CNAS对医学实验室临床化学检验领域的认可要求。
适用时,医学实验室临床免疫学定量检验领域的认可,应符合本文件要求。
2 规范性引用文件下列文件对于本文件的应用是必不可少的。
凡是注日期的引用文件仅注日期的版本适用于本文件。
凡是不注日期的引用文件,其最新版本(包括修改单)适用于本文件。
GB/T 20468-2006 临床实验室定量测定室内质量控制指南WS/T 407-2012 医疗机构内定量检验结果的可比性验证指南CNAS-RL02 能力验证规则CNAS-CL31 内部校准要求3 术语和定义4 管理要求4.1 组织和管理责任4.1.1.2医学实验室为独立法人单位的,应有医疗机构执业许可证;实验室为非独立法人单位的,其所属医疗机构的执业许可证书的诊疗科目中应有医学实验室;自获准执业之日起,实验室开展医学检验工作至少2年。
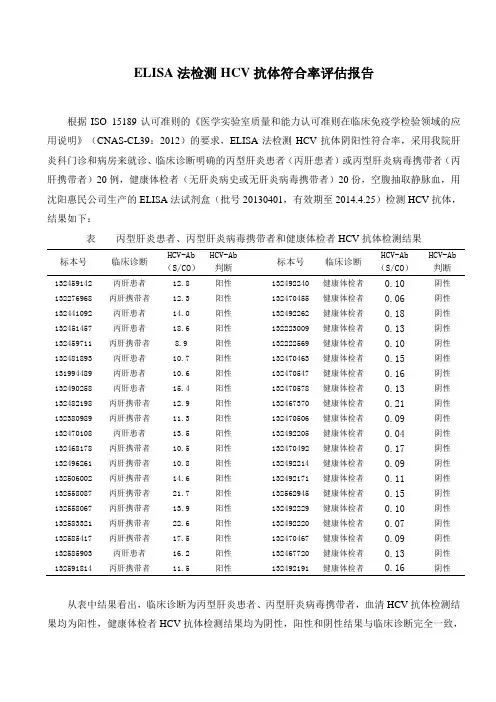
ELISA法检测HCV抗体符合率评估报告根据ISO 15189认可准则的《医学实验室质量和能力认可准则在临床免疫学检验领域的应用说明》(CNAS-CL39:2012)的要求,ELISA法检测HCV抗体阴阳性符合率,采用我院肝炎科门诊和病房来就诊、临床诊断明确的丙型肝炎患者(丙肝患者)或丙型肝炎病毒携带者(丙肝携带者)20例,健康体检者(无肝炎病史或无肝炎病毒携带者)20份,空腹抽取静脉血,用沈阳惠民公司生产的ELISA法试剂盒(批号20130401,有效期至2014.4.25)检测HCV抗体,结果如下:表丙型肝炎患者、丙型肝炎病毒携带者和健康体检者HCV抗体检测结果标本号临床诊断HCV-Ab(S/CO)HCV-Ab判断标本号临床诊断HCV-Ab(S/CO)HCV-Ab判断132459142 丙肝患者12.8 阳性132492240 健康体检者0.10 阴性132276968 丙肝携带者12.3 阳性132470455 健康体检者0.06 阴性132441092 丙肝患者14.0 阳性132492262 健康体检者0.18 阴性132451457 丙肝患者18.6 阳性132223009 健康体检者0.13 阴性132459711 丙肝携带者8.9 阳性132222569 健康体检者0.10 阴性132481893 丙肝患者10.7 阳性132470463 健康体检者0.15 阴性131994489 丙肝患者10.6 阳性132470547 健康体检者0.16 阴性132490258 丙肝患者15.4 阳性132470578 健康体检者0.13 阴性132482198 丙肝携带者12.9 阳性132467370 健康体检者0.21 阴性132380989 丙肝携带者11.3 阳性132470506 健康体检者0.09 阴性132470108 丙肝患者13.5 阳性132492205 健康体检者0.04 阴性132468178 丙肝携带者10.5 阳性132470492 健康体检者0.17 阴性132496261 丙肝携带者10.8 阳性132492214 健康体检者0.09 阴性132506002 丙肝携带者14.6 阳性132492171 健康体检者0.11 阴性132558087 丙肝携带者21.7 阳性132562945 健康体检者0.15 阴性132558067 丙肝携带者13.9 阳性132492229 健康体检者0.10 阴性132583321 丙肝携带者22.6 阳性132492220 健康体检者0.07 阴性132585417 丙肝携带者17.5 阳性132470467 健康体检者0.09 阴性132585903 丙肝患者16.2 阳性132467720 健康体检者0.13 阴性132591814 丙肝携带者11.5 阳性132492191 健康体检者0.16 阴性从表中结果看出,临床诊断为丙型肝炎患者、丙型肝炎病毒携带者,血清HCV抗体检测结果均为阳性,健康体检者HCV抗体检测结果均为阴性,阳性和阴性结果与临床诊断完全一致,说明该试剂盒检测结果的阴阳性符合率达到100%,质量完全满足实验室和临床医生及病人等客户的要求。

CNAS-CL02-A005医学实验室质量和能力认可准则在临床微生物学检验领域的应用说明Guidance on the Application of Accreditation Criteria for the Medical Laboratory Quality and Competence in the Field of Clinical Microbiology中国合格评定国家认可委员会前言本文件由中国合格评定国家认可委员会(CNAS)制定,是CNAS根据临床微生物学检验的特性而对CNAS-CL02:2012《医学实验室质量和能力认可准则》所作的进一步说明,并不增加或减少该准则的要求。
本文件与CNAS-CL02:2012《医学实验室质量和能力认可准则》同时使用。
在结构编排上,本文件章、节的条款号和条款名称均采用CNAS-CL02:2012中章、节条款号和名称,对CNAS-CL02:2012应用说明的具体内容在对应条款后给出。
本文件的附录A为规范性附录。
附录的序号及内容与CNAS-CL02:2012不对应。
本文件代替:CNAS-CL42:2012。
本次为换版修订,相对于CNAS-CL42:2012,本次换版仅涉及文件编号改变。
医学实验室质量和能力认可准则在临床微生物学检验领域的应用说明1 范围本文件规定了CNAS对医学实验室临床微生物学检验领域的认可要求。
临床微生物学检验领域中涉及的病毒血清学检验、基因扩增检验、寄生虫检验等应符合相关专业领域应用说明的要求。
2 规范性引用文件下列文件对于本文件的应用是必不可少的。
凡是注日期的引用文件仅注日期的版本适用于本文件。
凡是不注日期的引用文件,其最新版本(包括修改单)适用于本文件。
CNAS-RL02 能力验证规则3 术语和定义4 管理要求4.1 组织和管理责任4.1.1.2 实验室为独立法人单位的,应有医疗机构执业许可;实验室为非独立法人单位的,其所属医疗机构执业证书的诊疗科目中应有医学实验室;自获准执业之日起,开展医学检验工作至少2年。

HIV初筛实验室管理制度1.目的为加强本实验室艾滋病初筛检测工作的规范化管理,提高检测工作,根据《全国艾滋病检测工作管理办法》(2020年修订版),特制定本实验室的管理制度。
2.范围适用于艾滋病初筛实验室。
3.人员组成本实验室人员均参加过省疾病控制中心HIV初筛检测技术培训,并获得培训证书,实验室负责人为副主任检验师及以上,且有2年以上临床免疫工作经验:认可的授权签字人为主管检验师,且从事申请认可授权签字领域专业技术工作3年以上,符合相关要求。
4.安全等级HIV初筛实验室为二级生物安全实验室。
5. 管理制度5.1 热爱本职工作,遵守医务人员服务守则与工作原则;5.2 坚持不歧视原则,与服务对象建立良好关系,关心他人;5.3 做好合格和规范的预防艾滋病传播的宣传工作;5.4 严格执行《全国艾滋病检测工作管理办法》(2020年修订版),遵照本实验室的相关SOP文件工作;5.5 严格执行实验室生物安全通用要求,工作人员要熟悉生物安全操作知识和消毒技术;5.6 不得在实验室内喝饮料,抽烟,吃食物和化妆等,不得在实验室会客;5.7 实验室用品(包括工作服)不得用作其他用途,不可将私人用品和无关用品带入实验室;5.8 工作时,要戴手套,穿工作服,操作时手套破损应立即丢弃,洗手并戴上新手套;5.9 不要用戴手套的手触摸暴露皮肤、口唇、眼睛、耳朵和头发等;5.10 尽量避免使用尖锐物品和器具,宜用不易破碎材料制品;禁止用口吸任何物品;5.11 工作认真负责。
严格执行本实验室的质量管理控制程序规则;做好室间质评和室内质控工作;保证检测结果准确无误,杜绝差错事故的发生;5.12 工作结束后,要对工作台面消毒,如用消毒液清洁后要干燥20分钟以上;操作时要有标本,检测试剂外溅时,应及时消毒;平时要保持环境整洁;5.13 工作完毕,脱去手套后洗手,再脱去工作服,用消毒洗手液和流动水洗手;5.14 遇到意外事故,应立即处理并报告上级,妥善处理。

医学实验室质量和能力认可准则在临床微生物学检验领域的应用说明如下:
1. 标准化操作流程:医学实验室应根据质量认可准则建立标准化的操作流程,包括样品采集、处理、培养和鉴定等步骤,以确保结果的准确性和可重复性。
2. 质量控制体系:医学实验室应建立完善的质量控制体系,包括内部质量控制和外部质量评估。
内部质量控制包括定期进行质控样品的检测和记录,以评估实验室的准确性和稳定性。
外部质量评估则通过参与外部质量评估方案,与其他实验室进行比对,以评估实验室的能力和水平。
3. 人员培训和继续教育:医学实验室应确保实验人员具备必要的专业知识和技能,并定期进行培训和继续教育,以跟踪最新的技术和方法,提高实验人员的能力和水平。
4. 设备和设施:医学实验室应配备适当的设备和设施,以支持临床微生物学检验的进行。
设备应符合相关的质量标准,并定期进行维护和校准,以确保其准确性和可靠性。
5. 数据管理和报告:医学实验室应建立完善的数据管理系统,包括样
品信息、检测结果和质量控制记录等。
检测结果应准确、及时地向临床医生报告,以支持临床决策和治疗。
6. 不断改进:医学实验室应不断改进质量管理体系,包括定期进行内部审核和管理评审,以发现和纠正问题,并持续改进实验室的质量和能力。
总之,医学实验室质量和能力认可准则在临床微生物学检验领域的应用,旨在确保实验室的操作流程标准化、质量控制有效、人员能力高、设备可靠、数据管理完善,并持续改进实验室的质量和能力,以提供准确、可靠的检验结果,支持临床诊断和治疗。

CNAS-CL36:2012《医学实验室质量和能力认可准则在分子诊断领域的应用说明》(2014年第1次修订)(发布稿)医学实验室质量和能力认可准则在分子诊断领域的应用说明1 范围本文件规定了CNAS对分子诊断领域的认可要求,包括:病原体核酸和人体基因等领域涉及的核酸扩增试验、杂交试验(包括原位杂交试验)、核酸电泳分析等。
2 规范性引用文件下列文件对于本文件的应用是必不可少的。
凡是注日期的引用文件仅注日期的版本适用于本文件。
凡是不注日期的引用文件,其最新版本(包括修改单)适用于本文件。
GB/T 20468-2006 临床实验室定量测定室内质量控制指南CNAS-RL02 能力验证规则CNSA-CL31 内部校准要求临床技术操作规范·病理学分册,人民军医出版社,2004医疗机构临床基因扩增检验实验室工作导则病理科建设与管理指南(试行),卫办医政发〔2009〕31号3 术语和定义4 管理要求4.1 组织和管理责任4.1.1.2 实验室为独立法人单位的,应有医疗机构执业许可;实验室为非独立法人单位的,其所属医疗机构执业证书的诊疗科目中应有医学实验室,自获准执业之日起,开展分子诊断工作至少2年。
4.1.2.5应至少有1名具有副高及以上专业技术职务任职资格,从事分子诊断工作至少5年。
4.2 质量管理体系4.3 文件控制4.4 服务协议4.5 受委托实验室的检验4.6 外部服务和供应4.7 咨询服务4.8 投诉的解决4.9 不符合的识别和控制4.10 纠正措施4.11 预防措施4.12 持续改进4.13 记录控制4.14 评估和审核4.15 管理评审5 技术要求5.1 人员5.1.2 分子诊断实验室(以下简称实验室)负责人应至少具有中级专业技术职称、从事分子诊断工作至少3年。
分子诊断实验室操作人员应经过有资质的培训机构培训合格取得上岗证后方可上岗。
签发分子病理报告的医师应至少具有中级病理学专业技术职务任职资格,并有从事分子病理工作的经历。
CNAS-CL40:2012《医学实验室质量和能力认可准则在什么是CNAS-CL40准则?CNAS-CL40准则是指《医学实验室质量和能力认可准则》,它是由国家认可委员会(CNAS)制定的,旨在确保医学实验室的质量和能力达到国际标准。
它被认为是一项全面评估实验室质量管理和技术能力的规范性要求。
CNAS-CL40准则的主要内容CNAS-CL40准则包含了以下内容:管理要求医学实验室要建立质量管理体系,并按照其要求进行管理。
质量管理体系包括实验室设施的管理、人员的管理、设备的管理、试剂的管理、数据的管理以及文件的管理等。
技术要求医学实验室要能够进行各种常见和特殊的检验项目,并确保其结果准确可靠。
实验室需要有资质的技术人员、适当的设备和试剂。
报告要求医学实验室的报告必须符合相关法律法规和规范性文件的要求。
实验室需要建立标准的报告模板和流程,并保证报告的准确性、及时性和可追溯性。
审核和认证要求CNAS-CL40准则规定了医学实验室审核和认证的程序和要求。
医学实验室需要通过证书和标识来证明其质量和能力达到国际标准。
CNAS-CL40准则的作用CNAS-CL40准则的实施可以:提高医学实验室的质量和能力CNAS-CL40准则规范了医学实验室的管理、技术和报告等方面的要求,可以有效提高医学实验室的质量和能力。
提高医疗服务的水平医学实验室作为医疗服务的重要组成部分,其准确可靠的检验结果直接关系到医疗服务的质量和安全。
CNAS-CL40准则的实施可以提高医疗服务的水平,为病患提供优质服务。
促进国际贸易CNAS-CL40准则制定了国际标准的要求,医学实验室通过认证可以获得国际承认。
这可以促进医学实验室与国外供应商和客户的贸易往来,提高医学实验室在国际市场上的竞争力。
CNAS-CL40准则的应用医学实验室需要在满足CNAS-CL40准则的基础上,结合自身实际情况进行实施。
医学实验室可以按照CNAS-CL40准则的标准进行自评,也可以邀请第三方认证机构进行外部认证。
新通知|CNAS发布《医学实验室质量和能⼒认可准则在实验室信息系统的应⽤说明》等10份专业应⽤说明各有关医学实验室、评审员:根据亚太实验室认可合作组织(APLAC)国际同⾏评审要求,中国合格评定国家认可委员会(CNAS)对CNAS-CL35:2012《医学实验室质量和能⼒认可准则在实验室信息系统的应⽤说明》等10份应⽤说明进⾏了修订,于2015年11⽉11⽇发布, 2016年1⽉1⽇实施。
主要变化为增加了对5.2.3的说明,同时进⾏了⼀些编辑性修改。
⽂件清单如下:AS-CL35:2012《医学实验室质量和能⼒认可准则在实验室信息系统的应⽤说明》(第3次修订)AS-CL36:2012《医学实验室质量和能⼒认可准则在分⼦诊断检验领域的应⽤说明》(第3次修订)AS-CL37:2012《医学实验室质量和能⼒认可准则在组织病理学检查领域的应⽤说明》(第3次修订)AS-CL38:2012《医学实验室质量和能⼒认可准则在临床化学检验领域的应⽤说明》(第3次修订)AS-CL39:2012《医学实验室质量和能⼒认可准则在临床免疫学定性检验领域的应⽤说明》(第3次修订)AS-CL40:2012《医学实验室质量和能⼒认可准则在输⾎医学领域的应⽤说明》(第3次修订)AS-CL41:2012《医学实验室质量和能⼒认可准则在体液学检验领域的应⽤说明》(第3次修订)AS-CL42:2012《医学实验室质量和能⼒认可准则在临床微⽣物学检验领域的应⽤说明》(第3次修订)AS-CL43:2012《医学实验室质量和能⼒认可准则在临床⾎液学检验领域的应⽤说明》(第3次修订)10. CNAS-CL51:2014《医学实验室质量和能⼒认可准则在细胞病理学检查领域的应⽤说明》(第2次修订)上述⽂件可以从CNAS⽹站()“实验室认可”栏⽬下载。
如有疑问,可垂询CNAS认可四处。
认可四处联系⼈:胡冬梅电话:************,邮箱:*************.cn。
CNAS-CL29医学实验室质量和能力认可准则在临床生物化学检验领域的应用说明Guidance on the Application ofMedical Laboratory Quality and Competence Accreditation Criteria in the Field of Clinical Biochemistry中国合格评定国家认可委员会CNAS-CL29:2007第1页共7页医学实验室质量和能力认可准则在临床生物化学检验领域的应用说明一引言临床生物化学检验是中国合格评定国家认可委员会(英文缩写:CNAS)对医学实验室的认可领域之一。
本文件是CNAS根据临床生物化学检验的特性而对CNAS—CL02:2006《医学实验室质量和能力认可准则》所作的进一步说明,并未增加或减少该准则的要求。
本文件的条款编号同CNAS—CL02:2006《医学实验室质量和能力认可准则》的相应条款编号。
由于仅对需说明的条款进行了说明,故章节号是不连续的。
本文件应与CNAS—CL02:2006《医学实验室质量和能力认可准则》同时使用。
适用时,还应符合CNAS—RL05:2006《实验室生物安全认可规则》、CNAS—CL05:2006《实验室生物安全认可准则》以及国家法规和标准(如 GB19781:2005 医学实验室-安全要求)的要求。
二应用说明5 技术要求5.1 人员5.1.1 实验室应提供明确的组织结构图和所有人员的岗位描述。
5.1.3 实验室负责人至少应具有以下资格:a) 执业医师,医学实验室工作经历或培训2年以上;或b) 医学实验室相关专业高级技术职称;或c) 检验、生物化学、化学、生物科学等主修专业博士,医学实验室工作经历或培训2年以上;或d) 检验、生物化学、化学、生物科学等主修专业硕士,医学实验室工作经历或培训4年以上;或检验、生物化学、化学、生物科学等主修专业学士,医学实验室工作经历或培训8年以上。
CNAS-CL02医学实验室质量和能力认可准则Accreditation Criteria for the Quality and Competence of Medical Laboratories中国合格评定国家认可委员会CNAS-CL02:2012 第1 页共1 页前言本准则规定了中国合格评定国家认可委员会(英文缩写:CNAS)对医学实验室质量和能力进行认可的专用要求,包含了医学实验室为证明其按质量管理体系运行、具有相应技术能力并能提供正确的技术结果所必须满足的要求。
此外,我国对医学实验室的相关法律法规要求,医学实验室也须同时遵守。
医学实验室的服务对于患者的医疗很重要,因而应满足患者及负责患者医疗的临床人员的需求。
这些服务包括检验申请的安排,患者准备,患者识别,样品采集、运送和保存,临床样品的处理和检验以及后续的解释、报告及建议,此外,还包括医学实验室工作的安全和伦理方面的相关事项。
只要我国法律法规允许,鼓励医学实验室的服务能包含为咨询病例的患者进行检验,以及积极参与除诊断和患者服务之外的疾病预防,同时,也鼓励实验室为其专业工作人员提供适宜的教育和科研机会。
尽管本准则旨在用于目前公认的医学实验室服务所涉及的各类学科,但在临床生理学、医学影像学和医学物理学等其它服务和学科领域工作的人员,会发现本准则也是有用且适当的。
CNAS欢迎对医学实验室能力进行承认的各机构将本准则作为其工作的基础。
尽管本准则用于实验室认可(accreditation)而不意图用作认证(certification)目的,然而医学实验室符合本准则的要求即意味着满足持续发布技术上有效结果所必需的技术能力和管理体系要求。
本准则内容及条款号与国际标准ISO 15189:2012《医学实验室—质量和能力的要求》内容及条款号完全一致。
CNAS鼓励申请认可的机构购买和使用正版ISO标准及正版国家标准。
ISO 15189:2012及本准则均受到版权保护,未经恰当的授权禁止复制。