第四节 氨硝酸硫酸(1-3课时)
- 格式:ppt
- 大小:1.04 MB
- 文档页数:55


第四节氨硝酸硫酸氨气的泄漏事件2007年1月25日下午1点10分左右,大兴区正大大发熟食厂冷冻车间的氨气管道突然泄漏,外泄的液态氨瞬间挥发成白色气柱冲出来。
空气中弥漫着一股浓烈的刺激性气味,进入厂区呼吸都感到困难.厂区内寒气逼人。
刺鼻的味道也弥漫到了附近的林校路上。
…消防员利用喷雾水枪稀释空气中的氨,地上的水流已经结成了厚厚的一层冰。
上在的材料告诉我们些关于氨的什么性质?你能将它们一一找出来吗?一、氨1.氨的物理性质:氨是一种色、有气味的气体,密度比空气,溶于水,在常温下,1体积水大约可溶解体积氨气。
易液化(-33.5℃),液氨常作制冷剂。
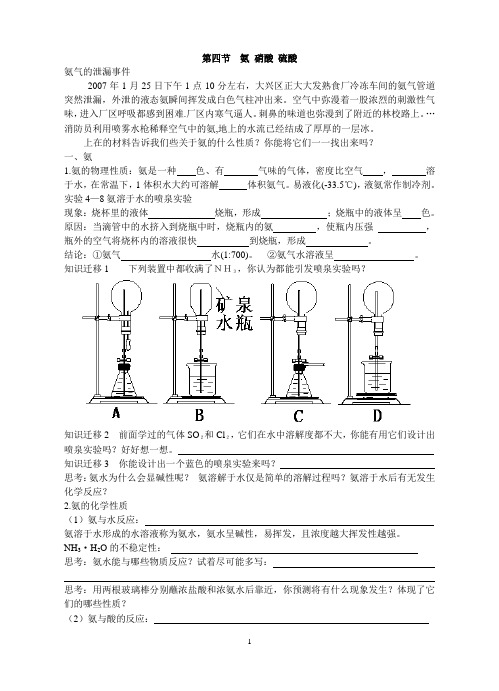
实验4—8氨溶于水的喷泉实验现象:烧杯里的液体烧瓶,形成;烧瓶中的液体呈色。
原因:当滴管中的水挤入到烧瓶中时,烧瓶内的氨,使瓶内压强,瓶外的空气将烧杯内的溶液很快到烧瓶,形成。
结论:①氨气水(1:700)。
②氨气水溶液呈。
知识迁移1 下列装置中都收满了NH3,你认为都能引发喷泉实验吗?知识迁移2 前面学过的气体SO2和Cl2,它们在水中溶解度都不大,你能有用它们设计出喷泉实验吗?好好想一想。
知识迁移3 你能设计出一个蓝色的喷泉实验来吗?思考:氨水为什么会显碱性呢?氨溶解于水仅是简单的溶解过程吗?氨溶于水后有无发生化学反应?2.氨的化学性质(1)氨与水反应:氨溶于水形成的水溶液称为氨水,氨水呈碱性,易挥发,且浓度越大挥发性越强。
NH3·H2O的不稳定性:思考:氨水能与哪些物质反应?试着尽可能多写:思考:用两根玻璃棒分别蘸浓盐酸和浓氨水后靠近,你预测将有什么现象发生?体现了它们的哪些性质?(2)氨与酸的反应:氨与酸反应生成铵盐。
铵盐又叫铵态氮肥。
思考:有一位农民看到自己买的一袋碳酸氢铵化肥受了潮,就在太阳底下晒,等他下午去取时,发现少了许多,是谁偷了他的氮肥?铵盐可以做氮肥体现了铵盐的什么物理性质?铵盐的性质①铵盐都易溶于水②铵盐受热易分解NH4HCO3受热:NH4Cl受热:③铵盐与碱反应(NH4)2SO4 + NaOH:实质:(离子方程式)NH4HCO3 + NaOH:实质:(离子方程式)一切铵盐的共同性质,实验室可利用这个性质来检验NH4+的存在。



第四节硫酸、硝酸和氨〔第一课时〕●教学目标一、知识与技能1.掌握浓硫酸的特性。
2.了解浓硫酸的重要用途,认识几种硫酸盐。
二、过程与方法培养学生的实验观察、分析思维能力。
三、情感、态度和价值观1.对学生进行“现象与本质〞“量变与质变〞等辩证唯物主义观点的教育2.通过实验研究,激发学生的学习兴趣,培养学生严谨求实、勇于创新的科学品质●教学重点浓硫酸的化学性质●教学难点浓硫酸的强氧化性●教学方法●教学设计写出此反响的化学方程式。
溶液褪色。
应该是二氧化硫。
Cu+2H2SO4(浓)=CuSO4+SO2↑+2H2O〔加热〕提问:苯实验的产物有毒气体,上述的实验装置有什么缺乏之处有无改进方法学生思考,提出意见。
投影:参考实验装置,让同学比较,评价。
要求:用双线桥法分析该反响,并指出氧化剂、复原剂、氧化产物、复原产物。
反响中浓H2SO4表现出什么性质铜是复原剂;浓硫酸是氧化剂。
浓H2SO4表现出氧化性和酸性。
提问:稀硫酸是否具有氧化性浓、稀硫酸的氧化性有什么不同启发学生从浓、稀硫酸的成分及与金属的反响分析。
比照、讨论出:稀硫酸也有氧化性。
但浓硫酸的氧化性是由于分子里的+6价硫引起的;稀硫酸的氧化性是由于它电离出的H+引起的。
H+的氧化性比+6价硫的弱。
【设问】浓硫酸是否也能氧化金属活动性顺序中氢以前的金属呢【投映图片】浓硫酸用铁皮桶盛装运输。
【设问】为什么浓硫酸能与铜反响,而放在铁桶中却没有反响呢【讲解】对,假设加热就会发生反响。
但是没加热就没发生反响吗不是的,这是由于浓硫酸具有强氧化性,它可使某些金属如铁、铝等外表“钝化〞。
解释“钝化〞现象。
【提问】浓硫酸与金属活动性顺序氢以前金属反响是否也生成氢气呢为什么推理并答复:能。
陷入沉思,猜想:没加热。
倾听,领悟,形成正确认识。
推理并答复:不能。
因为浓硫酸与金属反响是由于+6价硫引起的而不是H+。
板书:b. 氧化大多数金属↑+2H2O 归纳出:加热时,浓硫酸能与大多数金属反响,但都没有氢气生成;常温下,浓硫酸可使铁、铝等发生钝化。
高考总复习同步训练第四节氨硝酸硫酸整体设计从容说课本节课是典型的元素化合物知识,它是在初中有关硫酸的知识基础上更深入地学习有关硫酸的知识,硫酸是重要的基本化工产品之一,它既具有酸的通性,又有自身的特殊性。
初中主要学习了稀硫酸的一些性质,因此在这一节中主要侧重于学习浓硫酸的吸水性、脱水性以及氧化性。
对于这一节应该重视与初中的联系,本节通过“思考与交流”,应用初中化学知识了解硫酸、硝酸具有酸的通性,然后引出浓硫酸和硝酸的氧化性。
氨的性质主要学习氨的水溶性、氨水的碱性以及氨与酸的反应,同时也应该特别重视化学实验。
所以首先要做好有关知识的复习,让学生对稀硫酸的性质做到心中有数。
其次要做好实验,有条件的可在实验室中进行,在教师的指导下边讲边实验。
所以可按照复习7实验7观察7理解7练习掌握”的程序来处理。
硫酸、硝酸是硫、氮元素的最高价氧化物的水化物,是重要的含氧酸,氨是氮的氢化物。
非金属单质、氢化物、氧化物、含氧酸等构成某一非金属元素的知识体系。
在硫、氮元素的知识体系中,比较重要的是氧化物和含氧酸。
硫酸、硝酸既有酸的一些通性,又有它们自己的特性。
氨也有大多数非金属元素的氢化物所具有的性质,同时它又是水溶液呈碱性的唯一气体,而且是大家非常熟悉的物质。
因此,将它们归为一节进行学习。
硫酸、硝酸和氨是重要的基本化工产品。
掌握硫酸、硝酸和氨的性质,可以更好地认识它们在工农业生产和国防中的重要用途。
自然界中氮的循环具有一定的典型性。
因此,本节教科书选择浓硫酸、硝酸的氧化性,氨气的性质和制法,以及自然界中氮的循环为内容,目的是让学生了解这些重要化工产品的主要性质,了解氮的循环对生态平衡的作用。
本节内容编排有以下特点:1. 重视主干知识,建构知识结构。
知识结构由主干知识和基本知识构成,主干知识作支撑。
浓硫酸、硝酸的主干知识是强氧化性,它们能与绝大多数金属起反应,也能与一些非金属起反应,反应的特点是浓硫酸、硝酸中的硫、氮元素被还原,生成硫的氧化物和氮的氧化物。