物理化学第五章化学平衡小结【复习准备】
- 格式:doc
- 大小:176.50 KB
- 文档页数:12

高中化学平衡知识点总结归纳总结是学习过程中必不缺少的部分,那么化学平衡知识点有哪些呢?下面是由小编为大家整理的“高中化学平衡知识点总结”,仅供参考,欢迎大家阅读。
高中化学平衡知识点总结定义:化学平衡状态:一定条件下,当一个可逆反应进行到正逆反应速率相等时,更组成成分浓度不再改变,达到表面上静止的一种“平衡”,这就是这个反应所能达到的限度即化学平衡状态。
化学平衡的特征逆(研究前提是可逆反应);等(同一物质的正逆反应速率相等);动(动态平衡);定(各物质的浓度与质量分数恒定);变(条件改变,平衡发生变化)。
影响化学平衡移动的因素(一)浓度对化学平衡移动的影响(1)影响规律:在其他条件不变的情况下,增大反应物的浓度或减少生成物的浓度,都可以使平衡向正方向移动;增大生成物的浓度或减小反应物的浓度,都可以使平衡向逆方向移动(2)增加固体或纯液体的量,由于浓度不变,所以平衡不移动(3)在溶液中进行的反应,如果稀释溶液,反应物浓度减小,生成物浓度也减小,V正减小,V逆也减小,但是减小的程度不同,总的结果是化学平衡向反应方程式中化学计量数之和大的方向移动。
(二)温度对化学平衡移动的影响影响规律:在其他条件不变的情况下,温度升高会使化学平衡向着吸热反应方向移动,温度降低会使化学平衡向着放热反应方向移动。
(三)压强对化学平衡移动的影响影响规律:其他条件不变时,增大压强,会使平衡向着体积缩小方向移动;减小压强,会使平衡向着体积增大方向移动。
注意:(1)改变压强不能使无气态物质存在的化学平衡发生移动(2)气体减压或增压与溶液稀释或浓缩的化学平衡移动规律相似(四)催化剂对化学平衡的影响:由于使用催化剂对正反应速率和逆反应速率影响的程度是等同的,所以平衡不移动。
但是使用催化剂可以影响可逆反应达到平衡所需的_时间_。
(五)勒夏特列原理(平衡移动原理):如果改变影响平衡的条件之一(如温度,压强,浓度),平衡向着能够减弱这种改变的方向移动。

第四章 化学平衡核心内容: 恒T 、p 、W ˊ=0下,化学反应自发0,,><=∆∑='B B W p T G μν 平衡反向自发主要内容:化学反应△G 、K 的计算及过程方向的判断。
一、内容提要1、化学反应自发进行和达到平衡的条件自发0,,><=∆∑='B B W p T G μν 平衡反向自发其中,B ν为B 的化学计量数,对于产物B ν取正值,对于反应物B ν取负值。
2、理想气体化学反应的等温方程(分压的影响)和反应方向的具体判据θKQ RT pln= <0 自发 (Qp <θK ) =0 平衡 (Q p=θK )>0 反向自发(Qp >θK )式中:θθμνB B m r G ∑=∆为标准摩尔反应吉布斯函数变化,θK 为标准平衡常数,)ex p(RT G K mr θθ∆-==B p p eqB Bνθ)(∏=f(T)3、理想气体化学反应平衡常数的其他表示法及其相互关系除了标准平衡常数外,实际应用中常用经验平衡常数K P 、K C 、K n 、K y(1)K P :θK =∑∏=∏-BB B p p p p eq B BeqB B νθννθ)()()( θK =∑-B p K P νθ)( θK 仅是温度的函数,K P 也只与温度有关。
(2)K C :理想气体P B V=n B RT p B =RT c RT V n B B=θK =∑∏=∏=∏BB B B pRT c p RT c p p B B B B eqB B νθννθνθ)()()( KC 也只与温度有关 (3)K y :p B =py B K y 与温度和总压有关(4)K n :∑=BB BB n n pp =∑∑B npp K n νθ)(K n 与温度、总压和惰性气体有关。
综合以上各式得:θK =当∑=0B ν时,θK =K p =K c =K y =K n4、有纯凝聚态物质参加的理想气体反应的标准平衡常数若理想气体化学反应中有纯固态或纯液态参加时,由于常压下纯凝聚态物质的化学势可近似为标准态化学势,即)()(cd cd B B θμμ=(cd 表示凝聚态) 因此 P m r m r Q RT G G ln +∆=∆θ其中∑=∆ϑθμνB B m r G 即对参加反应的所有物质包括凝聚态物质求和。

化学平衡知识点总结我给你讲讲化学平衡这事儿。
化学平衡啊,就像是一场在微观世界里的拔河比赛,两边的队伍都有自己的力量。
我就这么瞅着那些分子、原子,它们在那反应容器里啊,乱哄哄的,可又有着自己的规矩。
我记得我刚开始学化学平衡的时候,那老师啊,戴着个厚厚的眼镜,镜片后面的眼睛总是瞪得大大的,像两颗铜铃。
他站在讲台上,拿着粉笔在黑板上“嘎吱嘎吱”地写着那些方程式,一边写还一边说:“都看好了啊,这化学平衡就像你们在操场上排队,两边的人数得差不多,要是一边人太多了,那就不平衡了。
”我当时就想啊,这分子原子又不是人,咋还排队呢?化学平衡有个概念叫可逆反应,这就像两个人在吵架,你一句我一句,谁也不服谁。
反应正向进行着,可同时啊,逆向也在偷偷进行。
比如说氮气和氢气合成氨这个反应,氮气和氢气就像两个急性子的小伙子,想凑到一块儿变成氨,可是氨呢,又像个不安分的小家伙,时不时地又想变回氮气和氢气。
这反应啊,就在这正反应和逆反应之间找平衡,就像在走钢丝一样,小心翼翼的。
平衡常数K可是个关键的东西,就像是这个反应的一个标准。
我当时算这个平衡常数啊,那脑袋都大了。
你看,那些物质的浓度在方程式里进进出出的,就像一群调皮的小鬼在捣乱。
我就跟同桌说:“这化学平衡咋这么麻烦呢?这平衡常数就像个密码,我怎么都解不开。
”同桌就笑我:“你就慢慢算呗,像数钱一样仔细点儿。
”我一听就来气了:“这能跟数钱比吗?数钱多开心,算这个我脑袋都快炸了。
”还有啊,影响化学平衡的因素那可不少。
温度、压强、浓度,这些就像是外界的干扰因素。
就像一群人在安静地做着自己的事儿,突然来了几个捣乱的。
温度升高或者降低,就像天气突然变热或者变冷,那些分子原子的活动就不一样了。
压强呢,就像有人在外面使劲儿推这个反应容器,里面的分子原子就得重新调整自己的位置。
浓度要是变了,那就像有新的队员加入或者有队员离开拔河比赛,两边的力量就不平衡了,反应就得向着重新平衡的方向进行。
我曾经做实验的时候,看到那些颜色变化啊,就像是在看一场魔术表演。


高中化学平衡的归纳总结高中化学平衡的归纳总结考点归纳:1. 化学反应速率:⑴. 化学反应速率的概念及表示方法:通过计算式:v =Δc /Δt来理解其概念:①化学反应速率与反应消耗的时间(Δt)和反应物浓度的变化(Δc)有关;②在同一反应中,用不同的物质来表示反应速率时,数值可以相同,也可以是不同的。
但这些数值所表示的都是同一个反应速率。
因此,表示反应速率时,必须说明用哪种物质作为标准。
用不同物质来表示的反应速率时,其比值一定等于化学反应方程式中的化学计量数之比。
如:化学反应mA(g) + nB(g) pC(g) + qD(g) 的:v(A)∶v(B)∶v(C)∶v(D) = m∶n∶p∶q③一般来说,化学反应速率随反应进行而逐渐减慢。
因此某一段时间内的化学反应速率,实际是这段时间内的平均速率,而不是瞬时速率。
⑵. 影响化学反应速率的因素:I. 决定因素(内因):反应物本身的性质。
Ⅱ. 条件因素(外因)(也是我们研究的对象):①. 浓度:其他条件不变时,增大反应物的浓度,可以增大活化分子总数,从而加快化学反应速率。
值得注意的是,固态物质和纯液态物质的浓度可视为常数;②. 压强:对于气体而言,压缩气体体积,可以增大浓度,从而使化学反应速率加快。
值得注意的是,如果增大气体压强时,不能改变反应气体的浓度,则不影响化学反应速率。
③. 温度:其他条件不变时,升高温度,能提高反应分子的能量,增加活化分子百分数,从而加快化学反应速率。
④. 催化剂:使用催化剂能等同地改变可逆反应的正、逆化学反应速率。
⑤. 其他因素。
如固体反应物的表面积(颗粒大小)、光、不同溶剂、超声波等。
2. 化学平衡:⑴. 化学平衡研究的对象:可逆反应。
⑵. 化学平衡的概念(略);⑶. 化学平衡的特征:动:动态平衡。
平衡时v正=v逆≠0等:v正=v逆定:条件一定,平衡混合物中各组分的百分含量一定(不是相等);变:条件改变,原平衡被破坏,发生移动,在新的条件下建立新的化学平衡。


“”建议收藏下载本文,以便随时学习!+ O22H O2HmA(g) + nB(g) pC(g) + qD(g)nB(g) pC(g)我去人也就有人!为UR扼腕入站内信不存在向你偶同意调剖沙mA(g) + nB(g) pc(g) + qD(g) + (【总结】增大反应物浓度或减小生成物浓度,化学平衡向正反应方向移动;减小反应物浓度或增大生成物浓度,化学平衡向逆反应方向移动。
增大压强,化学平衡向系数减小的方向移动;减小压强,平衡会向系数增大的方向移动。
升高温度,平衡向着吸热反应的方向移动;降低温度,平衡向放热反应的方向移动。
催化剂不改变平衡移动的方向移动。
平衡移动原理对所有的动态平衡都适用,如对后面将要学习的电离平衡,水解平衡也适用。
五、有关化学平衡的计算1、主要类型有:①求起始浓度、转化浓度、平衡浓度。
②求某反应物的转化率、平衡气体混合物中各成分的体积分数等。
2、化学平衡的计算模式—三段式法设a(mol·L-1)、b(mol·L-1)分别为A、B两物质的起始浓度,mx(mol·L-1)为反应物A的转化浓度,nx(mol·L-1)为反应物B的转化浓度,则mA(g) + nB(g) pC(g) + qD(g)c始(mol·L-1) a b 0 0Δc(mol·L-1)mx nx px qxC平(mol·L-1)a-mx b-nx px qx物质浓度的变化关系反应物:平衡浓度=起始浓度-转化浓度生成物:平衡浓度=起始浓度+转化浓度以上三种浓度中,只有转化浓度之比等于化学方程式中计量数之比六化学平衡常数1.概念:对于一定条件下的可逆反应(aA+bB cC+dD),达到化学平衡时,生成物浓度的乘幂的乘积与反应物浓度的乘幂的乘积之比为一常数,记作Kc,称为化学平衡常数(浓度平衡常数)。
2.平衡常数的意义平衡常数的大小反映了化学反应进行的程度(也叫反应的限度)。

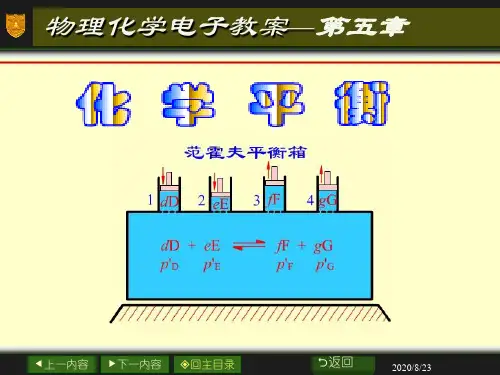
物理化学平衡教案【篇一:物理化学lesson17-18 化学平衡】第五章化学平衡5.1-5.3 复习及补充没有达到平衡的化学反应,在一定条件下均有向一定方向(平衡状态)进行的趋势,随着反应的进行,过程推动力逐渐减小,最后下降为零,这是反应达到最大限度,反应系统的组成不再改变,于是达到化学平衡状态。
这表明反应总是向着平衡状态变化,达到化学平衡状态,反应就达到了限度。
因此,只要找出一定条件下的化学平衡状态,求出平衡组成,那么化学反应的方向和限度问题就解决了。
化学平衡指动态平衡;反应并没有停止;正反应速率等于逆反应速率一、复习1) 化学反应的等温方程以及标准平衡常数; 2) 摩尔反应吉布斯函数与化学反应亲和势判断。
恒压及非体积功为零时化学反应进行的推动力。
5)a 0化学反应能自发进行a = 0产物及反应物处于平衡状态a 0不可能自发进行且其逆反应会自发进行下真实气体、液态混合物及液态溶液中的化学反应。
b转化率。
平衡时反应物转化成产物的百分数。
二、补充5.2,p164理想气体反应平衡常数的不同表示方法1) 平衡常数的表示形式有多种,上节课介绍的标准平衡常数没有量纲,而平衡常数有时具有一定的量纲。
k?=(pl/p?)l(pm/p?)m/(pa/p?)a(pb/p?)b=?(pb/p?) ? b (1) 式中?b表示参加反应各物质的计量数,对于,上式可化为压力无关。
2) 由于理想气体的分压与系统压力有下列关系:pb=pxb xb为各物质平衡时的物质的量分数。
注意:kp 、kx是气相反应的经验平衡常数。
3) xb=nb/n总,nb为各物质平衡时的物质的量。
将此式代入(5)式可得:【讲解】式中由于物质的量nb与pb 、xb不同,不具有浓度的内涵,因此,kn不是平衡常4) kp 、kx、kn与标准平衡常数的关系:k?=kp = kx = kn 5.4 温度对标准平衡常数的影响化学平衡是在一定条件下的相对平衡,一旦该平衡条件改变,平衡就要发生移动。

第四章化学平衡核心内容: 恒T、p、Wˊ=0下,化学反应自发平衡反向自发主要内容:化学反应△G、K得计算及过程方向得判断。
一、内容提要1、化学反应自发进行与达到平衡得条件自发平衡反向自发其中,为B得化学计量数,对于产物取正值,对于反应物取负值。
2、理想气体化学反应得等温方程(分压得影响)与反应方向得具体判据<0 自发(Qp<)=0 平衡(Q p=)>0 反向自发(Qp>)式中:为标准摩尔反应吉布斯函数变化,为标准平衡常数,==f(T)3、理想气体化学反应平衡常数得其她表示法及其相互关系除了标准平衡常数外,实际应用中常用经验平衡常数K P 、K C、K n、K y(1)K P:==仅就是温度得函数,K P也只与温度有关。
(2)K C:理想气体P B V=n B RT p B==K C也只与温度有关(3)K y:p B=py BK y与温度与总压有关(4)K n:=K n与温度、总压与惰性气体有关。
综合以上各式得:=当时,=K p=K c=K y=K n4、有纯凝聚态物质参加得理想气体反应得标准平衡常数若理想气体化学反应中有纯固态或纯液态参加时,由于常压下纯凝聚态物质得化学势可近似为标准态化学势,即(cd表示凝聚态)因此其中即对参加反应得所有物质包括凝聚态物质求与。
即只考虑气相组分得平衡分压。
5、真实气体化学反应得标准平衡常数真实气体得化学势表达式为,代入可得:为组分B在指定条件下得逸度,,为B得逸度因子,它就是温度与总压得函数,也就是温度与压力得函数,对于理想气体=1 。
6、液态混合物或溶液得化学平衡常数对于液态混合物(或溶液)中得化学反应,由于任一组分得化学势为,代入可得:若反应系统为理想液态混合物或理想稀溶液,则=1,7、标准摩尔吉布斯函数变得计算方法由于,因此由可求得。
得计算主要有以下三种方法:①由计算:②计算③由相关反应计算8、化学反应得等压方程(温度得影响)上式就是范特霍夫方程得微分式,由此式可进行以下讨论:若,即吸热反应,,说明标准平衡常数随温度升高而增大,平衡右移,有利于反应正向进行。

化学平衡基础知识 三、化学平衡 1、可逆反应⑴定义:在同一条件下,既能向正反应方向进行,同时又能向逆反应方向进行的反应叫做可逆反应。
用“”代替“==”。
⑵可逆反应中所谓的正反应、逆反应是相对的,一般把向右进行的反应叫做正反应,向左进行的反应叫做逆反应。
⑶在不同条件下能向两个方向进行的反应不叫可逆反应。
如:2H 2 + O 22H 2O ;2H 2O2H 2↑+ O 2↑⑷可逆反应不能进行到底,在一定条件下只能进行到一定程度后达到平衡状态。
2、化学反应的限度⑴化学反应的限度就是研究可逆反应在一定条件下所能达到的最大限度。
⑵反应的转化率 反应物的转化率:α=%100 该反应物起始量反应物的转化量3、化学平衡⑴化学平衡状态:在一定条件下的可逆反应里,正反应速率和逆反应速率相等,反应物和生成物的浓度保持不变的状态,叫做化学平衡状态,简称化学平衡。
①化学平衡的微观标志(即本质):v 正=v 逆②化学平衡的宏观标志:反应混合物中各组分的浓度和体积分数保持不变,即随时间的变化,保持不变。
③可逆反应无论从正反应开始,还是从逆反应开始,或正、逆反应同时开始,都能达到化学平衡。
⑵化学平衡的特征①逆:化学平衡研究的对象是可逆反应。
②动:化学平衡是动态平衡,反应处于平衡态时,化学反应仍在进行,反应并没有停止。
③等:化学反应处于化学平衡状态时,正反应速率等于逆反应速率,且都不等于零。
④定:化学反应处于化学平衡状态时,反应混合物中各组分的浓度保持一定,体积分数保持一定。
对反应物,有一定的转化率,对生成物,有一定的产率。
⑤变:化学平衡是有条件的平衡,当外界条件变化,原有的化学平衡被破坏,在新的条件下,平衡发生移动,最终又会建立新的化学平衡。
四、判断可逆反应达到平衡的标志 以可逆反应mA(g) + nB(g) pC(g) + qD(g)为例 1、直接标志 ⑴v 正=v 逆。
具体可以是:①A 、B 、C 、D 中任一种在单位时间内的生成个数等于反应掉的个数。
第四章 化学平衡核心内容: 恒T 、p 、W ˊ=0下,化学反应自发0,,><=∆∑='B B W p T G μν平衡 反向自发主要内容:化学反应△G、K的计算及过程方向的判断。
一、内容提要1、化学反应自发进行与达到平衡的条件自发0,,><=∆∑='B B W p T G μν 平衡反向自发其中,B ν为B 的化学计量数,对于产物B ν取正值,对于反应物B ν取负值。
2、理想气体化学反应的等温方程(分压的影响)与反应方向的具体判据P m r m r Q RT G G ln +∆=∆θθp Q RT K RT ln ln +-=θθK Q RT pln= <0 自发 (Q p<θK )=0 平衡 (Q p=θK ) >0 反向自发(Qp>θK )式中:θθμνB B m r G ∑=∆为标准摩尔反应吉布斯函数变化,θK 为标准平衡常数,)ex p(RT G K mr θθ∆-==B p p eqB Bνθ)(∏=f(T)3、理想气体化学反应平衡常数的其她表示法及其相互关系除了标准平衡常数外,实际应用中常用经验平衡常数KP 、K C 、K n 、K y(1)K P :θK =∑∏=∏-BB B p p p p eq B BeqB B νθννθ)()()(θK =∑-B p K P νθ)( θK 仅就是温度的函数,K P 也只与温度有关。
(2)KC :理想气体PB V=n B RT pB=RT c RT Vn B B= θK =∑∏=∏=∏BB B B pRT c p RT c p p B B B B eqB B νθννθνθ)()()( ∑=BpRT K K C νθθ)( KC 也只与温度有关(3)K y:p B=py B=θK∑∏=∏=∏B BB B pp y p y p p p B B B B eqB B νθννθνθ)()()( ∑=Bpp K K y νθθ)(总K y 与温度与总压有关(4)K n :∑=BB BB n n pp =θK BB BB BeqB Bn npp pp ννθυθ)()()(∑∏=∏=∑∑B npp K n νθ)(K n 与温度、总压与惰性气体有关。