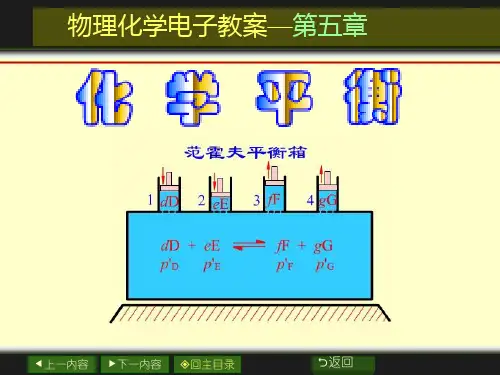
物理化学第五章化学平衡kj
- 格式:ppt
- 大小:932.50 KB
- 文档页数:81
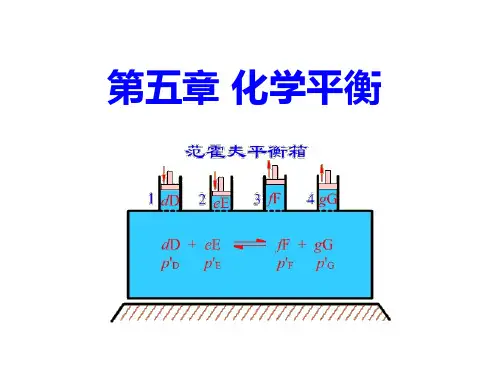

第五章 化学平衡一.基本要求1.掌握化学反应等温式的各种形式,并会用来判断反应的方向和限度。
2.了解标准平衡常数的定义,掌握标准平衡常数的各种表示形式和计算方法。
3.掌握标准平衡常数K 与r m G ∆在数值上的联系,熟练用热力学方法计算r m G ∆,从而获得标准平衡常数的数值。
4.了解标准摩尔生成Gibbs 自由能f m G ∆的定义和它的应用。
5.掌握温度对化学平衡的影响,记住van ’t Hoff 公式及其应用。
6.了解压力和惰性气体对化学平衡的影响。
二.把握学习要点的建议把本章放在多组分系统之后的目的,就是要利用多组分系统中介绍的化学势的概念和各种表示方式,来导出化学反应等温式,从而用来判断化学反应的方向与限度。
本章又用到了反应进度的概念,不过其值处在0 1 mol -的区间之内。
因为在利用化学势的表示式来计算反应的Gibbs 自由能的变化值时,是将化学势看作为一个定值,也就是在有限的反应系统中,化学进度为d ξ,如果在一个很大的系统中, 1 mol ξ=。
严格讲,标准平衡常数应该用绝对活度来定义,由于本教材没有介绍绝对活度的概念,所以利用标准态化学势来对标准平衡常数下定义,其含义是一样的。
从标准平衡常数的定义式可知,标准平衡常数与标准化学势一样,都仅是温度的函数,因为压力已指定为标准压力。
对于液相反应系统,标准平衡常数有其相应的形式。
对于复相化学反应,因为纯的凝聚态物质本身就作为标准态,它的化学势就是标准态化学势,已经归入r m G ∆中,所以在计算标准平衡常数时,只与气体物质的压力有关。
学习化学平衡的主要目的是如何判断反应的方向和限度,知道如何计算平衡常数,了解温度、压力和惰性气体对平衡的影响,能找到一个经济合理的反应条件,为科研和工业生产服务。
而不要过多地去考虑各种浓度表示式和各种平衡常数表示式之间的换算,否则会把自己搞糊涂了,反而没抓住主要内容。
由于标准平衡常数与r m G ∆在数值上有联系,r m ln p G RT K ∆=-,所以有了r m G ∆的值,就可以计算p K 的值。

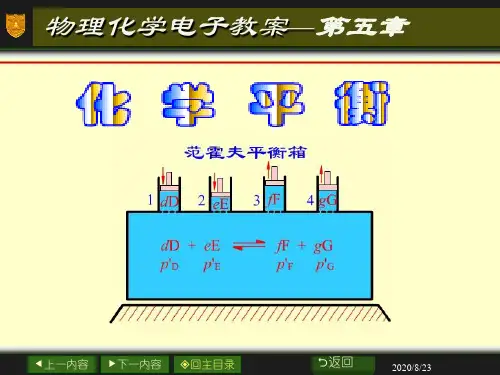



第五章 化学平衡没有达到平衡的化学反应,在一定条件下均有向一定方向进行的趋势,即该类反应过程均有一定的推动力。
随着反应的进行,推动力逐渐减小,最后下降为零,这时反应达到最大限度,反应系统的组成不再改变,于是达到化学平衡状态。
这表明反应总是向着平衡状态变化,达到化学平衡状态,反应就达到了限度。
§5.1化学反应的方向及平衡条件对于一任意化学反应B B0B ν=∑,随反应的进行,各组分的物质的量及系统的吉布斯函数都发生变化,在恒定T ,P ,/0W =时有B BBdG dnμ=∑将反应进度BB dn d ξν=代入上式,整理得,()T P B B r m BGG νμξ∂==∆∂∑ 根据恒温恒压条件下的吉布斯函数判据可有: 若,0r m G ∆<即,()0T P G ξ∂<∂,反应正向进行,反应物自发生成产物; 若0r m G ∆>,即,()0T P G ξ∂>∂,反应不能自发正向进行; 若0r m G ∆=,即,()0T P Gξ∂=∂,反应达平衡。
化学反应亲和势A 定义为: ,()r m T P GA G ξ∂=-∆=-∂ A 是状态函数,体系的强度性质。
用A 判断化学反应的方向具有“势”的性质,即:A >0 反应正向进行; A <0 反应逆向进行; A =0 反应达平衡。
§5.1理想气体反应的等温方程及标准平衡常数1. 理想气体反应的等温方程对于恒温恒压理想气体化学反应,将*()()ln p pg g RT p μμ=+代入关系式r m B B BG νμ∆=∑得ln()B Br m B B B B BBBP G RT P νμνμνΘΘ∆==+∑∑∑式中BBBνμΘ∑为各反应组分均处在标准态时,每摩尔反应进度的吉布斯函数变,称标准摩尔反应吉布斯函数,用m r G Θ∆表示。
r m BBBG νμΘΘ∆=∑ 令()()()()()By zY Z BP a bABP P P P P J PP P PPνΘΘΘΘΘ==∏ 称为压力商则理想气体反应的等温方程:ln r m r m P G G RT J Θ∆=∆+2.理想气体反应的标准平衡常数当反应达到平衡ln 0P eqr m r m G G RT J Θ∆=∆+=即ln P eqr m G RT J Θ∆=-式中P eqJ 为反应的平衡压力商,以K表示,并称之为标准平衡常数。