(完整版)化学速率平衡图像专题练习题
- 格式:doc
- 大小:556.51 KB
- 文档页数:5

化学平衡图像一、选择题(本题包括35小题,每小题2分,共70分。
每小题有一个或两个选项符合题意。
)1.一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如右图所示,下列描述正确的是()A.反应开始到10s,用Z表示的反应速率为0.158mol/(L·s)B.反应开始时10s,X的物质的量浓度减少了0.79mol/LC.反应开始时10s,Y的转化率为79.0%D.反应的化学方程式为:X(g)+Y(g)Z(g)2.T℃时,A气体与B气体反应生成C气体。
反应过程中A、B、C浓度变化如图(Ⅰ)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示,则下列结论正确的是()A.在(t1+10)min时,保持其他条件不变,增大压强,平衡向逆反应方向移动B.t1+10)min时,保持容器总压强不变,通入稀有气体,平衡向逆反应方向移动C.T℃时,在相同容器中,若由0.3mol·L—1 A 0.1 mol·L—1 B和0.4 mol·L—1 C反应,达到平衡后,C的浓度仍为0.4 mol·L—1D.其他条件不变,升高温度,正、逆反应速率均增大,且A的转化率增大3.已知可逆反应aA+bB cC中,物质的含量A%和C%随温度的变化曲线如图所示,下列说法正确的是()A.该反应在T1、T3温度时达到过化学平衡B.该反应在T2温度时达到过化学平衡C.该反应的逆反应是放热反应D.升高温度,平衡会向正反应方向移动4.右图表示反应N 2(g)+3H2(g)2NH3(g);ΔH=-92.2kJ/mol。
在某段时间t0~t6中反应速率与反应过程的曲线图,则氨的百分含量最高的一段时间是()A.t0~t1B. t2~t3C. t3~t4D. t5~t65.反应过程中A(g)、B(g)、C(g)物质的量变化如图所示,根据图中所示判断下列说法正确的是()A .10~15 min 可能是加入了正催化剂B .10~15 min 可能是降低了温度C .20 min 时可能是缩小了容器体积D .20 min 时可能是增加了B 的量6.在一定条件下,将X 和Y 两种物质按不同的比例放入密闭容器中反应,平衡后测得X ,Y 的转化率与起始时两物质的物质的量之比n x /n y 的关系如图所示,则X ,Y 的反应方程式可表示为( )A . 2X +Y 3ZB . 3X +2Y 2ZC . X +3Y ZD . 3X +Y Z7.可逆反应aX (g )+bY (g )cZ (g )在一定温度下的一密闭容器内达到平衡后,t 0时改变某一外界条件,化学反应速率(v )-时间(t )图象如右图。


化学反应速率和化学平衡图像题专练题组一速率—时间图像1. 在密闭容器中进行反应:2SO2(g)+O2(g)2SO3(g)(正反应放热),如图是某次实验的化学反应速率随时间变化的图像,推断在t1时刻突然改变的条件可能是( )A.催化剂失效B.减小生成物的浓度C.降低体系温度D.增大容器的体积答案 C解析从图像可以看出:改变条件后,反应速率与原平衡速率出现断点且低于原平衡反应速率,说明改变的条件可能是降低温度或减压。
从改变条件后的v′正与v′逆的大小关系,可得出化学平衡正向移动。
降低温度,该平衡正向移动,必有v′正>v′逆,故选C。
2.向一容积不变的密闭容器中充入H2和I2,发生反应H2(g)+I2(g)2HI(g)ΔH<0,当达平衡后,t0时若保持混合气体总物质的量不变而改变某一反应条件,使平衡移动(如图所示),下列说法正确的是( )A.容器内气体颜色变深,平均相对分子质量不变B.平衡不移动,混合气体密度增大C.H2转化率增大,HI平衡浓度减小D.t0时改变的条件为减小体积或升高体系温度答案 A解析条件改变后,正、逆反应速率均增大,但是逆反应速率大于正反应速率,平衡逆向移动,改变的条件应为升高温度,A项正确。
题组二时间—浓度(物质的量)图像3.已知X(g)和Y(g)可以相互转化:2X(g)Y(g) ΔH<0。
现将一定量X(g)和Y(g)的混合气体通入一体积为1L的恒温密闭容器中,反应物及生成物的浓度随时间变化的关系如图所示。
则下列说法不正确的是( )A.若混合气体的压强不变,则说明反应已达化学平衡状态B.a、b、c、d四个点表示的反应体系中,表示化学反应处于平衡状态的只有b点C.25~30min内用X表示的平均化学反应速率是0.08mol·L-1·min-1D.反应进行至25min时,曲线发生变化的原因是增加Y的浓度答案 D解析正反应是气体分子数减小的反应,所以当压强不再发生变化时,可以说明反应已经达到平衡状态,A项正确;根据图像可知,只有b 点表示的反应体系中,各物质的浓度不再发生变化,所以只有b点表示反应处于平衡状态,B项正确;25~30min内X的浓度变化量是0.4mol·L-1,所以用X表示的平均化学反应速率是0.4mol·L-15min=0.08mol·L-1·min-1,C项正确;反应进行至25min时,X物质的浓度增大,D项不正确。

第二章化学反应速率与化学平衡专题强化练2化学反应速率与化学平衡图像1.(2024浙江台州路桥中学月考)已知:A(g)+2B(g) 3C(g)ΔH<0,向一恒温恒容的密闭容器中充入1 mol A和2 mol B发生反应,t1 min 时达到平衡状态Ⅰ,在t2 min时改变某一条件,t3 min时达到平衡状态Ⅱ,正反应速率随时间的变化如图所示。
下列说法正确的是()A.t2 min时改变的条件:向容器中加入AB.平衡时B的体积分数φ:φ(Ⅱ)=φ(Ⅰ)C.t2~t3 min时平衡正向移动D.平衡时A(g)的物质的量浓度c:c(Ⅰ)>c(Ⅱ)2.(2023黑龙江哈尔滨九中月考)将一定量硫化氢气体加入密闭容器中,发生反应:2H2S(g) S2(g)+2H2(g),该反应的平衡常数的负对数(-lg K)随温度(T)的变化曲线如图所示。
下列说法错误的是()A.该反应的ΔH>0B.C点对应状态的平衡常数K=10-3.638 0C.反应速率:v A>v CD.30 ℃时,B点对应状态的v正>v逆3.(2024安徽合肥168中学月考)CO2合成乙烯的反应原理为2CO2(g)+6H2(g) C2H4(g)+4H2O(g)ΔH,往恒压密闭容器中按n(CO2)∶n(H2)=1∶3充入气体,在常压和催化剂作用下进行反应,测得温度对CO2平衡转化率和催化剂催化效率影响情况如图所示。
下列说法不正确的是()A.该反应ΔH<0,平衡常数:K M>K NB.反应速率有可能是v(M)>v(N)C.其他条件相同,温度越低,反应一定时间后CO2的转化率越高D.若投料比改为n(CO2)∶n(H2)=1∶4,可提高CO2的平衡转化率4.(2024河北承德月考)已知反应:2H2(g)+CO(g) CH3OH(g)。
一定条件下,在容积恒定的密闭容器中充入1 mol CO和2 mol H2,在催化剂作用下发生上述反应,CO的平衡转化率与温度、压强的关系如图所示。

第27讲 化学反应速率、平衡图像(模拟精练+真题演练)完卷时间:50分钟可能用到的相对原子质量:H 1 C 12 O 16 S 32 Cl35.5 Cu 64 Ba137 一、选择题(每小题只有一个正确选项,共12×5分)1.(2023·江苏南通·海门中学校考模拟预测)飞机在平流层飞行时,尾气中的NO 会破坏臭氧层。
如何有效消除NO 成为环保领域的重要课题。
某研究小组用新型催化剂对CO 、NO 催化转化进行研究,测得一段时间内NO 的转化率、CO 剩余的百分率随温度变化情况如图所示。
已知NO 可发生下列反应: 反应I :()()()()222CO g 2NO g 2CO g N g ++1ΔH反应Ⅱ:()()()222NO g N g O g +2ΔH下列叙述不.正确的是A .10∆<H ,2H 0∆<B .温度大于775K 时,催化剂活性降低C .()()NO 1CO n n =时,控制温度875K 已可较好的去除NOD .775K ,()()NO 1CO n n =时,不考虑其他反应,该时刻()()22CO :N 3:2n n ≈2.(2023·江苏盐城·盐城市伍佑中学校考模拟预测)利用2H 和CO 反应生成4CH 的过程中主要涉及的反应如下:反应Ⅱ ()()()()242CO g 3H g CH g H O g +=+ 1Δ206.2H =- kJ ⋅mol -1 反应Ⅱ ()()()()222CO g H O g CO g H g +=+ 2Δ41.2H =- kJ ⋅mol -1[4CH 的产率()()4CH 100%CO n n ⨯,4CH 的选择性()()()424%n +CH 100CO C n H n ⨯生成生成生成]。
保持温度一定,在固定容积的密闭容器中进行上述反应,平衡时4CH 和2CO 的产率及CO 和2H 的转化率随()()2n H n CO 的变化情况如图所示。
30化学速率与平衡图像专项练习一、选择题1、如图是温度和压强对X+Y2Z反应影响的示意图.图中横坐标表示温度,纵坐标表示平衡混合气体中Z 的体积分数.下列叙述正确的是( )A .上述可逆反应的正反应为放热反应B .X、Y 、Z 均为气态 C .X 和Y 中只有一种为气态,Z 为气态D .上述反应的逆反应的△H>0 2、一定温度下,在2 L 的密闭容器中,X 、Y 、Z 三种气体的物质的量随时间 变化的曲线如图所示.下列描述正确的是( )A .反应从开始到10 s 时,用Z 表示的反应速率为0.158 mol·L -1·s -1B .反应从开始到10 s 时,X 的物质的量浓度减少了0.79 mol ·L -1C .反应从开始到10 s 时,Y 的转化率为79%D .反应的化学方程式为:X(g)+Y(g) Z(g)3、[双选题] 对于一个气态反应体系,如图所示,表示的是反应速率和时间的关系,其中t 1达到平衡,t 2~t 3是改变条件后出现的情况,则该条件可能是( ) A .加压 B .增大反应物浓度C .减压 D .加入催化剂4、工业合成氨的正反应是放热反应,下列关于N 2(g)+3H 2(g) 2NH 3(g)反应的图象中,错误的是( )5、下列各图中能表示A(g)+B(g) 2C(g)(正反应为放热反应)这个可逆反应的图像为( )二、非选择题:6、科学家一直致力于“人工固氮”的新方法研究。
目前合成氨技术原理为:N 2(g)+3H 2(g) 2NH 3(g) △H=-92.2 kJ ·mol -1。
(1)673 K ,30 MPa 下,上述合成氨反应中n(NH 3)和n(H 2)随时间变化的关系如图所示.下列叙述正确的是 。
A .点a 的正反应速率比点b 的大 B .点c 处反应达到平衡 C .点d 和点e 处的n(N 2)相同D .773 K ,30 MPa 下,t 2时刻也是该反应的平衡点,则n(NH 3)比图中e 点的值大(2)在容积为2.0 L 恒容的密闭容器中充人0.80 mol N 2(g)和1.60 mol H 2(g),反应在673 K 、30 MPa 下进行,达到平衡时,NH3的体积分数为20%。
化学平衡和速率图像1.速率-时间(v-t )图像方法:A. 首先分清图像的“突变”和“渐变”,出现渐变的为改变浓度。
如下图甲乙甲图中v 正突然变大、v 逆在t1渐变,可见改变的为增加反应物的浓度。
乙图中v 正突然变小、v 逆在t1渐变,可见改变的为减少反应物的浓度。
B.如果图像都为突变,则改变的可能是温度、压强、催化剂等,以及同时改变反应物和生成物的浓度。
这类图像要先看速率,再看平衡。
首先分析速率较之前的大小变化,如果变大,为增大温度、增大压强、加催化剂,再分析此时v 正、v 逆的相对大小,如果v 正>v 逆,表示平衡正向移动,再从上述条件里选择使平衡正向移动的条件。
例1,N 2+ 3H 22NH 3,△H<0建立平衡后加热对速率的影响如图1。
123图1υ图2如图1所示,t 2时刻后,图像突变,速率较之前都变大,为升温、升压、加催化剂,又因为v 逆>v 正,平衡逆向移动,上述可以使此反应逆向移动的为升温。
如图2所示,t 2时刻后,图像突变,速率较之前都变大,为升温、升压、加催化剂,又因为v 正>v 逆,平衡正向移动,上述可以使此反应正向移动的为升压。
如图3所示,t2时刻后,图像突变,速率较之前都变小,为降温降压,又因为v 逆>v 正,平衡逆向移动,上述可以使此反应逆向移动的为降温。
图3练习1.下列图像为反应H 2(g)+I 2(g)2HI(g);△H>0 的速率-时间图像,分析下列三个图像改变的条件图1中,t2时刻后,图像突变,速率较之前都变大,为升温、升压、加催化剂,又因为v 正>v逆,平衡正向移动,上述可以使此反应正向移动的为升温。
图2中,t1时刻后,图像渐变,v逆突然变小,V正渐渐变小,为减少生成物即HI的浓度。
图3中,t0时刻后,图像突变,速率都变大,为升温、升压、加催化剂,又因为v正=v逆,平衡不移动,根据此反应,为升压或者加催化剂。
练习2一密封体系中发生下列反应:N+3H2 2NH3 +Q,下图是某一时间段中反应速率2与反应进程的曲线关系图:回答下列问题:(1)处于平衡状态的时间段是______.(2)t1、t3、t4时刻体系中分别是什么条件发生了变化?、、(3)下列各时间段时,氨的百分含量最高的是______.A.t0~t1B.t2~t3C.t3~t4D.t5~t6【答案】(1)t0~t1、t2~t4、t5~t6(2)升高温度,加了催化剂,降低压强(3)t0~t1练习3一定温度下可逆反应aX(g)+bY(g)cZ(g)在一密闭容器内达到平衡后,t0时刻改变某一外界条件,化学反应速率()随时间(t)变化如图所示。
化学反应速率与平衡的图像专题✧一、速率-时间图像:1、在密闭容器中充入SO2(g)和O2(g),发生可逆反应2SO2(g)+O2(g) 2 SO3(g) △H<0,当反应达到平衡后,只改变下列各条件时,填入相应速率随时间的变化图像的编号。
(1)加入催化剂(2)升温(3)增大体积(4)增大氧气浓度【应用】2、右图表示反应N2(g)+3H2(g)2NH3(g);ΔH=-92.2kJ/mol。
在时间t0~t6中反应速率与反应过程的曲线图,则各时间段的变化不正确的是( )A t1~t2升温B t2~t3加压C t3~t4加催化剂D t4~t5减压3、反应A(g)+B(g)2C (g)+D(s)达到平衡状态时,只改变某一条件时,正、逆反应速率随时间的变化如图2所示,则所改变的条件可能是A. 升高温度B. 增大D的用量C. 使用正催化剂D. 增大压强✧二、浓度(或物质的量或气体体积)-时间图像:4、在密闭容器中,充入一定量A气体和B气体,反应中各物质的浓度随时间的变化情况如图1:(1)根据图像,写出反应方程式(2)A的平衡转化率为____________【应用】5、[2012福建]一定条件下,溶液的酸碱性对TiO2光催化燃料R降解反应的影响如右图所示。
下列判断正确的是( ) A.在0-50min之间,pH=2和pH=7时R的降解百分率相等B.溶液酸性越强,R的降解速率越小C.R的起始浓度越小,降解速率越大D.在20-25min之间,pH=10时R的平均降解速率为0.04 mol·L—1·min—1CABt/min图10.51.51.02.0c(mol/L)V正V逆V'正=V'逆V正V逆V正V逆V'逆V'正V'正V'逆V'逆V'正V正V逆V正V逆V'正=V'逆V图2三、反应物转化率(或百分含量或浓度)—时间—温度(或压强)图像:6.对于反应mA(g)+nB(g) pC(g)+qD(g)(1)T1___T2 正反应____热(2)P1___P2 m+n__p+q(3)T1___T2 正反应____热(4)P1___P2 m+n___p+q【解题方法】7、(双选)【2011新课标改编】在容积为2L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变的情况下,考察温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300℃);下列说法正确的是()A. 温度为T1时,从反应开始到平衡,生成甲醇的平均速率为:v(CH3OH)=n A/t A mol·L-1·min-1B. 该反应在T1时的平衡常数比T2时的小C. 该反应为放热反应D. 处于A点的反应体系从T1变到T2,达到平衡时n(H2)/n(CH3OH)增大四、反应物转化率(或百分含量或浓度)-温度-压强图像:8、对于反应mA(g)+nB(g) pC(g)+qD(g)(1)△H 0 m+n___p+q (2) m+n___p+q △H 0【解题方法】9、【2011年山东】CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)CH3OH(g)。
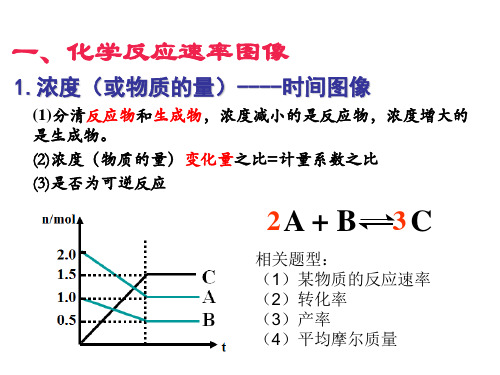
化学反应速率、化学平衡图像
一、ν-t图像或c-t图像
1. ν-t图像:分清正逆反应,分清各因素(浓度、温度、压强、催化剂)对反应速率和平衡移
动的影响。
【练习1】对于反应2SO 2(g)+O2(g) 2SO3(g) △H<0,填写改变的条件及平衡移动的方向。
t1时,,
平衡向移动。
t2时,,
平衡向移动。
t3时,,
平衡向移动。
t4时,,
平衡向移动。
小结:改变条件,图像一点保持连续;改变,两点突变,_____________使正逆反应速率同等程度的增大而平衡不移动。
【练习2】对达到平衡状态的可逆反应X+Y Z+W,在其他
条件不变的情况下,增大压强,反应速率变化如右图所示,
则图像中关于X、Y、Z、W四种物质的聚集状态为( )
A.Z、W均为气体,X、Y中有一种是气体
B.Z、W中有一种是气体,X、Y皆非气体
C.X、Y、Z、W皆非气体
D.X、Y均为气体,Z、W中有一种为气体
【练习3】在密闭容器,一定条件下进行反应,
mA(g)+nB(g) pC(g)+qD(g),若增大压强或升高温度,
重新达到平衡,变化过程均如右图所示,则对该反应叙述正确
的是( )
A.正反应是吸热反应B.逆反应是吸热反应
C.m+n>p+q D.m+n<p+q
【练习4】应N2(g)+3H2(g) 2NH3(g) △H<0 在某
一时间段中反应速率与反应过程的曲线关系如图,则
图中氨的百分含量最低的时间段是( ) ,氨的百
分含量最高的时间段是( )
A.t0-t1
B.t2-t3
C.t3-t4
D. t5-t6
2. c-t图像:分清反应物和生成物,浓度减小的为反应物,浓度增大的为生成物,分清消耗
浓度和增加浓度,反应物的消耗浓度和生成物的增加浓度之比,等于化学方程
式中各物质的化学计量数之比。
【练习5】今有X(g)+Y(g) 2Z(g) △H<0。
从反应
开始经过t1后达到平衡状态,t2时由于条件改变,平衡
受到破坏,在t3时又达到平衡,引起t2→t3曲线变化的
原因是( )
A.增大X或Y的浓度B.增大压强
C.增大Z的浓度D.升高温度
【练习6】右图表示800℃时A、B、C三种气体物质的浓度随时间的
变化情况,t1是到达平衡状态的时间。
试回答:
(1)该反应的反应物是______;
(2)反应物的转化率是______;
(3)该反应的化学方程式为___________________________。
二、平衡图像
1.出现拐点的图像:分析依据“先拐先平”。
在转化率-时间图像或物质的百分含量-时间
图像中,先出现拐点的曲线先达到平衡(代表温度高或压强大或使用合适的催化剂)。
【练习7】已知某可逆反应在密闭容器中进行:
A(g)+2B(g) 3C(g)+D(s) △H<0,图中曲线b代表一定条件
下该反应的过程,若使曲线b变为曲线a,可采取的措施是( )
A.增大A的浓度B.缩小容器的容积
C.加入催化剂D.升高温度
【练习8】现有可逆反应A(g)+2B(g) nC(g) △H<0,在相同
温度、不同压强时,A的转化率跟反应时间(t)的关系如右图,
其中结论正确的是( )
A.p1>p2,n>3 B.p1<p2,n>3
C.p1<p2,n<3 D.p1>p2,n=3
【练习9】对于可逆反应A(g)+B(g)C(g) △H<0,下列图像正确的是()
【练习10】可逆反应:aA(g)+ bB(g)cC(g)+ dD(g)
根据图回答:
①压强P1比P2(填大或小);
②(a +b)比(c +d)(填大或小);
③温度t1℃比t2℃(填高或低);
④正反应热(填吸或放)。
【练习11】在密闭容器中进行下列反应:
M(g) + N(g) R(g) + 2L,此反应符合右图,下列叙
述正确的是( )
A.正反应吸热,L是气体
B.正反应吸热,L是固体
C.正反应放热,L是气体
D.正反应放热,L是固体或液体
【练习12】等质量的两份锌粉a和b,分别加入过量的稀硫酸中,a中同时加入少量CuSO4溶液,下列各图中表示其产生氢气的总体积(V)与时间的关系正确的是( )
2.受两个变量(P、T)影响的图像:分析依据“定一议二”。
转化率或百分含量等因素受到
压强、温度两个变量的影响,先确定一个变量,分析另外两个量的关系。
如
确定温度分析转化率受压强的影响。
【练习13】可逆反应2A+B2C(g) △H<0,随温度变化气体平
均相对分子质量如图所示,则下列叙述正确的是( )
A.A和B可能都是固体B.A和B一定都是气体
C.若B为固体,则A一定是气体
D.A和B可能都是气体
【练习14】反应L(s)+aG(g) bR(g)达到平衡时,温度和压
强对该反应的影响如图所示。
图中,压强p1>p2,x轴表示
温度,y轴表示平衡混合气中G的体积分数。
据此可判断( )
A.上述反应是放热反应
B.上述反应是吸热反应
C. a>b D. a<b
【练习15】某可逆反应L(s) + G(g) 3R(g) ΔH>0,右图表
示外界条件温度压强的变化对上述反应的影响。
试判断图中
Y轴可以表示( )
A.平衡混合气中R的质量分数
B.达到平衡时G的转化率
C.平衡混合气中G的质量分数
D.达到平衡时L的转化率
【练习16】反应mA(s) + nB(g) eC(g) + fD(g)反应过程中,当其它条件不变时,C的百分含量(C%)和压强(P)的关系如图,下列叙述正确的是()
A.达到平衡后,加入催化剂,则C%增大
B.达到平衡后,若升温,平衡左移
C.化学方程式中n>e +f
D.达到平衡后,增加A的量有利于平衡右移
【练习17】如图所示,可逆反应:2A(g)+B(g) 2C(g) △H<0
的图像正确的是()
【练习18】对于可逆反应,A2(g)+3B2(g) 2AB3(g)△H<0,下列图像不正确的是()
【练习19】在其它条件一定时,图中曲线表示反应
2NO(g)+ O2(g) 2NO2(g) △H>0达平衡时NO的转化率
与温度的关系,图上标有A、B、C、D、E点,其中表示未达
平衡状态且V正>V逆的点是( )
A.A或E B.B点
C.C点D.D点
【练习20】反应A2+B22AB在不同条件下,产物AB百分含
量随时间变化关系如图所示,a为500℃,b为300℃时情
况,c为300℃时从时间t3开始向容器中加压的情况,则下
列叙述正确的是( )
A.A2、B2、AB均为气体,正反应放热
B.AB为气体,A2、B2中最少有一种为非气体,正反应放热
C.AB为气体,A2、B2中最少有一种为非气体,正反应吸热
D.AB为固体,A2、B2中最少有一种为非气体,正反应吸热
【练习21】两种气态单质按下列反应
X2(g) + Y2(g) 2XY(g),X2与Y2按一定比例混合,在不同温
度下经一定时间反应,混合物中X2的体积分数变化如图所示,试确
定该反应是吸热反应还是放热反应
化学反应速率、化学平衡图像参考答案
练习题
1.增大反应物的浓度;正向;降低温度;正向;增大压强;正向;使用催化剂
小结:浓度;温度或压强;使用催化剂
2.A
3.BD
4.D;A
5.D
6.(1)A(2)40%(3)2A B+3C
7.BC 8.B 9.B 10.小、小、高、吸
11.C 12.A 13.CD 14.BD 15.C 16.BC 17.A 18.AC 19.C 20.B 21.放热反应。