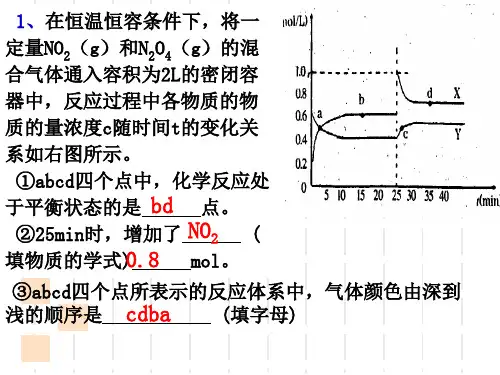
课堂评价
1.判断正误(正确的打“√”,错误的打“×”)。
在密闭容器中,反应2X(g)+Y2(g) ⇌2XY(g) ΔH<0达到甲平衡状态。在仅改变 某一条件后,达到乙平衡状态:
(1)图Ⅰ中t时刻改变的反应条件可能是降低反应
的温度。 ( ×)
(2)图Ⅰ中平衡正向移动,化学平衡常数K一定增大。
( ×)
大小关系为T2 > T1。 ②T1→T2时改变温度的方式是 升高温度 ,生成物 图2-2-10 百分含量C%变小,说明 升高温度 平衡向 逆反应方向 移动,故知该反应的 正反应是 放热 反应。
新课探究
Ⅱ.据B图可知
①因“先拐先平”,p1时反应达到平衡所用时间短,则p1时反应速率大,故p1与p2
表示的压强大小关系为p1 > p2。 ②p1→p2时压强改变方式是 减小压强 , 反应物转化率α变大,说明 减小压强 平衡
则a+b < c。 Ⅱ.在压强一定时(如p3),温度升高,C% 增大 , 化学平衡 正向 移动,正反应是 吸热 反应。
图2-2-11
新课探究
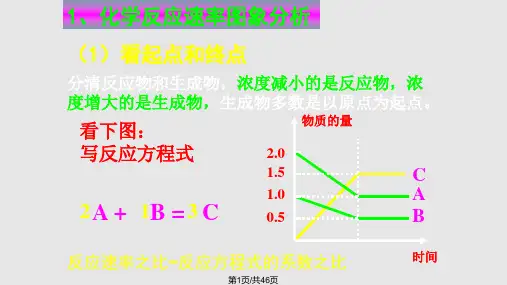
2.化学平衡图像题的解题流程 一看面(纵、横坐标的意义) 二看线(线的走向和变化趋势)
看图像 三看点(起点、拐点、终点) 四看辅助线(如等温线、等压线、平衡线) 五看量的变化(如浓度变化、温度变化)
(√)
图2-2-14
(5)图Ⅱ中,平衡状态甲与乙相比,甲的反应物转化率低。 × ( )
课堂评价
2.分别在V L密闭容器中加入等物质的量的A和B 气体,发生2A(g)+B(g) ⇌2C(g),测得不同温度下,A 的转化率随时间变化关系如图2-2-15。下列判定 正确的是( A )
A.T2>T1 ΔH<0 B.T2<T1 ΔH<0 C.T2>T1 ΔH>0 D.T2<T1 ΔH>0