化学平衡的移动图像专题
- 格式:ppt
- 大小:1.11 MB
- 文档页数:25




高二化学平衡移动图像问题专项训练题一、单选题1.在不同条件下进行化学反应2A(g) B(g) + D(g), B、 D起始浓度均为0,反应物A的浓度-1序号0 20 40 50①800 1.0 0.67 0.50 0.50②800 x 0.50 0.50 0.50③800 y 0.75 0.60 0.60④820 1.0 0.25 0.20 0.20下列说法不正确的是( )A.①中B在0~20min平均反应速率为8.25x10-3mo1·L-1min-1B.②中K=0.25,可能使用了催化剂C.③中Y=1.4mo1·L-1D.比较①、④可知,该反应为吸热反应2.烯气相直接水合反应制备乙醇:C2H4(g)+H2O(g)C2H5OH(g)。
乙烯的平衡转化率随温度、压强的变化关系如下(起始时,n(H2O)=n(C2H4)=1 mol,容器体积为1L)。
下列分析不正确的是( )A.乙烯气相直接水合反应的ΔH<0B.图中压强的大小关系为:p1>p2>p3C.图中a点对应的平衡常数K=5/16D.达到平衡状态a、b所需要的时间:a>b3.升高温度,下列各项的值可能减小的是( )A.化学反应速率vB.NaCl的溶解度SC.化学平衡常数KD.弱酸的电离平衡常数K a4.在恒容密闭容器中进行反应:2CO2(g)+6H2(g)C2H5OH(g)+3H2O(g) ΔΗ在某压强下起始时按不同氢碳比[n(H2)/n(CO2)]投料(见图中曲线①②③ ),测得CO2的平衡转化率与温度的关系如图所示,下列有关说法正确的是( )A.该反应的ΔΗ>0B.氢碳比:① <② <③C.其他条件不变的情况下,增大容器的体积可提高CO 2的转化率D.若起始时CO 2浓度为2mol·L -1,H 2浓度为4mol·L -1,在图中曲线③ 氢碳比条件下进行反应,则400K 时该反应的平衡常数数值约为1.75.在某容积一定的密闭容器中,有下列可逆反应:()()()A g +B g xC g H 僔未知,有图Ⅰ所示的反应曲线,试判断对图Ⅱ的说法中正确的是(T 表示温度,P 表示压强,C%表示C 的体积分数( )A. 34P >P ,y 轴表示C 的转化率B. 34P <P ,y 轴表示B 的体积分数C. 34P <P ,y 轴表示混合气体的密度D. 34P >P ,y 轴表示混合气体的平均摩尔质量6.在一恒温、恒容密闭容器中发生反应:()()()()50~804180~200Ni s +4CO g Ni CO g ,H<0垐垐垎V 噲垐垐℃℃利用该反应可以将粗镍转化为纯度达99.9%的高纯镍.对该反应的说法正确的是( ) A. 增加Ni 的量可提高CO 的转化率,Ni 的转化率降低℃ B. 缩小容器容积,平衡右移,H V 减小C. 反应达到平衡后,充入CO 再次达到平衡时,CO 的体积分数降低D. 当()()44v Ni CO =v CO ⎡⎤⎣⎦正正时或容器中混合气体密度不变时,都可说明反应已达化学平衡状态7.以下自发反应可以用熵判据来解释的是( ) A. ()()()222N g +2O g ==2NO g H=+67.7kJ/mol VB. ()()()23CaO s +CO g ==CaCO s H=-175.5kJ/mol VC. ()()()()434332NH CO s ==NH HCO s +NH g H=+74.9kJ/mol VD. ()()()2222H g +O g ==2H O l H=-285.8kJ/mol V 8.工业上以CH 4为原料制备H 2的原理为CH 4(g)+H 2O(g)4CO(g)+3H 2(g) ΔΗ>0。

or personal use only in study and research; not for commercial use化学平衡图像专题解题思路:一看轴(纵、横坐标的意义),二看线(线的走向和变化趋势),三看点(起点、折点、交点、终点、零点的意义),四看要不要作辅助线(等温线、等压线、平衡线),五看量的变化(如浓度变化、温度变化等),六想规律(外界条件对反应速率的影响规律和化学平衡移动规律)1. 速率-时间图1. 对于达平衡的可逆反应X+Y W+Z,增大压强则正、逆反应速度(v)的变化如上图,分析可知X,Y,Z,W的聚集状态可能是()。
(A)Z,W为气体,X,Y中之一为气体(B)Z,W中之一为气体,X,Y为非气体(C)X,Y,Z皆为气体,W为非气体(D)X,Y为气体,Z,W中之一为气体2. 在一定条件下,反应A(g)+B(g)C(g)(正反应为放热反应)达到平衡后,根据下列图象判断A. B. C. D.E.(1)升温,达到新的平衡的是( )(2)降压,达到新的平衡的是( )(3)减少C的量,移向新平衡的是( )(4)增加A的量,移向新平衡的是( )(5)使用催化剂,达到平衡的是( ) 2. 浓度(物质的量)-时间图3. 在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如右图,下列表述中正确的是()A.反应的化学方程式为:2 M NB.t2时,正逆反应速率相等,达到平衡C.t3时,正反应速率大于逆反应速率 D.t1时,N的是M浓度的2倍3. 含量-时间-温度(压强)图4. 可逆反应m A(s)+n B(g ) e C(g)+f D(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如下图:下列叙述正确的是()。
(A)达平衡后,加入催化剂则C%增大(B)达平衡后,若升温,平衡左移(C)化学方程式中n>e+f(D)达平衡后,增加A的量有利于平衡向右移动5. 在密闭容器中进行下列反应:M(g)+N(g )R(g)+2L此反应符合下面图像,下列叙述是正确的是()(A) 正反应吸热,L是气体(B) 正反应吸热,L是固体(C) 正反应放热,L是气体(D) 正反应放热,L是固体或液体6. 可逆反应m A(s) + n B(g) p C(g) + q D(g)反应过程中,当其它条件不变时,C的质量分数与温度(T)和压强(P)的关系如图(T2>T1),根据图中曲线分析,判断下列叙述中正确的是()(A)到达平衡后,若使用催化剂,C的质量分数增大(B)平衡后,若升高温度,平衡则向逆反应方向移动(C)平衡后,增大A的量,有利于平衡向正反应方向移动(D)化学方程式中一定n>p+q7. 现有可逆反应A(气)+B(气)3C(气),下图中甲、乙、丙分别表示在不同的条件下,生成物C在反应混和物中的百分含量(C%)和反应时间的关系:(1)若甲图中两条曲线分别表示有催化剂和无催化剂时的情况,则__ _曲线是表示有催化剂时的情况。



1 / 4§2.3化学平衡(第三课时)化学平衡移动的图像专题训练一、化学平衡图像题的分析方法与思路 1.化学平衡图像题的主要特点:该类题目的主要特点是通过多种图像,对化学反应速率和化学平衡的有关知识、 规律进行分析考察,题目特别注重对知识综合应用能力和分析判断能力的考查。
2.解题的方法及思路(1)看懂图像:一看 面(图像形状,横、纵坐标的含义),二看线(走向,变化趋势),三看点(起点、终点、交点、拐点),四看是否需作辅助线(等温线、等压线、平衡线等),五看量的变化(浓度的变化,温度变化) (2)联想规律:外界条件的改变对化学反应速率和化学平衡移动的影响规律。
(3)作出判断:根据图像中表现的关系与所学规律相对比,做出符合题目要求的判断。
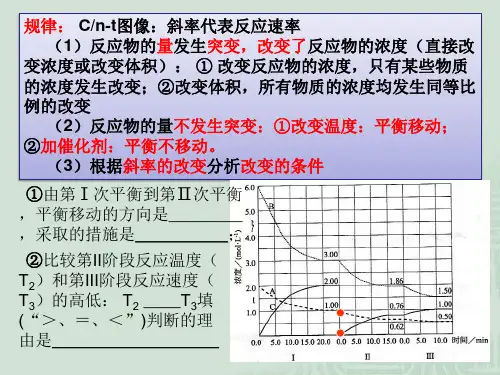
3.解化学平衡图像题的原则:“先拐先平衡,数值大”原则:含量与时间变化关系的图像中,先出现拐点的则先到达平衡,说明该曲线表示的温度较大或压强较高。
a A(g)+bB(g) cC(g)图1图2在图1中,P1P2 ,a+b c (填“<”“>”) 在图2中T1T2,正反应为反应(吸热或放热)(2)“定一议二”原则:在含量与温度、压强变化图像中,先确定一个量不变,再讨论另外两个量的关系。
即定温看压强或定压看温度变化,由曲线的高低走势,结合平衡移动原理和指定的可逆反应,确定平衡的移动方向,反应的热效应,反应两边气体体积的大小等。
mA(g)+nB(g) qC(g)+qD (g )图3 图4图3中正反应为反应,m+n p+q ;图4中,正反应为反应,m+n p+q 。
二、图像的常见类型:1.物质的量(或浓度)———时间图象:例1:某温度下,在体积为5L的容器中,A、B、C三种物质物质的量随着时 间变化的关系如所示,则该反应的化学方程式为,2s内用A的浓度变化和用B的浓度变化表示的平均反应速率分别为_________、 _________。
2.速率-时间图:【例2】对于mA(g)+nB(g) pC(g)+qD(g),能引起如图5平衡移动的因素可能是: 能引起如图6平衡移动的因素可能是:【例3】把除去氧化膜的镁条投入到盛有少量稀盐酸的试管中,发现氢气发生的速率变化情况如图2所示,其中t1~t2速率变化的主要原因是 ;t2~t3速率变化的主要原因是。
