高中化学09化学平衡图像专题
- 格式:docx
- 大小:819.94 KB
- 文档页数:27



or personal use only in study and research; not for commercial use化学平衡图像专题解题思路:一看轴(纵、横坐标的意义),二看线(线的走向和变化趋势),三看点(起点、折点、交点、终点、零点的意义),四看要不要作辅助线(等温线、等压线、平衡线),五看量的变化(如浓度变化、温度变化等),六想规律(外界条件对反应速率的影响规律和化学平衡移动规律)1. 速率-时间图1. 对于达平衡的可逆反应X+Y W+Z,增大压强则正、逆反应速度(v)的变化如上图,分析可知X,Y,Z,W的聚集状态可能是()。
(A)Z,W为气体,X,Y中之一为气体(B)Z,W中之一为气体,X,Y为非气体(C)X,Y,Z皆为气体,W为非气体(D)X,Y为气体,Z,W中之一为气体2. 在一定条件下,反应A(g)+B(g)C(g)(正反应为放热反应)达到平衡后,根据下列图象判断A. B. C. D.E.(1)升温,达到新的平衡的是( )(2)降压,达到新的平衡的是( )(3)减少C的量,移向新平衡的是( )(4)增加A的量,移向新平衡的是( )(5)使用催化剂,达到平衡的是( ) 2. 浓度(物质的量)-时间图3. 在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如右图,下列表述中正确的是()A.反应的化学方程式为:2 M NB.t2时,正逆反应速率相等,达到平衡C.t3时,正反应速率大于逆反应速率 D.t1时,N的是M浓度的2倍3. 含量-时间-温度(压强)图4. 可逆反应m A(s)+n B(g ) e C(g)+f D(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如下图:下列叙述正确的是()。
(A)达平衡后,加入催化剂则C%增大(B)达平衡后,若升温,平衡左移(C)化学方程式中n>e+f(D)达平衡后,增加A的量有利于平衡向右移动5. 在密闭容器中进行下列反应:M(g)+N(g )R(g)+2L此反应符合下面图像,下列叙述是正确的是()(A) 正反应吸热,L是气体(B) 正反应吸热,L是固体(C) 正反应放热,L是气体(D) 正反应放热,L是固体或液体6. 可逆反应m A(s) + n B(g) p C(g) + q D(g)反应过程中,当其它条件不变时,C的质量分数与温度(T)和压强(P)的关系如图(T2>T1),根据图中曲线分析,判断下列叙述中正确的是()(A)到达平衡后,若使用催化剂,C的质量分数增大(B)平衡后,若升高温度,平衡则向逆反应方向移动(C)平衡后,增大A的量,有利于平衡向正反应方向移动(D)化学方程式中一定n>p+q7. 现有可逆反应A(气)+B(气)3C(气),下图中甲、乙、丙分别表示在不同的条件下,生成物C在反应混和物中的百分含量(C%)和反应时间的关系:(1)若甲图中两条曲线分别表示有催化剂和无催化剂时的情况,则__ _曲线是表示有催化剂时的情况。

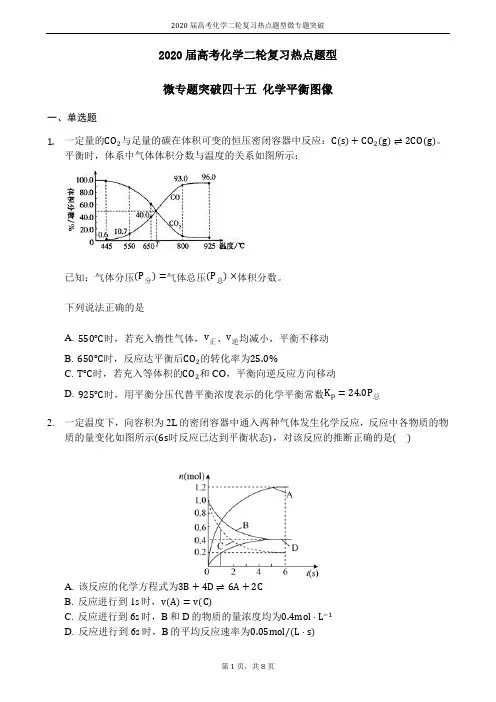
2020届高考化学二轮复习热点题型微专题突破2020届高考化学二轮复习热点题型微专题突破四十五化学平衡图像一、单选题1.一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)⇌2CO(g)。
平衡时,体系中气体体积分数与温度的关系如图所示:已知:气体分压(P分)=气体总压(P总)×体积分数。
下列说法正确的是A. 550℃时,若充入惰性气体,v正、v逆均减小,平衡不移动B. 650℃时,反应达平衡后CO2的转化率为25.0%C. T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动D. 925℃时,用平衡分压代替平衡浓度表示的化学平衡常数K p=24.0P总2.一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示(6s时反应已达到平衡状态),对该反应的推断正确的是()A. 该反应的化学方程式为3B+4D⇌6A+2CB. 反应进行到1s时,v(A)=v(C)C. 反应进行到6s时,B和D的物质的量浓度均为0.4mol⋅L−1D. 反应进行到6s时,B的平均反应速率为0.05mol/(L⋅s)3.在一定条件下,使10mol SO3在体积固定为2L的密闭容器中发生反应:2SO2(g)+O2(g)⇌2SO3(g),则下图中正确的是(M表示混合气体的平均相对分子质量)()A. B.C. D.4.如图所示的各图中,表示2A(g)+B(g)⇌2C(g)(△H<0)这个可逆反应的正确图象为(注:Φ(C)表示C的质量分数,P表示气体压强,C表示浓度)()A. B.C. D.5.下列叙述与图象对应符合的是()A. 对于达到平衡状态的N2(g)+3H2(g)⇌2NH3(g)在t0时刻充入了一定量的NH3,平衡逆向移动B. 对于反应2A(g)+B(g)⇌C(g)+D(g)△H<0,p2>p1,T1>T2C. 该图象表示的化学方程式为:2A=B+3CD. 对于反应2X(g)+3Y(g)⇌2Z(g)△H<0,y可以表示Y的百分含量6.在密闭容器中,反应X2(g)+Y2(g)⇌2XY(g)△H<0达到甲平衡,仅改变某一条件后,达到乙平衡.对此过程的分析正确的是()A. 可能是减小了反应物的浓度,反应物X2转化率一定减小B. 可能是加入了催化剂,反应物X2百分含量(X2%)将增大2020届高考化学二轮复习热点题型微专题突破C. 可能是缩小了容器的体积,但该反应的平衡常数保持不变D. 可能是升高了温度,该反应的平衡常数一定减小7.反应:2X (g)+Y(g)⇌2Z(g)在不同温度和压强下的产物Z的物质的量和反应时间t的关系如下图所示,下列判断正确的是()A. P1>P2T1>T2△H<0B. P1>P2T1<T2△H<0C. P1<P2T1>T2△H>0D. P1<P2T1<T2△H>08.在一个固定容积的密闭容器中,可发生以下反应:A(g)+B(g)⇌xC(g)△H=?,符合图(a)所示的关系,其中w(C)为C的质量分数,由此推断关于图(b)的说法正确的是()A. P3>P4,y轴表示A的转化率B. P3<P4,y轴表示B的体积分数C. P3<P4,y轴表示混合气体的平均相对分子质量D. P3>P4,y轴表示混合气体的密度9.图中表示2NO(g)+O2(g)⇌2NO2(g)△H<0,能正确反映该可逆反应变化的图象是()A. B.C. D.10.某化学研究小组探究外界条件对化学反应mA(g)+n(B)(g)⇌pC(g)的速率和平衡的影响图像如下,下列判断正确的是()A. 由图1可知,T1<T2,该反应正反应为吸热反应B. 由图2可知,该反应m+n<pC. 图3中,表示反应速率v(正)>v(逆)的是点3D. 图4中,若m+n=p,则a曲线一定使用了催化剂11.在容积可变的密闭容器中存在如下反应:CO(g)+H2O(g)⇌CO2(g)+H2(g)ΔH<0下列分析中正确的是()A. 图Ⅱ研究的只是t0时使用催化剂对反应速率的影响B. 图Ⅰ研究的是t0时缩小容器体积对反应速率的影响C. 图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较高D. 图Ⅲ研究的是催化剂对化学平衡的影响,且甲使用了催化剂12.某密闭容器中发生如下反应:2X(g)+Y(g)⇌Z(g);△H<0如图表示该反应的速率(v)随时间(t)变化的关系图,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的用量.则下列说法中不正确的是()A. t3时降低了压强B. t5时提高了温度C. t1−t2时该反应的平衡常数小于t6时反应的平衡常数D. t6时刻后反应物的转化率最低二、填空题13.汽车尾气里含有的NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:N2(g)+O2(g)⇌2NO(g)△H>0,已知该反应在240℃,平衡常数K=64×10−4.请回答:(3)将N2、O2的混合气体充入恒温恒容密闭容器中,如图变化趋势正确的是______(填字2020届高考化学二轮复习热点题型微专题突破母序号).14.元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4−(绿色)、Cr2O72−(橙红色)、CrO42−(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:(2)CrO42−和Cr2O72−在溶液中可相互转化。




高考化学专题复习《化学平衡图像》在高考化学中,化学平衡图像是一个重要的考点,也是同学们学习的难点之一。
掌握化学平衡图像的分析方法,对于理解化学平衡的概念、原理以及解决相关问题具有至关重要的意义。
一、化学平衡图像的常见类型1、浓度时间图像这类图像通常以时间为横坐标,反应物或生成物的浓度为纵坐标。
通过观察浓度随时间的变化趋势,可以判断反应的进行方向、反应速率的快慢以及是否达到平衡状态。
2、速率时间图像以时间为横坐标,反应速率为纵坐标。
图像中曲线的斜率表示反应速率的大小。
如果正反应速率和逆反应速率相等,即曲线斜率相等且不再变化,说明反应达到平衡。
3、含量时间温度(压强)图像这类图像一般有三个变量,横坐标为时间,纵坐标为反应物或生成物的含量,同时通过不同的曲线表示在不同温度或压强下的变化情况。
4、恒温(恒压)线图像在恒温或恒压条件下,以反应物或生成物的浓度(或分压)为横坐标,以另一种物质的浓度(或分压)为纵坐标绘制的曲线。
二、化学平衡图像的分析方法1、看面即看清图像中横坐标和纵坐标所表示的物理量。
明确是哪种类型的图像,是浓度、速率、含量还是其他。
2、看线观察曲线的走势,是上升、下降还是保持水平。
曲线的斜率大小反映了反应速率的快慢。
3、看点图像中的特殊点往往蕴含着重要的信息。
比如起点、终点、转折点、交点等。
(1)起点:可以判断反应的初始状态,反应物和生成物的浓度或物质的量。
(2)转折点:通常表示反应达到平衡的时刻或者条件发生改变的时刻。
(3)交点:在多个曲线的交点处,往往表示不同条件下某种物质的浓度或含量相等。
4、联系化学原理将图像所反映的信息与化学平衡的原理相结合,分析反应的方向、限度、条件对平衡的影响等。
三、具体实例分析例 1:浓度时间图像在一个密闭容器中发生反应:A(g) + 2B(g) ⇌ 2C(g),其浓度时间图像如下:画出简单的浓度时间图像从图像中可以看出,A、B 的浓度逐渐减小,C 的浓度逐渐增大。

化学平衡图像专题(超详细版)化学平衡是化学反应中一个非常重要的概念,它描述了在封闭系统中,反应物和物之间的动态平衡状态。
在化学平衡状态下,反应物和物的浓度保持不变,尽管反应仍在进行。
为了更好地理解和应用化学平衡原理,我们可以通过图像来直观地展示和解释这一概念。
一、化学平衡图像概述1. 反应物和物浓度随时间变化的曲线图2. 反应速率随时间变化的曲线图3. 平衡常数与温度、压力等条件的关系图二、反应物和物浓度随时间变化的曲线图在化学平衡图像中,反应物和物浓度随时间变化的曲线图是最常见的一种。
这种图像可以清晰地展示出反应物和物在反应过程中的浓度变化趋势,以及它们何时达到平衡状态。
1. 反应物浓度随时间变化的曲线图:在反应初期,反应物浓度较高,随着反应的进行,反应物浓度逐渐降低。
当反应达到平衡状态时,反应物浓度不再变化,形成一条水平直线。
2. 物浓度随时间变化的曲线图:在反应初期,物浓度较低,随着反应的进行,物浓度逐渐升高。
当反应达到平衡状态时,物浓度不再变化,形成一条水平直线。
3. 反应物和物浓度随时间变化的曲线图:将反应物和物浓度随时间变化的曲线图叠加在一起,可以更直观地展示它们之间的浓度关系。
在平衡状态下,两条曲线会相交,形成一个平衡点。
三、反应速率随时间变化的曲线图反应速率随时间变化的曲线图可以展示出反应速率在反应过程中的变化趋势,以及它如何受到反应物浓度、温度、压力等条件的影响。
1. 反应速率随时间变化的曲线图:在反应初期,反应速率较快,随着反应的进行,反应速率逐渐降低。
当反应达到平衡状态时,反应速率不再变化,形成一条水平直线。
2. 反应速率与反应物浓度的关系图:反应速率通常与反应物浓度成正比,即反应物浓度越高,反应速率越快。
当反应物浓度达到一定值时,反应速率达到最大值,不再随反应物浓度变化。
3. 反应速率与温度的关系图:反应速率通常与温度成正比,即温度越高,反应速率越快。
这是因为温度升高,反应物分子运动加快,碰撞频率增加,从而提高反应速率。
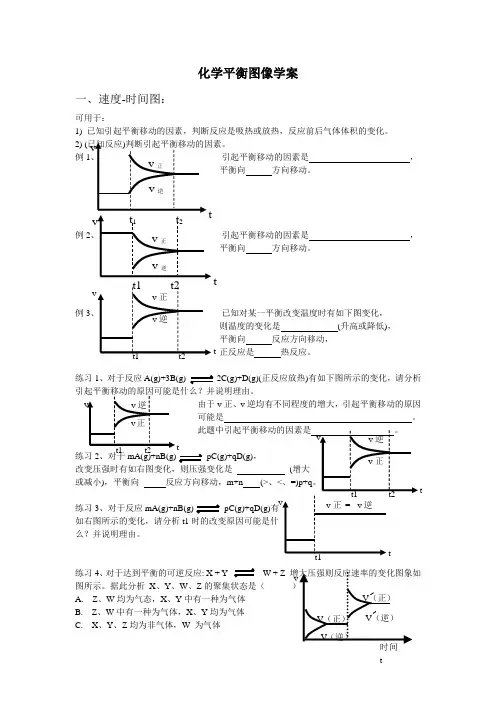
化学平衡图像学案一、速度-时间图:可用于:1) 已知引起平衡移动的因素,判断反应是吸热或放热,反应前后气体体积的变化。
2) (例1引起平衡移动的因素是 ,平衡向 方向移动。
例2引起平衡移动的因素是,平衡向 方向移动。
例3 已知对某一平衡改变温度时有如下图变化,则温度的变化是 (升高或降低), 平衡向 反应方向移动, 正反应是 热反应。
练习1、对于反应A(g)+3B(g) 2C(g)+D(g)(正反应放热)有如下图所示的变化,请分析 由于v 正、v 逆均有不同程度的增大,引起平衡移动的原因 可能是 。
练习2、对于mA(g)+nB(g) pC(g)+qD(g),改变压强时有如右图变化,则压强变化是 (或减小),平衡向 反应方向移动,m+n (>、<、练习3、对于反应mA(g)+nB(g) pC(g)+qD(g)有如右图所示的变化,请分析t1时的改变原因可能是什么?并说明理由。
练习4、对于达到平衡的可逆反应: X + Y W + Z 图所示。
据此分析 X 、Y 、W 、Z 的聚集状态是( A. Z 、W 均为气态,X 、Y 中有一种为气体B. Z 、W 中有一种为气体,X 、Y 均为气体C. X 、Y 、Z 均为非气体,W 为气体t t t t t tD. X 、Y 均为气体,Z 、W 皆为非气体练习5、如图所示,合成氨反应:N 2(g )+3H 2(g )2NH 3(g )△H <0。
在某一时间段t 0~t 6中反应速率与反应过程的曲线图。
试回答下列问题:(1)合成氨反应已达平衡状态的时间段为: 。
(2)t 1~t 2时间段是改变的 条件使平衡向 方向 移动;t 4~t 5时间段是改变的 条件使平衡 向 方向移动。
(3)在此过程中,氨的百分含量最高的一段时间是 。
解题方法及思路(1)看图像:一看面(即纵坐标与横坐标的意义), 二看线(即线的走向和变化趋势), 三看点(即起点、折点、交点、终点),四看辅助线(如等温线、等压线、平衡线等), 五看量的变化(如浓度变化、温度变化等)。
化学平衡图像专题之邯郸勺丸创作解题思路:一看轴(纵、横坐标的意义),二看线(线的走向和变更趋势),三看点(起点、折点、交点、终点、零点的意义),四看要不要作帮助线(等温线、等压线、平衡线),五看量的变更(如浓度变更、温度变更等),六想规律(外界条件对反响速率的影响规律和化学平衡移动规律) 1. 速率-时间图1. 对于达平衡的可逆反响X +Y W +Z,增大压强则正、逆反响速度(v )的变更如上图,阐发可知X,Y,Z,W 的聚集状态可能是( ).(A)Z,W 为气体,X,Y 中之一为气体 (B)Z,W 中之一为气体,X,Y 为非气体 (C)X,Y,Z 皆为气体,W 为非气体 (D)X,Y 为气体,Z,W 中之一为气体 2. 在一定条件下,反响A(g)+B(g)C(g)(正反响为放热反响)达到平衡后,按照下列图象判断A .B .C .D .E .(1)升温,达到新的平衡的是( ) (2)降压,达到新的平衡的是( )(3)减少C 的量,移向新平衡的是( )(4)增加A 的量,移向新平衡的是( )(5)使用催化剂,达到平衡的是( ) 2. 浓度(物质的量)-时间图3. 在一定温度下,容器内某一反响中M 、N 的物质的量随反响时间变更的曲线如右图,下列表述中正确的是( ) A .反响的化学方程式为:2 MNB .t2时,正逆反响速率相等,达到平衡C .t3时,正反响速率大于逆反响速率 D.t1时,N 的是M 浓度的2倍3. 含量-时间-温度(压强)图4. 可逆反响mA (s )+nB (g )eC (g )+fD (g ),反响过程中,当其它条件不变时,C 的百分含量(C %)与温度(T )和压强(P )的关系如下图:下列叙述正确的是( ).(A)达平衡后,加入催化剂则C%增大(B)达平衡后,若升温,平衡左移(C)化学方程式中n>e+f(D)达平衡后,增加A的量有利于平衡向右移动5. 在密闭容器中进行下列反响:M(g)+N(g )R(g)+2L此反响合适下面图像,下列叙述是正确的是()(A) 正反响吸热,L是气体(B) 正反响吸热,L是固体(C) 正反响放热,L是气体(D) 正反响放热,L是固体或液体6. 可逆反响mA(s)+nB(g)pC(g)+qD(g)反响过程中,当其它条件不变时,C的质量分数与温度(T)和压强(P)的关系如图(T2>T1),按照图中曲线阐发,判断下列叙述中正确的是()(A)到达平衡后,若使用催化剂,C的质量分数增大(B)平衡后,若升低温度,平衡则向逆反响标的目的移动(C)平衡后,增大A的量,有利于平衡向正反响标的目的移动(D)化学方程式中一定n>p+q 7. 现有可逆反响A(气)+B(气)3C(气),下图中甲、乙、丙辨别暗示在不合的条件下,生成物C在反响混和物中的百分含量(C%)和反响时间的关系:(1)若甲图中两条曲线辨别暗示有催化剂和无催化剂时的情况,则___曲线是暗示有催化剂时的情况.(2)若乙图中的a曲线暗示200℃和b曲线暗示100℃时的情况,则此可逆反响的正反响是_____热反响.(3)若丙图中两条曲线辨别暗示不合压强下的情况,则____曲线是暗示压强较大的情况.8. 在容积固定的密闭容器中存在如下反响:A(g)+3B(g )2 C(g)(正反响放热),某研究小组研究了其它条件不变时,改动某一条件对上述反响的影响,并按照实验数据作出右边关系图.下列判断一定错误的是( )A、图Ⅰ研究的是不合催化剂对反响的影响且乙使用的催化剂效率较高.B、图Ⅱ研究的是压强对反响的影响,且甲的压强较高.C、图Ⅱ研究的是温度对反响的影响,且甲的温度较高.D、图Ⅲ研究的是不合催化剂对反响的影响,且甲使用的催化剂效率较高.4. 恒压(温)线9. 如图所示,反响:X(气)+3Y (气) 2Z(气)(正反响为放热反响),在不合温度、不合压强(p1>p2)下,达到平衡时,混合气体中Z的百分含量随温度变更的曲线应为()10. 反响aA(g)+bB(g) cC(g),生成物C的质量分数与压强P 和温度的关系如图,方程式中的系数和Q值合适图象的是()(A)a+b>c 正反响为放热反响(B)a+b>c 正反响为吸热反响(C)a+b<c 正反响为吸热反响(D)a+b=c 正反响为放热反响11. 某可逆反响L(s)+G(g)3R(g) (正反响为吸热反响),本图暗示外界条件温度、压强的变更对上述反响的影响.试判断图中y轴可以暗示()(A)平衡混合气中R的质量分数(B)达到平衡时G的转化率(C)平衡混合气中G的质量分数(D)达到平衡时L的转化率12. 图中暗示外界条件(T、P)的变更对下列反响的影响:L(s)+G(g ) 2R(g)(正反响为吸热反响),y 轴暗示的是()(A) 平衡时,混合气中R的百分含量(B) 平衡时,混合气中G的百分含量(C) G的转化率(D) L的转化率13.A%为气态反响物在平衡体系中的百分含量,合适曲线的反响是()(A)N2(g)+3H2(g )2NH3(g)(正反响为放热反响)(B)C(s)+CO2(g ) 2CO(g)(正反响为吸热反响)(C)N2(g)+O2(g ) 2NO(g)(正反响为吸热反响)(D) CaCO3(s )CaO(s)+CO2(g)(正反响为吸热反响)14. 在可逆反响mA(g)+nB(g) pC(g) (正反响为放热反响)中m、n、p为系数,且m+n>p.阐发下列各图,在平衡体系中A的质量分数与温度toC、压强P关系正确的是()15. 能正确反应出N2+3H22NH3(正反响为放热反响)的关系的是()16. 由可逆反响测绘出图像,纵坐标为生成物在平衡混合物中的百分含量,下列对该反响的判断正确的是( )(A)反响物中一定有气体(B)生成物中一定有气体(C)正反响一定是放热反响(D)正反响一定是吸热反响5. 全程速率-时间图17.把在空气中久置的铝片5.0 g投入盛有500 Ml0.5 mol·L-1硫酸溶液的烧杯中,该铝片与硫酸反响产生氢气的速率与反响时间可用如右的坐标曲线来暗示,回答下列问题:(1)曲线由0→a段不产生氢气的原因有关的化学方程式为__________________(2)曲线由a→b段产生氢气的速率较慢的原因_____________________________________;(3)曲线由b→c段,产生氢气的速率增加较快的主要原因_________________________;(4)曲线由c以后,产生氢气的速率逐渐下降的主要原因_________________________.6. 其他图像18. 对于mA(s)+nB(g)pC(g)(正反响为放热反响)的可逆反响,在一定温度下B的百分含量与压强的关系如图所示,则下列判断正确的是( )(A)m+n<p (B)n>p(C)x点的状态是v正>v逆(D)x点比y点的反响速度慢19. 图中C%暗示某反响物在体系中的百分含量,v暗示反响速度,P暗示压强,t暗示反响时间.图(A)为温度一定时压强与反响速度的关系曲线;图(B)为压强一定时,在不合时间C%与温度的关系曲线.同时合适以下两个图像的反响是( )(A)4NH3(g)+5O2(g )4NO(g)+6H2O(g)(正反响为放热反响)(B)N2O3(g )NO2(g)+NO(g)(正反响为吸热反响)(C)3NO2(g)+H2O(l )2HNO3(l)+NO(g)(正反响为放热反响)(D)CO2(g)+C(s )2CO(g)(正反响为吸热反响)20.图7暗示mA(g)+nB(g)pC(g)+qD(g)△H=Q,在不合温度下经过一定时间混合体系中C的质量分数与温度T的关系;图8暗示一定条件下达到平衡(v正=v逆)后t时刻改动影响平衡的另一个条件重新建立新平衡的反响过程,判断该反响是().A.m+n>p+qQ>0 B.m+n>p+qQ<0C.m+n<p+qQ>0 D.m+n<p+qQ<021、向某密闭容器中加入0.3molA、0.1molC和一定量的B三种气体,一定条件下产生反响,各物质浓度随时间变更如下图所示.右图为t2时刻后改动容器中条件平衡体系中速率随时间变更情况,且四个阶段都各改动一种条件,所用条件均不合.已知t3-t4阶段为使用催化剂.(1)若t1=15s时,则t0-t1阶段以C浓度变更暗示的反响速率为V(C)= .(2)若t2-t3阶段,C的体积分数变小,V(正)小于v(逆),改动条件的是____________(3)若t4-t5阶段改动的条件为 ___________,B的起始物质的量___________ .(4) t5-t6阶段容器内A的物质的量共减小0.03mol,则此反响正反响为___________ 反响.(填吸、放热).时间:二O二一年七月二十九日。
化学平衡图象专题一、对于化学平衡的有关图象问题,可按以下的方法进行分析:1、认清坐标系,搞清纵、横坐标所代表的意义,并与勒夏特列原理挂钩。
2、紧扣可逆反应的特征,看清正反应方向是吸热还是放热、体积增大还是减小、不变, 有无固体、纯液体物质参加或生成等。
3、看清速率的变化及变化量的大小,在条件与变化之间搭桥。
4、看清起点、拐点、终点,看清曲线的变化趋势。
5、先拐先平。
例如,在转化率一时间图上,先出现拐点的曲线先达到平衡,此时逆向推理可得该变化的温度高、浓度大、压强高。
6、定一议二。
当图象中有三个量时,先确定一个量不变再讨论另外两个量的关系。
三、几种图象1、物质的量(或浓度)—时间图象:解题时要注意各物质曲线的折点(达平衡时刻),各物质浓度变化的内在联系及比例符合化学方程式中化学计量数关系等情况。
量随着时间变化的关系如图1所示,则该反应的化学方程式为_____ ___ _,2s内用A的浓度变化表示的平均反应速率分别为_________。
A的转化率是______ ;2、平衡图像:对于反应mA(气)+nB(气)pC(气)+qD(气);△H= -Q⑴含量-时间图压强一定时,Q 0;温度一定时,m+n p+q(填<、>、=)练习2:对于可逆反应mA(g)+nB(s)pC(g)+qD(g)反应过程中,其他条件不变时,产物D的质量分数D%与温度T或压强p的关系如右图所示,请判断下列说法正确的是()。
A.升温,化学平衡向正反应方向移动B.使用催化剂可使D%有所增加C.化学方程式中气体的化学计量数m<p+qD.B的颗粒越小,正反应速率越快,有利于平衡向正反应方向移动⑵转化率-时间图P一定时,Q 0;T一定时,m+n p+q;T一定时,m+n p+q;T一定时,m+n p+q;(填<、>、=)练习3: 反应2X(g)+Y(g)2Z(g)(正反应放热),在不同温度(T1和T2)及压强(p1和p2)下,产物Z的物质的量(n2)与反应时间(t)的关系,如右图所示。
【知识精讲】平衡图像一般有两种,折线图一般是转折点往后才达到平衡状态,注意转折点的横坐标和纵坐标,横坐标表示达到平衡所需的时间,时间越短,反应速率越快,温度或压强越高。
纵坐标表示达到平衡时的转化率或百分含量,抓住量的变化,找出平衡移动的方向,利用勒夏特列原理解题。
曲线图。
在曲线上的点表示平衡点,关注曲线图的走势,有多个变量时,注意控制变量。
示例反应:mA(g)+nB(g) hC(g)+qD(g) ΔH1. 转化率-时间-温度(压强)图:p一定时,ΔH<0 T一定时,m+n>h+qT一定时,m+n<h+q T一定时,m+n=h+q2. 含量-时间-温度(压强)图:这类图像反映了反应物或生成物的量在不同温度(压强)下对时间的关系,解题时要注意,一定条件下物质含量不再改变是化学反应达到平衡的特征。
p一定时,ΔH>0 p一定时,ΔH>0T一定时,m+n>h+q T一定时,m+n>h+q3. 转化率-温度-压强图:m+n>h+q,ΔH>0 m+n<h+q,ΔH<04. 含量-温度-压强图:m+n>h+q,ΔH>0 m+n<h+q,ΔH>0m+n>h+q,ΔH<0 m+n>h+q,ΔH>0【经典例析】例1. (1) 可逆反应:aA(g)+bB(g) cC(g)+dD(g) ΔH=Q。
根据下图回答:①p1 p2;②a+b c+d;③T1 T2;④ΔH 0。
(2) 可逆反应:2A(g)+B(g) 2C(g) ΔH=Q,平衡时C的百分含量、B的转化率与温度、压强的关系满足下图,根据图像回答:①p1 p2;②ΔH 0。
③图中标出的1、2、3、4四个点表示v(正)>v(逆)的点是。
(3) 某密闭容器中发生如下反应:X(g)+3Y(g) 2Z(g) ΔH<0。
下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。
一、几大影响因素对应的基本v-t图像1.浓度当其他条件不变时,增大反应物浓度或减小生成物浓度,平衡向正反应方向移动;增大生成物浓度或减小反应物浓度,平衡向逆反应方向移动。
改变浓度对反应速率及平衡的影响曲线:2.温度。
在其他条件不变的情况下,升高温度,化学平衡向着吸热的方向进行;降低温度,化学平衡向着放热的方向进行。
化学平衡图像专题知识梳理由曲线可知:当升高温度时,υ正和υ逆均增大,但吸热方向的速率增大的倍数要大于放热方向的速率增大的倍数,即υ吸>υ放,故化学平衡向着吸热的方向移动;当降低温度时,υ正和υ逆<υ放,故化学平降低,但吸热方向的速率降低的倍数要大于放热方向的速率降低的倍数,即υ吸衡向着放热的方向移动。
3.压强对于有气体参加且方程式左右两边气体物质的量不等的反应来说,在其他条件不变的情况下,增大压强,平衡向着气体物质的量减小的方向移动;减小压强,平衡向着气体物质的量增大的方向移动。
改变压强对反应速率及平衡的影响曲线[举例反应:mA(g)+n(B)p(C),m+n>p]由曲线可知,当增大压强后,υ正和υ逆均增大,但气体物质的量减小的方向的速率增大的倍数大于气体物质的量增大的方向的速率增大的倍数(对于上述举例反应来说,即'υ正增大的倍数大于'υ逆增大的倍数),故化学平衡向着气体物质的量减小的方向移动;当减小压强后,υ正和υ均减小,但气体物质的量减小的方向的速率减小的倍数大于气体物质的量增大的方向的速率逆减小的倍数(对于上述举例反应来说,即'υ正减小的倍数大于'υ逆减小的倍数),故化学平衡向着气体物质的量增大的方向移动。
【注意】对于左右两边气体物质的量不等的气体反应来说:*若容器恒温恒容,则向容器中充入与反应无关的气体(如稀有气体等),虽然容器中的总压强增大了,但实际上反应物的浓度没有改变(或者说:与反应有关的气体总压强没有改变),故无论是反应速率还是化学平衡均不改变。
*若容器恒温恒压,则向容器中充入与反应无关的气体(如稀有气体等),为了保持压强一定,容器的体积一定增大,从而降低了反应物的浓度(或者说:相当于减小了与反应有关的气体压强),故靴和她均减小,且化学平衡是向着气体物质的量增大的方向移动。
*对于反应:mA(g)十nB(g)pC(g),若m+n=p,则改变压强后的反应速率及平衡的曲线如下所示:由曲线可知,对于左右两边气体等物质的量的反应来说,改变压强后,对于υ正和υ逆来说,均同等程度地增大或减小,即'υ正='υ逆,所以化学平衡不移动。
4.催化剂使用催化剂,能用等程度地增大或减小正、逆反应速率,即'υ正='υ逆,故化学平衡不移动,只能缩短达到平衡所需要的时间。
图像如上图。
二、几种平衡图像的应用以反应mA(气)+nB(气)pC(气)+qD(气)+Q为例引导学生分析下列各图,分析时突出“起点、折点、终点”及“曲线的变化趋势”1.转化率-时间【思考】转化率的高低代表什么?斜率的大小代表什么?【答案】转化率的高低可以看到平衡移动的方向,速率的大小表示的是反应的速率,综合看效果是:“先拐先平,数值大”意思是先出现拐点的则先达到平衡,说明反应速率快,所需时间短,则该曲线表示温度较高或压强较大2.含量-时间【思考】含量的高低代表什么?先拐先平代表什么?【答案】含量的高低可以看到平衡移动的方向,但是要注意是反应物的含量还是生成物的含量。
先拐先平表示的是反应的速率,一定是温度或者压强较高。
注意含量的高低和温度(压强)两者之间没有一定的关系。
3.转化率-温度-压强4.含量-温度-压强【思考】等温线和等压线一般的看图技巧是什么?【答案】定一议二:图像中有三个量时,先确定一个量不变,再讨论另外两个量的关系。
知识点1:速率-时间图像【例1】某密闭容器中发生如下反应:X(g)+3Y(g)2Z(g)+Q上图表示该反应的速率(v )随时间(t )的变化关系,t 2、t 3、t 5时刻外界条件有所改变,但都没有改变各物质的初始加入量。
下列说法中正确的是 ( )A .t 2时增大了压强B .t 3时降低了温度C .t 5时升高温度D .t 6时反应物的转化率比t 4时高 【难度】★【答案】C 变式1:反应N 2(g )+3H 2(g )2NH 3(g )+Q 在某一时间段中反应速率与反应过程的曲线关系如图,则图中氨的百分含量最低的时间段是 () A .t 0-t 1 B .t 2-t 3C .t 3-t 4D .t 5-t 6【难度】★【答案】D 【例2】可逆反应a X(g)+b Y(g)c Z(g)在一定温度下的密闭容器内达到平衡后,t 0时改变某一外界条件,化学反应速率(v )-时间(t )图像如图。
下列说法正确的是 ()A .若a +b =c ,则t 0时只能是增大反应体系的压强B .若a +b =c ,则t 0时只能是加入催化剂C .若a +b ≠c ,则t 0时只能是加入催化剂D .若a +b ≠c ,则t 0时只能是增大体系的压强 【难度】★【答案】C例题解析变式1:往一容积不变的密闭容器中充入H2和I2,发生反应H2(g)+I2(g)2HI(g)-Q,当达到平衡后,t0时改变反应的某一条件(混合气体物质的量不变)且造成容器内压强增大,下列说法正确的是()A.容器内气体颜色变深,平均相对分子质量不变B.平衡不移动,混合气体密度增大C.H2转化率增大,HI平衡浓度变小D.改变条件前后,速率图像如下图【难度】★【答案】D变式2:右图是关于反应A2(g)+3B2(g) 2C(g)(正反应为放热反应)的平衡移动图象,影响平衡移动的原因可能是()A.升高温度,同时加压B.降低温度,同时减压C.增大反应物浓度,同时减小生成物浓度D.增大反应物浓度,同时使用催化剂【难度】★★【答案】C【方法提炼】分析反应速度图像:①看起点:分清反应物和生成物,浓度减小的是反应物,浓度增大的是生成物,生成物多数以原点为起点。
②看变化趋势:分清正反应和逆反应,分清放热反应和吸热反应。
升高温度时,△V(吸热)>△V(放热)。
③看终点:分清消耗浓度和增生浓度。
反应物的消耗浓度与生成物的增生浓度之比等于反应方程式中各物质的计量数之比。
④对于时间—速度图像,看清曲线是连续的,还是跳跃的。
分清“渐变”和“突变”、“大变”和“小变”。
增大反应物浓度V正突变,V逆渐变。
升高温度,V吸热大增,V放热小增⑤全程速率一时间图,分析时要抓住各阶段的主要矛盾,认真探究知识点2:转化率-时间图像【例1】下图曲线a表示反应X(g)+Y(g) +N(s) Z(g)+M(g)+Q进行过程中X的转化率随时间变化的关系。
若要改变起始条件,使反应过程按b曲线进行,可采取的措施是()A.升高温度B.加大N的投入量C.缩小体积D.加大X的投入量【难度】★【答案】C变式1:现有可逆反应A(g)+2B(g) nC(g)+Q,在相同温度、不同压强时,A的转化率跟反应时间(t)的关系如图,其中结论正确的是()A.p1>p2,n>3B.p1<p2,n>3C.p1<p2,n<3D.p1>p2,n=3【难度】★【答案】D变式2:向某密闭容器中充入1 mol X与2 mol Y发生反应:X(g)+2Y(g)a Z(g)+Q,达到平衡后,改变某一条件(温度或容器体积),X的平衡转化率的变化如图所示。
下列说法中正确的是)A.a=2 B.T2>T1C.A点的反应速率:v正(X)=v逆(Z)D.用Y表示A、B两点的反应速率:v(A)>v(B)【难度】★【答案】C【方法提炼】在转化率——时间曲线中,先出现拐点的曲线先达到平衡。
它所代表的温度高、压强大。
这时如果转化率也较高,压强则反应中m+n>p+q,若转化率降低,则表示m+n<p+q;温度则正反应是吸热反应。
知识点3:含量-时间图像【例1】可逆反应aA(g)+bB(s)cC(g)+dD(g)在反应过程中,其他条件不变,D的质量分数和T或p的关系如下图所示,下列叙述中正确的是()A.温度降低,化学平衡向逆反应方向移动B.使用催化剂,D的物质的量分数增加C.化学方程式中系数a<c+dD.无法根据图像确定改变温度后化学平衡向哪个反应方向移动【难度】★【答案】C变式1:同压、不同温度下的反应:A(g)+B(g)C(g),A的含量和温度的关系如图所示,下列结论正确的是()A.T1>T2, 正反应吸热B.T1<T2, 正反应吸热C.T1>T2, 正反应放热D.T1<T2, 正反应放热【难度】★【答案】C变式2:在一定温度不同压强(P1<P2)下,可逆反应2A(g) 2B(g) + C(g)中,生成物C在反应混合物中的体积分数(ψ)与反应时间(t)的关系有以下图示,正确的是【难度】★【答案】B变式3:反应a M(g)+b N(g)c P(g)+d Q(g)达到平衡时,M的体积分数y(M)与反应条件的关系如图所示。
其中z表示反应开始时N的物质的量与M的物质的量之比。
下列说法正确的是()A.同温同压同z时,加入催化剂,平衡时Q的体积分数增加B.同压同z时,升高温度,平衡时Q的体积分数增加C.同温同z时,增加压强,平衡时Q的体积分数增加D.同温同压时,增加z,平衡时Q的体积分数增加【难度】★★【答案】B【方法提炼】这类图象题表明了各种反应物或生成物浓度,或某一组成的浓度反应过程中的变化情况,此类图象往往可反应出化学反应速率与化学计量数的关系或平衡移动方向,分清反应物和生成物,浓度减小的为反应物,浓度增大的为生成物,分清消耗浓度和增加浓度,反应物的消耗浓度和生成物的增加浓度之比,等于化学方程式中各物质的化学计量数之比。
解这类题的方法和解第一类题类似,还是要注意曲线的起点、终点及变化趋势。
知识点4:等温线、等压线【例1】反应X(s)+a Y(g)b Z(g)达到平衡时,温度和压强对该反应的影响如图所示,图中:压强p1>p2,x轴表示温度,y轴表示平衡混合气体中Z的体积分数。
据此可判断下列说法正确的是()A.上述反应正方向是吸热反应B.上述反应正方向是放热反应C.b>a D.a+1<b【难度】★【答案】B变式1:在容积一定的密闭容器中发生可逆反应Y(g)+2X(g) 2Z(g)-Q,平衡移动关系如图所示。
下列说法正确的是()A.P1>P2,纵坐标指Y的质量分数B.P1<P2,纵坐标指X的转化率C.P1>P2,纵坐标指Z的质量分数D.P1<P2,纵坐标指混合气体的平均摩尔质量【难度】★【答案】C变式2:已知(HF)2(g)2HF(g)-Q,且平衡体系的总质量(m总)与总物质的量(n总)之比在不同温度下随压强的变化曲线如图所示。