厦门大学无机化学第12章ds区元素
- 格式:doc
- 大小:139.00 KB
- 文档页数:12

无机化学实验(第三版)实验习题答案p区非金属元素(卤素、氧、硫)1.氯能从含碘离子的溶液中取代碘,碘又能从氯酸钾溶液中取代氯,这两个反应有无矛盾?为什么?答:这两个反应无矛盾。
因为氯的氧化性强于碘,而碘的氧化性又强于氯酸钾。
2.根据实验结果比较:①S2O82-与MnO4-氧化性的强弱;②S2O32-与I-还原性的强弱。
答:因为S2O82-可以将Mn2+氧化为MnO4-,所以S2O82-的氧化性强于MnO4-,S2O32-能将I2还原为I-,S2O32-和还原性强于I-。
3.硫代硫酸钠溶液与硝酸银溶液反应时,为何有时为硫化银沉淀,有时又为[Ag(S2O3)2]3-配离子?答:这与溶液的浓度和酸碱性有关,当酸性强时,会生成硫化银沉淀,而在中性条件下就会生成[Ag(S2O3)2]3-配离子。
4.如何区别:①次氯酸钠和氯酸钠;②三种酸性气体:氯化氢、二氧化硫、硫化氢;③硫酸钠、亚硫酸钠、硫代硫酸钠、硫化钠。
答:①分别取少量两种固体,放入试管中,然后分别往试管中加入适量水,使固体全部溶解,再分别向两支试管中滴入两滴品红溶液,使品红溶液褪色的试管中放入的固体为次氯酸钠,剩下的一种为氯酸钠。
②将三种气体分别通入品红溶液中,使品红褪色的是二氧化硫,然后将剩余的两种气体分别通入盛有KMnO4溶液的试管中,产生淡蓝色沉淀的是H2S,剩下的一种气体是氯化氢。
③分别取四种溶液放入四支试管中,然后向四支试管中分别加入适量等量的H2SO4溶液,有刺激性气味气体产生的是亚硫酸钠,产生臭鸡蛋气味气体是的硫化钠,既有刺激性气味气体产生,又有黄色沉淀产生的是硫代硫酸钠,无明显现象的是硫酸钠。
5.设计一张硫的各种氧化态转化关系图。
1.在氯酸钾和次氯酸钠的制备实验中,如果没有二氧化锰,可改用哪些药品代替地二氧化锰?答:可用高锰酸钾代替二氧化锰。
2.用碘化钾淀粉试纸检验氯气时,试纸先呈蓝色,当在氯气中放置时间较长时,蓝色褪去,为什么?答:因为2KI+Cl2=2KCl+I2,I2遇淀粉变蓝,因此试纸呈蓝色,但氯气有氧化性,可生成HClO,可以将蓝色漂白,所以在氯气中放置时间较长时,蓝色褪去。

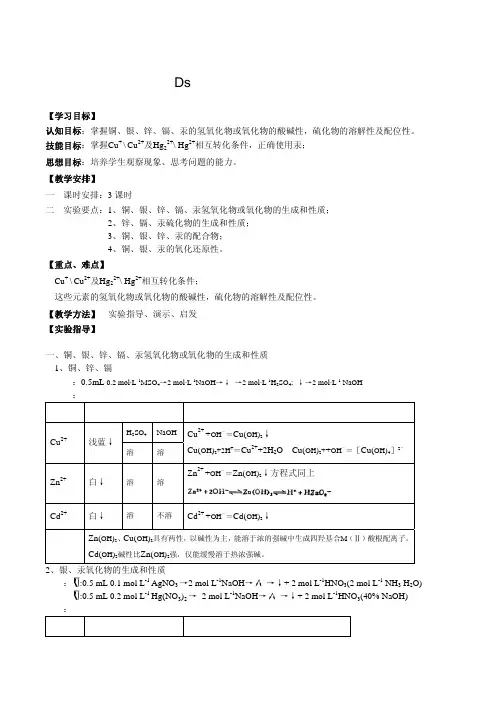
⽆机化学实验报告-DS区元素实验11 ds 区元素(铜、银、锌、镉、汞)的性质⼀、实验⽬的1、掌握铜、锌氢氧化物的酸碱性;2、掌握铜、银、锌、汞的配合物的⽣成和性质; 6、掌握铜、银、锌、汞离⼦的分离与鉴定⽅法。
⼆、实验原理IB IIBCu Zn Cu (+2,+1) Zn(+2) Ag Cd Ag (+1) Cd(+2) Au Hg Au (+1,+3) Hg(+2,+1)蓝⾊的Cu(OH)2呈现两性,在加热时易脱⽔⽽分解为⿊⾊的CuO 。
AgOH 在常温下极易脱⽔⽽转化为棕⾊的Ag 2O 。
Zn(OH)2呈两性,Cd(OH)2显碱性,Hg(I, II)的氢氧化物极易脱⽔⽽转变为黄⾊的HgO(II)和⿊⾊的Hg 2O(I)。
易形成配合物是这两副族的特性,Cu 2+、Ag +、Zn 2+、Cd 2+与过量的氨⽔反应时分别⽣成[Cu(NH 3)4]2+、[Ag(NH 3)2]+、[Zn(NH 3)4]2+、[Cd(NH 3)4]2+。
但是Hg 2+和Hg 22+与过量氨⽔反应时,如果没有⼤量的NH 4+存在,并不⽣成氨配离⼦。
如:HgCl 2 + 2NH 3 = Hg(NH 2)Cl↓⽩+ 2 NH 4Cl Hg 2Cl 2 + 2NH 3 = Hg(NH 2)Cl↓⽩+ Hg↓⿊+NH 4Cl(观察为灰⾊)Cu 2+具有氧化性,与I -反应,产物不是CuI 2,⽽是⽩⾊的CuI :Cu2+ +I- =2CuI↓⽩+I2将CuCl2溶液与铜屑混合,加⼊浓盐酸,加热可得黄褐⾊[CuCl2]-的溶液。
将溶液稀释,得⽩⾊CuCl沉淀:Cu +Cu2+ +4Cl-=2[CuCl2]-[CuCl2]-←稀释→CuCl↓⽩+Cl-卤化银难溶于⽔,但可利⽤形成配合物⽽使之溶解。
例如:AgCl +2NH3 =[Ag(NH)2]+ +Cl-红⾊HgI2难溶于⽔,但易溶于过量KI中,形成四碘合汞(II)配离⼦:HgI2 +2I- =[HgI4]2-黄绿⾊Hg2I2与过量KI反应时,发⽣歧化反应,⽣成[HgI4]2-和Hg:Hg2I2+2I- =[HgI4]2-+Hg↓⿊三、实验内容1、氧化物的⽣成和性质(1)Cu2O的⽣成和性质Cu2++2OH-=Cu(OH)2↓蓝⾊Cu(OH)2+2OH- = [Cu(OH)4]-2-蓝⾊2[Cu(OH)4]2-+C6H12O6(葡萄糖) =Cu2O↓(红) +4OH-+C16H12O7+2H2O或:2Cu2+ + 5OH- +C6H12O6 = Cu2O↓+ C6H11O7- + 3H2O (须加热)分析化学上利⽤此反应测定醛,医学上利⽤此反应检查糖尿病。



无机化学实验报告-DS区元素实验11 ds 区元素(铜、银、锌、镉、汞)的性质一、实验目的1、掌握铜、锌氢氧化物的酸碱性;2、掌握铜、银、锌、汞的配合物的生成和性质; 6、掌握铜、银、锌、汞离子的分离与鉴定方法。
二、实验原理IB IIBCu Zn Cu (+2,+1) Zn(+2) Ag Cd Ag (+1) Cd(+2) Au Hg Au (+1,+3) Hg(+2,+1) 蓝色的Cu(OH)2呈现两性,在加热时易脱水而分解为黑色的CuO 。
AgOH 在常温下极易脱水而转化为棕色的Ag 2O 。
Zn(OH)2呈两性,Cd(OH)2显碱性,Hg(I, II)的氢氧化物极易脱水而转变为黄色的HgO(II)和黑色的Hg 2O(I)。
易形成配合物是这两副族的特性,Cu 2+、Ag +、Zn 2+、Cd 2+与过量的氨水反应时分别生成[Cu(NH 3)4]2+、[Ag(NH 3)2]+、[Zn(NH 3)4]2+、[Cd(NH 3)4]2+。
但是Hg 2+和Hg 22+与过量氨水反应时,如果没有大量的NH 4+存在,并不生成氨配离子。
如:HgCl 2 + 2NH 3 = Hg(NH 2)Cl↓白+ 2 NH 4Cl Hg 2Cl 2 + 2NH 3 = Hg(NH 2)Cl↓白+ Hg↓黑+NH 4Cl(观察为灰色)Cu 2+具有氧化性,与I -反应,产物不是CuI 2,而是白色的CuI :Cu2++ I - = 2CuI↓白 + I 2将CuCl 2溶液与铜屑混合,加入浓盐酸,加热可得黄褐色[CuCl 2]-的溶液。
将溶液稀释,得白色CuCl 沉淀:Cu + Cu2++ 4Cl - = 2[CuCl 2]-[CuCl 2]-←稀释→CuCl↓白 + Cl -卤化银难溶于水,但可利用形成配合物而使之溶解。
例如:AgCl + 2NH 3 = [Ag(NH 3)2]++ Cl -红色HgI 2难溶于水,但易溶于过量KI 中,形成四碘合汞(II)配离子:HgI 2 + 2I -= [HgI 4]2-黄绿色Hg 2I 2与过量KI 反应时,发生歧化反应,生成[HgI 4]2-和Hg :Hg 2I 2+ 2I - = [HgI 4]2-+ Hg↓黑三、实验内容 1、氧化物的生成和性质(1) C u 2O 的生成和性质Cu 2+ + 2OH - =Cu(OH)2↓ 蓝色 Cu(OH)2 + 2OH - = [Cu(OH)4]-2- 蓝色2[Cu(OH)4]2-+ C 6H 12O 6 (葡萄糖) =Cu 2O↓(红) + 4OH -+C 16H 12O 7+2H 2O或:2Cu 2+ + 5OH - +C 6H 12O 6 = Cu 2O↓+ C 6H 11O 7- + 3H 2O (须加热)分析化学上利用此反应测定醛,医学上利用此反应检查糖尿病。




无机化学实验报告-ds区元素实验名称:ds区元素实验实验目的:通过实验了解ds区元素的性质,并掌握ds区元素的化学反应。
实验步骤:1. 实验前准备:取出实验器材和试剂,清洗干净。
2. 实验1:铑(Rh)和铱(Ir)颜色对比实验。
将Rh和Ir放在白纸上比较颜色的不同。
Rh呈现银白色,而Ir呈现黄色,可以清晰地区分这两种元素。
先将Rh粉磨成粉末状,并称取一定量的Rh,加入200毫升的盐酸中。
在加热的过程中,观察Rh在盐酸中的反应。
Rh在盐酸中反应,生成RhCl3的无色溶液,并放出氢气。
反应方程式:2Rh + 6HCl → 2RhCl3 + 3H2。
4. 实验3:铱(Ir)的化学反应实验。
将Ir和硫在空气中加热时,会发生强烈的反应,生成黑色的IrS2。
IrS2是一种比较稳定的化合物,可以在空气中保存。
反应方程式:2Ir + 3S → IrS2。
实验结果及分析:通过这些实验,我们可以发现ds区元素的某些性质和化学反应式。
Rh和Ir颜色的对比实验,让我们比较容易地区分这两种元素。
在Rh的化学反应实验中,我们可以清晰地看到Rh粉末加入盐酸中反应时,生成RhCl3的无色溶液,同时放出氢气。
而在Ir的实验中,我们可以发现,在空气中加热Ir和硫时,会形成黑色的IrS2,是一种比较稳定的化合物,可以在空气中保存。
结论:通过本次实验,我们了解了ds区元素的某些性质和化学反应式,学会了如何区分Rh和Ir的颜色差别,并掌握了Rh和Ir的化学反应过程。
同时,通过实验过程中的观察和分析,将理论知识和实际操作紧密结合起来,有助于更好地理解和掌握相关科学知识。
第十二章ds区元素12。
1 铜族元素 (1)12。
2 锌族元素 (10)12.1 铜族元素12。
1.1 铜族元素通性铜族元素1。
铜族元素通性铜族元素的氧化态有+1,+2,+3三种,这是由于铜族元素最外层ns电子和次外层(n-1)d电子能量相差不大。
有人认为在本族元素中,元素第二电离能与第一电离能的差值越小,它的常见氧化值就越高.对于Cu、Ag、Au,Δ(I2—I1)Au 〈Δ(I2—I1)Cu < Δ(I2-I1)Ag所以常见氧化态物+3,+2,+1。
铜、银、金的标准电势图如下所示:12.1.2 铜族元素金属单质2。
铜族元素金属单质(1).物理性质铜和金是所有金属中仅有的呈现特殊颜色的二种金属,铜族元素的熔点、沸点、硬度均比相应的碱金属高。
这可能与d电子也参与形成金属键有关。
由于铜族金属均是面心立方晶体(如下图),它们不仅堆积最密而且存在较多可以滑动的高密度原子层,因而比相应的碱金属(多为体心立方晶体)密度高得多,且有很好的延展性,其中以金最佳。
铜族元素的导电性和传热性在所有金属中都是最好的,银占首位,铜次之。
(2)。
化学性质铜族元素的化学活性远较碱金属低,并按Cu—-Ag-—Au的顺序递减.在潮湿的空气中放久后,铜表面会慢慢生成一层铜绿。
铜绿可防止金属进一步腐蚀,其组成是可变的。
银和金不会发生该反应。
空气中如含有H2S气体与银接触后,银的表面上很快生成一层Ag2S的黑色薄膜而使银失去银白色光泽。
()在电位序中,铜族元素都在氢以后,所以不能置换稀酸中的氢。
但当有空气存在时,铜可缓慢溶解于这些稀酸中:浓盐酸在加热时也能与铜反应,这是因为Cl-和Cu+形成了较稳定的配离子[CuCl4]3—,使Cu == Cu++e-的平衡向右移动:铜易为HNO3、热浓硫酸等氧化性酸氧化而溶解银与酸的反应与铜相似,但更困难一些;而金只能溶解在王水中:铜、银、金在强碱中均很稳定。
12。
1。
3 铜族元素重要化合物3。
第 三 部 分 元 素 化 学•熟悉元素性质与电子层结构的关系 •掌握单质和重要化合物的性质•了解它们在医药中的应用结束无机化学 2014/12/1 §12-15 : 2从上到下 半径增大 电离能减小 电负性减小第一节 s 区元素概述第十一章 s 区元素ⅠA ns 1 Li Na K Rb Cs ⅡA ns 2 Be Mg Ca Sr Ba碱金属 碱土金属从左到右,半径减小电离能增大 电负性增大除Li 和Be 外,多数金属形成离子化合物。
p273结束 无机化学 2014/12/1 §12-15 : 7NaHCO 3:小苏打,用于治疗胃酸过多和酸中毒; CaCO 3: 珍珠、钟乳石、贝壳的主要成分;Na 2SO 4·10H 2O : 中药称芒硝或朴硝,作缓泻剂; Na 2SO 4 :中药称玄明粉或元明粉,作缓泻剂; BaSO 4: 重晶石,难溶于水、酸、碱,能强烈吸收X 射线,因无毒用作胃肠造影剂之“钡餐”; BaCl 2:剧毒(致死量0.8g )。
CaSO 4·2H 2O 生石膏,内服清热泻火; CaSO 4· H 2O 熟石膏(煅石膏, 烧石膏)粉末遇水膨胀硬化,石膏绷带,外敷治疗烫伤疥疮等。
MgSO 4·7H 2O :又称泻盐,作缓泻剂。
四、重要的盐类 p28112结束无机化学 2014/12/1 §12-15 : 8 五、对角线规则 p282在周期表s 区和p 区,某元素与左上方或右下方的元素及其化合物的性质相似。
例如:Be 和Al 的还原性相近; Be(OH)2和Al(OH)3 均为两性;例如:LiCl,、MgCl 2 都是共价化合物; LiOH 、Mg(OH)2都是中强碱,微溶于水Li Be B C Na Mg Al Si结束 无机化学 2014/12/1 §12-15 : 9VIIA 族 n s 2n p 59F 17Cl 35Br 53I 85At一、卤族元素的通性 (p284)(1) 是非极性分子,难溶于水,易溶于有机溶剂及碘化钾溶液中:KI + I 2 = KI 3 碘酒(碘酊)(p306习题3) F 2→I 2 的熔点、沸点、密度增大。
第十二章ds区元素12.1 铜族元素.................................................................................................. 错误!未定义书签。
12.2 锌族元素.................................................................................................. 错误!未定义书签。
12.1 铜族元素12.1.1 铜族元素通性铜族元素1.铜族元素通性铜族元素的氧化态有+1,+2,+3三种,这是由于铜族元素最外层ns电子和次外层(n-1)d电子能量相差不大。
有人认为在本族元素中,元素第二电离能与第一电离能的差值越小,它的常见氧化值就越高。
对于Cu、Ag、Au,Δ(I2-I1)Au < Δ(I2-I1)Cu < Δ(I2-I1)Ag所以常见氧化态物+3,+2,+1。
铜、银、金的标准电势图如下所示:12.1.2 铜族元素金属单质2.铜族元素金属单质(1).物理性质铜和金是所有金属中仅有的呈现特殊颜色的二种金属,铜族元素的熔点、沸点、硬度均比相应的碱金属高。
这可能与d电子也参与形成金属键有关。
由于铜族金属均是面心立方晶体(如下图),它们不仅堆积最密而且存在较多可以滑动的高密度原子层,因而比相应的碱金属(多为体心立方晶体)密度高得多,且有很好的延展性,其中以金最佳。
铜族元素的导电性和传热性在所有金属中都是最好的,银占首位,铜次之。
(2).化学性质铜族元素的化学活性远较碱金属低,并按Cu--Ag--Au的顺序递减。
在潮湿的空气中放久后,铜表面会慢慢生成一层铜绿。
铜绿可防止金属进一步腐蚀,其组成是可变的。
银和金不会发生该反应。
空气中如含有H2S气体与银接触后,银的表面上很快生成一层Ag2S的黑色薄膜而使银失去银白色光泽。
()在电位序中,铜族元素都在氢以后,所以不能置换稀酸中的氢。
但当有空气存在时,铜可缓慢溶解于这些稀酸中:浓盐酸在加热时也能与铜反应,这是因为Cl-和Cu+形成了较稳定的配离子[CuCl4]3-,使Cu == Cu++e-的平衡向右移动:铜易为HNO3、热浓硫酸等氧化性酸氧化而溶解银与酸的反应与铜相似,但更困难一些;而金只能溶解在王水中:铜、银、金在强碱中均很稳定。
12.1.3 铜族元素重要化合物3.铜族元素重要化合物(1).氧化物与氢氧化物a.氧化铜、氧化亚铜和氢氧化铜铜可以形成黑色的氧化铜(CuO)和红色的氧化亚铜(Cu2O),氧化铜和氧化亚铜均不溶于水。
加热氢氧化铜、碱式碳酸铜、硝酸盐都能得到氧化铜;选用温和的还原剂如葡萄糖、羟氨、酒石酸钾钠或亚硫酸钠在碱性溶液中还原Cu(II)盐,可得到氧化亚铜:2Cu2++SO32―+4OH― ==== Cu2O↓+SO42―+2H2O2Cu2++4OH―+C6H12O6 ==== Cu2O↓+C6H11O7+3H2O【问题1】该反应有什么用途?该反应在医疗上用于诊断糖尿病,分析化学上利用这个反应测定醛。
Cu2O在酸性溶液中立即歧化为Cu2+和Cu。
当溶于氨水中形成无色的Cu(NH3)+,它会很快被空气中的氧氧化为蓝色的Cu(NH3)42+。
Cu2++2OH―=Cu(OH)2【问题2】Cu(OH)2是两性吗?它微显两性,以碱性为主,能溶于较浓的强碱形成Cu(OH)42―。
Cu(OH)2 +4NH3·H2O = Cu(NH3)42+ + 4H2O。
Cu(NH3)42+的溶液简称铜氨液,它有溶解纤维的能力,在溶解了纤维的溶液中加水或酸,纤维又可沉淀析出。
纺织工业利用这种性质来制造人造丝。
b.氧化银和氢氧化银将碱金属氢氧化物同硝酸银反应,可以得到棕黑色Ag2O。
(为什么?)由于Ag+极化能力较强,所以一般不生成氢氧化物,而生成氧化物。
在温度低于-45℃,用碱金属氢氧化物和硝酸银的90%酒精溶液作用,则可能得到白色的AgOH沉淀。
潮湿的氧化银具有弱碱性,它容易从大气中吸收CO2;当溶于碳酸铵、氰化钠和氰化钾溶液分别生成[Ag(NH3)2]2CO3、Na[Ag(CN)2]和K[Ag(CN)2]。
2Ag++S2O82―+2H2O ===== 2AgO+4H++2SO42―Ag2O是构成银锌蓄电池的重要原材料;Ag2O和MnO2,Cr2O3,CuO等的混合物能在室温下将CO迅速氧化成CO2,用于防毒面具中。
(2).盐类a.卤化物CuCl2·2H2O受热时,按下式分解:所以无水CuCl2是在HCl气流中,将CuCl2·2H2O加热到412~423K下制得的,X射线测定表明CuCl2是共价化合物,具有含平面CuCl4单元的链状结构:CuCl2不但易溶于水,而且易溶于乙醇和丙酮。
它在很浓的溶液中呈黄绿色,在较浓溶液中显绿色,在稀溶液中显蓝色。
(为什么?)黄色是由于[CuCl4]2-配离子存在,蓝色是由于[Cu(H2O)6]2+配离子存在,两者并存时显绿色。
但也有人认为在溶液中,随着Cl-离子浓度增大,由于H2O被Cl-取代而将荷移谱带由紫外光区移到可见光区,故溶液由蓝变绿。
卤化银只有AgF易溶于水,在湿空气中潮解,其余均微溶于水,而且依Cl-Br-I的顺序溶解度降低,颜色加深。
AgI有α、β、γ等多种晶型,在419K β-AgI转变为a-AgI,导电性增大近万倍。
在常温下Ag+导电能力较强,其中以a-AgI为主要成分的常温型固体电解质电池已广泛应用。
(详细资料)在这种电池中,负极为银,正极用含碘或其它银的化合物,其电极反应为:此电池本身放电少,适合长期保存,理论寿命可达10年之久。
金的卤化物具有明显的共价性,如AuCl3,无论在固态或气态都是二聚体,它基本上是平面正方形结构:Au+在水溶液中易歧化为Au3+和Au,因而Au+在水溶液中不能存在,即使溶解度很小的AuCl也要歧化。
只有当Au+形成配合物如[Au(CN)2]-才能在水溶液中稳定。
b.硫酸铜CuSO4·5H2O(俗称胆矾)可用铜屑或氧化铜溶于硫酸中制得。
硫酸铜用在铜的电解精炼、电镀、丹尼尔电池、颜料的制造,纺织工业的媒染剂等。
CuSO4·5H2O在不同温度下可逐步失水,最后分解为CuO。
可见各个水分子的结合力不完全一样,实验证明,四个水分子(配位水)以平面四边形配位在Cu2+周围,第五个水分子(阴离子水)以氢键与二个配位水分子和SO42-结合,SO42-在平行四边形的上下,形成一个不规则的八面体。
CuSO4·5H2O可写成[Cu(H2O)4]SO4·H2O,其结构如下图所示:加热失水时,先失去Cu2+的两个非氢键配位水,再失去两个氢键配位水,最后失去阴离子水。
无水硫酸铜为白色粉末,吸湿性很强,不溶于乙醇、乙醚。
吸水后有特征蓝色,利用这一性质可检验乙醇、乙醚中的少量水,在有机合成中用作干燥剂。
c.硝酸银AgNO3晶体加热或受日光直接照射时,均能逐渐分解:因此,AgNO3晶体或溶液都应保存在棕色玻璃瓶中。
AgNO3是一种氧化剂(E Ag+/Ag=0.7992V),即使在室温,许多有机物都能将它还原为黑色的银粉,例如皮肤与布与之接触后均会生成黑色的银。
大量硝酸银可用于制造照相底片上卤化银。
AgNO3还是重要的分析试剂。
12.1.4 铜族元素主要配合物4.铜族元素主要配合物(1).铜的配合物Cu+为d10电子构型,易与NH3、S2O32-,CN-等易变形的配体形成配离子,如[CuX n]-(n-1)、[Cu(CN)2]-、[Cu(CN)4]3-、[Cu(NH3)2]+等。
大多数Cu(I)配合物是无色的。
Cu+的卤配合物的稳定性顺序为I>Br>Cl,正好与过渡金属离子八面体配合物的光谱化学序列相反。
(为什么?)这符合硬软酸碱原理的软亲软原则的。
[Cu(NH3)2]+溶液可用来定量吸收合成氨原料气中的CO,减压加热后CO可放出。
Cu2+离子为d9构型,比Cu+更容易形成配合物,常见配位数为4、6,配位数为2的很稀少。
Cu(II)配离子多为四短两长键的变形八面体,或平面正方形结构。
如:[Cu(H2O)6]2+、[Cu(NH3)4(H2O)2]2+如:[Cu(en)2]2+(蓝紫色)、CuCl42-由于[Cu(NH3)4]2+的稳定性,大多数微溶的Cu(II)化合物都能被氨水所溶解。
Cu2+为交界酸,它与OH-、Cl-等硬碱离子形成的配离子均不够稳定。
Cu2+还具有一定的氧化性,与还原性阴离子如CN-、I-反应时并不形成Cu(II)的配离子,而是得到较稳定的Cu(I)化合物。
通常认为Cu(III)是罕见的,它非常容易还原,但最近发现其与某些生物过程有关,因而受到重视。
已知的Cu III配合物除K3CuF6为高自旋(两个未成对电子)以外,其它均为低自旋抗磁性,大部分为平面正方形结构,因为Cu III类似于Ni II为d8电子构型。
例如Cu II被碱性ClO-氧化成Cu III配合物:(2).银的配合物Ag+易形成配合物,常见的配位数为2,可与Cl-、NH3、S2O32-、CN-等形成稳定程度不同的配离子。
利用Ag+离子易于形成某些配离子的性质,可使某些难溶银(I)盐溶解。
例如,由于各种AgX的溶解度不同,银的各种配合物的稳定性不同,可发生如下反应:如何判断AgX形成配合物的难易程度?根据K=K sp·K可判断AgX沉淀转化的难易及完全程度,因此,AgCl溶于氨水,AgBr 能溶于浓氨水而AgI难溶;同理可说明AgBr易溶于Na2S2O3,而AgI难溶于Na2S2O3却易溶于KCN溶液中。
Ag2S在所有银的化合物中是最难溶的。
银的配合物广泛应用于电镀工业、照相技术等方面,利用[Ag(NH3)2]+能均匀释放出Ag+而被甲醛或葡萄糖还原,生成银镜的反应,在分析化学上可鉴定醛类。
(3).金的配合物当把Au溶于王水,将AuCl3溶于盐酸中或将含有[AuCl4]-配离子溶液蒸发时,我们可以得到黄色的氯金(IV)酸水合晶体H[AuCl4]·H2O。
黄色的Na[AuCl4]·2H2O,无色片状K[Au(CN)4]·3/2H2O,均易溶于水。
12.1.5 Cu(I)与Cu(II)的相互转化5.Cu(I)与Cu(II)的相互转化Cu(I)与Cu(II)的相互转化涉及到热力学上的歧化稳定性问题。
从铜族元素的电势图ssss 可知Cu+(d10)在水溶液中易歧化为Cu2+(d9)和Cu。
具有d10相对稳定构型的Cu+在水溶液中反而不稳定(为什么?)这主要是Cu2+离子(电荷高、半径小、与水的静电作用大,并有晶体场作用能的额外贡献)的水合热(2121KJ/mol)比Cu+的(582KJ/mol)大得多,补偿了Cu+气态时歧化反应焓变的正值(881KJ/mol)和一价铜的去水合热,足以破坏Cu+的d10相对稳定的电子构型,使之向d9电子构型的Cu2+转变。