PbBi含量的连续测定
- 格式:doc
- 大小:23.50 KB
- 文档页数:2

铅铋连续测定实验报告
实验名称:铅铋连续测定实验
实验目的:掌握铅铋连续测定实验的操作方法和数据处理技能,了解铅和铋元素的测定方法和仪器原理。
实验原理:铅铋连续测定法是指在一定条件下将液态铅和铋连
续气化成气态后直接输入到质谱仪中分析,根据不同原子量的气
体在质谱中的质量数信号比值,求出样品中铅和铋的质量浓度。
实验步骤:
1. 启动质谱仪,将其预热至稳定状态。
2. 准备样品:将待分析的铅铋样品加入量杯中,在室温下将其
蒸发到干燥状态,并在炉子中将其进一步加热至液态。
3. 连接液体进样器,并通过控制器设置样品喷入频率和量。
4. 启动进样器和加热器,持续3分钟后取得前15次质谱信号。
5. 计算实验数据:根据比较标准质谱信号和样品质谱信号,计
算出样品中铅和铋的质量浓度。
实验结果:
通过实验,我们得到了以下结果:
样品编号铅浓度(mg/L) 铋浓度(mg/L)
样品1 10.23 2.08
样品2 11.05 1.98
样品3 9.87 2.12
实验结论:
通过铅铋连续测定实验,我们成功获得了三个样品中铅铋的浓
度数据。
根据实验数据,我们可以得出以下结论:
1. 实验数据的误差在可接受范围以内,表明实验操作和数据处理方法正确有效。
2. 样品1和样品2中铅含量较高,铋含量较低,可能是来自于同一种原料的产物。
3. 样品3中铅和铋的含量相对均衡,可能是来自于两种原料的混合物。
总之,本次实验为我们提供了铅铋元素测定的重要实验经验和数据基础,有利于我们进一步深入了解质谱仪的检测原理和应用方法。




铅铋连续测定实验报告铅铋连续测定实验报告引言:铅和铋是常见的金属元素,它们在环境和工业中的存在对人类健康和生态系统都有潜在的危害。
因此,准确测定铅和铋的含量对于环境保护和人类健康至关重要。
本实验旨在通过连续测定方法,确定给定样品中铅和铋的含量,并探讨实验过程中可能遇到的问题和解决方法。
实验步骤:1. 样品准备:首先,我们收集了不同来源的样品,包括水样、土壤样品和金属合金样品。
然后,将样品研磨成细粉末,并通过筛网筛选出均匀的颗粒。
2. 样品预处理:为了提高测定的准确性和灵敏度,我们采用了样品预处理步骤。
对于水样,我们使用了离子交换树脂进行预处理,以去除悬浮物和有机物。
对于土壤样品,我们使用了酸溶解和过滤的方法,以去除杂质。
对于金属合金样品,我们使用了高温熔融法,将样品转化为溶液。
3. 连续测定方法:我们选择了原子吸收光谱法作为连续测定铅和铋的方法。
首先,我们校准了仪器,使用标准溶液制备了一系列不同浓度的铅和铋溶液。
然后,将样品溶液导入原子吸收光谱仪中,通过测量吸光度来确定样品中铅和铋的浓度。
结果与讨论:通过连续测定方法,我们成功确定了给定样品中铅和铋的含量。
在水样中,铅的浓度范围为0.05 mg/L到0.1 mg/L,铋的浓度范围为0.02 mg/L到0.05 mg/L。
在土壤样品中,铅的浓度范围为10 mg/kg到20 mg/kg,铋的浓度范围为5mg/kg到10 mg/kg。
在金属合金样品中,铅的浓度范围为1%到5%,铋的浓度范围为0.5%到2%。
在实验过程中,我们遇到了一些问题,如样品预处理的时间和操作步骤较多,可能会导致误差的累积。
此外,仪器的校准和灵敏度调整也需要一定的经验和技巧。
为了解决这些问题,我们进行了多次实验重复和仪器校准,以确保结果的准确性和可靠性。
结论:通过连续测定方法,我们成功确定了给定样品中铅和铋的含量,并讨论了实验过程中可能遇到的问题和解决方法。
这些结果对于环境监测、工业生产和人类健康具有重要意义,为相关领域的研究和实践提供了有价值的参考。


铅、铋混合溶液中铅、铋含量的连续测定文摘:EDTA:乙二胺四乙酸H4Y(本身是四元酸),由于在水中的溶解度很小,通常把它制成二钠盐(Na2H2Y·2H2O),也称为EDTA或EDTA二钠盐。
EDTA相当于六元酸,在水中有六级离解平衡。
与金属离子形成螯合物时,络合比皆为1:1。
EDTA因常吸附0.3%的水分且其中含有少量杂质而不能直接配制标准溶液,通常采用标定法制备EDTA标准溶液。
标定EDTA的基准物质有纯的金属:如Cu、Zn、Ni、Pb,以及它们的氧化。
某些盐类:如CaCO3、ZnSO4.7H2O、MgSO4.7H2OBi3+,Pb2+均能和EDTA形成稳定的 1:1 络合物。
logK 值分别为27.04 和18.04 。
由于二者的l ogK值相差很大,故可控制不同的酸度分别进行滴定。
关键字:EDTA ZnO Bi3+, Pb2+ 二甲酚橙六次甲基四胺溶液综述:金属离子指示剂:在络合滴定时,与金属离子生成有色络合物来指示滴定过程中金属离子浓度的变化。
M +In ←→ MIn颜色甲颜色乙滴入EDTA后,金属离子逐步被络合,当达到反应化学计量点时,已与指示剂络合的金属离子被EDTA夺出,释放出指示剂的颜色:MIn +Y ←→MY +In颜色乙颜色甲指示剂变化的pMep应尽量与化学计量点的pMsp一致。
金属离子指示剂一般为有机弱酸,存在着酸效应,要求显色灵敏,迅速,稳定。
常用金属离子指示剂:铬黑T(EBT):pH=10时,用于Mg2+,Zn2+,Cd2+,Pb2+,Hg2+,In3+,二甲酚橙(XO):pH5~6时,Zn2+K-B指示剂(酸性铬蓝(K)-荼酚绿(B)混合指示剂):pH=10时,用于Mg2+,Zn2+, Mn2+。
pH=12时,用于Ca2+在络合滴定过程中,随着络合物的生成,不断有H+释出:M+H2Y=MY+2H+因此,溶液的酸度不断增大,酸度增大的结果,不仅降低了络合物的条件稳定常数,使滴定突跃减小,而且破坏了指示剂变色的最适宜酸度范围,导致产生很大的误差。


铅、铋混合液中铅、铋含量的连续测定实验目的:1进一步熟练滴定操作和滴定终点的判断;2 掌握铅、铋测定的原理、方法和计算。
一、实验原理Bi3+、Pb2+均能与EDTA形成稳定的络合物,其lgK值分别为27.94和18.04,两者稳定性相差很大,ΔpK>9.90>6。
因此,可以用控制酸度的方法在一份试液中连续滴定Bi3+和Pb2+。
在测定中,均以二甲酚橙(XO)作指示剂,XO在pH<6时呈黄色,在pH>6.3时呈红色;而它与Bi3+、Pb2+所形成的络合物呈紫红色,它们和稳定性与Bi3+、Pb2+和EDTA所形成的络合物相比要低;而且K Bi-XO>K Pb-XO。
测定时,先用HNO3调节溶液pH=1.0,用EDTA标准溶液滴定溶液由紫红色突变为亮黄色,即为滴定Bi3+的终点。
然后加入六次甲基四胺溶液,使溶液pH为5~6,此时Pb2+与XO 形成紫红色络合物,继续用EDTA标准溶液滴定至溶液由紫红色突变为亮黄色,即为滴定Pb2+的终点。
二、试剂0.02mol/L EDTA标准溶液;HNO30.10nol/L;六次甲基四胺溶液200g/L;Bi3+、Pb2+混合液,含Bi3+、Pb2+各约为0.010mol/L,含HNO30.15mol/L;二甲酚橙2g/L水溶液。
三、实验步骤1、EDTA溶液的标定准确称取在120度烘干的碳酸钙0.5~0. 55g一份,置于250ml 的烧杯中,用少量蒸馏水润湿,盖上表面皿,缓慢加1:1HCl 10ml,加热溶解定量地转入250ml容量瓶中,定容后摇匀。
吸取25ml,注入锥形瓶中,加20ml NH3-NH4Cl缓冲溶液,铬黑T指示剂2~3滴,用欲标定的EDTA溶液滴定到由紫红色变为纯蓝色即为终点,计算EDTA溶液的准确浓度。
2、铅、铋混合液中铅、铋含量的连续测定用移液管移取25.00ml Bi3+、Pb2+混合试液于250ml锥形瓶中,加入10ml 0.10mol/L HNO3,2滴二甲酚橙,用EDTA标准溶液滴定溶液由紫红色突变为亮黄色,即为终点,记取V1(ml),然后加入10ml 200g/L六次甲基四胺溶液,溶液变为紫红色,继续用EDTA标准溶液滴定溶液由紫红色突变为亮黄色,即为终点,记下V2(ml)。

实验七铅、铋混合液中铅、铋含量的连续测定教案课程名称:分析化学实验B教学内容:以二甲酚橙为指示剂连续测定铅、铋混合液中铅、铋含量实验类型:验证教学对象:化工、环境工程、药学、生物科学、应用化学、医学检验、制药、复合材料、生物工程、生物技术授课地点:中南大学南校区化学实验楼302授课学时:4学时一、教学目的与要求1、练习巩固移液管、滴定管的正确使用;2、了解铅、铋混合液中铅、铋含量连续测定的意义;3、巩固EDTA标准溶液的配制与标定;4、学习利用酸效应曲线进行混合液中金属离子连续滴定的条件选择;5、掌握铅、铋连续测定的原理、方法和计算;6、熟悉二甲酚橙(XO)指示剂终点颜色判断和近终点时滴定操作控制二、知识点配位反应、化学计量点、金属指示剂、指示剂的僵化和封闭现象、滴定终点、酸效应曲线、标准溶液、移液管、酸式滴定管、实验报告的撰写(数据处理三线表表格化)、有效数字三、技能点玻璃器皿的洗涤、移液管的使用、酸式滴定管的使用、标准溶液的配制与标定四、教学重点及难点重点:锌标准溶液标定EDTA标准溶液;控制酸度的办法进行金属离子连续滴定的原理;络合滴定中缓冲溶液的作用难点:控制酸度的办法进行金属离子连续滴定的原理五、教学方法任务驱动法、分组讨论法、阅读指导法、现场讲解指导等六、复习引入1、复习配位滴定法有关知识,提问学生:(1)二甲酚橙指示剂在滴定终点的颜色如何变化的?(由紫红色变成黄色)(2) EDTA配位滴定法测定铋和铅时,溶液的pH值分别控制在多少?(1和5~6)(3)EDTA配位滴定法测定铋和铅时,分别用什么溶液控制溶液的pH值?(硝酸和六次甲基四胺)[引入] EDTA配位滴定法的应用:以二甲酚橙为指示剂连续测定铅、铋混合液中铅、铋含量[引言] 铅铋合金是一种重要的材料,在许多的领域中得到应用。
在医疗领域,用做特定形状的防辐射专用挡块;在模具制造领域,用作铸造制模,模具装配调试等;在电子电气、自动控制领域,用作热敏元件、保险材料、火灾报警装置等;在折弯金属管时,作为填充物;在做金相试样时,作为嵌镶剂以及液力偶合器用。
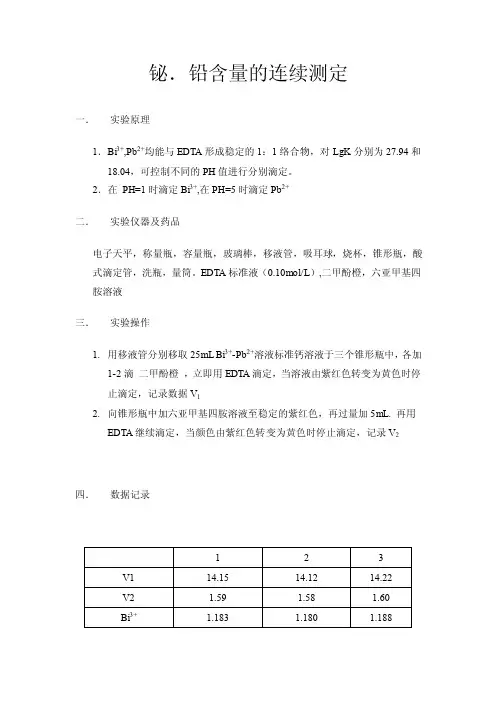
铋.铅含量的连续测定
一.实验原理
1.Bi3+,Pb2+均能与EDTA形成稳定的1:1络合物,对LgK分别为27.94和
18.04,可控制不同的PH值进行分别滴定。
2.在PH=1时滴定Bi3+,在PH=5时滴定Pb2+
二.实验仪器及药品
电子天平,称量瓶,容量瓶,玻璃棒,移液管,吸耳球,烧杯,锥形瓶,酸式滴定管,洗瓶,量筒。
EDTA标准液(0.10mol/L),二甲酚橙,六亚甲基四胺溶液
三.实验操作
1.用移液管分别移取25mL Bi3+-Pb2+溶液标准钙溶液于三个锥形瓶中,各加
1-2滴二甲酚橙,立即用EDTA滴定,当溶液由紫红色转变为黄色时停止滴定,记录数据V1
2.向锥形瓶中加六亚甲基四胺溶液至稳定的紫红色,再过量加5mL. 再用
EDTA继续滴定,当颜色由紫红色转变为黄色时停止滴定,记录V2四.数据记录
五.注意事项。
1.酸式滴定管,移液管均应用标准液润洗,酸式滴定管经排气泡,调零点后才能滴定。
2.移液管放液时要使其竖直,锥形瓶要倾斜,使尖端靠在锥形瓶内壁上。
3.滴定时滴定管尖端约在锥形瓶颈部处,在此过程中要不断用洗瓶冲洗锥形瓶内壁。
实验六--铅铋含量的连续测定铅铋含量的连续测定是化学分析实验室中常用的分析方法之一。
本实验通过离子选择性电极法(ISE)测定铅浸出液中的铅铋含量,探究了ISE的原理及其在实验中的应用。
一、实验原理1. 离子选择性电极离子选择性电极(ISE)是用于测定电解质溶液中某种离子浓度的一种电化学传感器。
ISE具有选择性地响应某种离子,但对其他离子的响应很少或根本没有。
ISE由电极体和参比电极两部分组成,其中电极体是选择性膜和电极内液组成的。
2. 铅铋浓度测定本实验通过ISE测定铅浸出液中的铅铋含量。
测定时,将ISE插入铅浸出液中并测量出电势值。
将测量结果与参考电势和标准曲线相比较,即可得到铅铋含量的浓度值。
3. 标准曲线的绘制为了得到准确的测量结果,需要绘制标准曲线。
标准曲线是针对某种离子在特定条件下响应电位所得到的一组数据。
绘制标准曲线时,通过测量一系列已知浓度的样品,得到各浓度下的电位值。
将电位值与浓度绘制成标准曲线,即可根据待测样品的电位值得到其浓度值。
二、实验步骤1. 实验器材和试剂(2)标准溶液:0.1 mol/L、1.0 mol/L的Pb(NO3)2溶液和0.1 mol/L的Bi(NO3)3溶液(3)样品:经过浸出处理的铅矿石含铅铋溶液(1)根据离子选择性电极的使用说明,连接参比电极和电位计,对电位计进行校准。
(2)将标准溶液分别加入容量瓶中,用去离子水稀释至100 mL。
分别称取10 mL、20 mL、30 mL、40 mL和50 mL的标准溶液,加入容量瓶中,并用去离子水稀释至100 mL,制成5个不同浓度的标准溶液。
分别用ISE测量各标准溶液中的电位值,并记录数据。
(3)将样品倒入容量瓶中,加入少量的HNO3调节pH值,并用去离子水稀释至100 mL。
用ISE测量样品中的电位值,并记录数据。
(4)根据标准曲线计算样品中的铅铋含量浓度。
三、实验结果及分析1. 实验数据(1)铅标准曲线|Pb(NO3)2浓度/mol L-1|电位值/mV||-|-||0.05|43.0||0.1|64.0||0.15|84.9||0.2|105.3||0.25|124.8||0.3|144.4||0.4|183.7||0.5|222.2||0.6|259.6||0.7|295.8||0.8|330.9||0.9|364.8||1.0|397.6|(3)样品测量结果样品电位值:188.3 mV2. 数据分析使用ISE测定铅铋浓度时,需要分别绘制铅和铋的标准曲线。
铅铋含量的连续测定计算公式铅铋含量的连续测定计算公式为:
铅铋含量= ([铅] × M1 × V1) / ([铋] × M2 × V2)
其中,[铅]和[铋]分别表示测得的铅和铋的质量浓度,M1和M2分别表示铅和铋的摩尔质量,V1和V2分别表示对应的体积。
需要注意的是,该公式仅适用于铅和铋在样品中的含量较低且不能相互干扰的情况下。
拓展:在实际应用过程中,为了提高测定的准确性和可靠性,通常还需要采用多种方法和技术手段,如前处理、分离富集、X射线荧光光谱、电感耦合等离子体质谱等,以实现对铅铋含量的连续、精确、快速测定和分析。
【精选铅铋混合液的连续测定· 奥司他林焦磷酸铜法:奥司他林焦磷酸铜法是一种连续测定铅(Pb)和铋(Bi)混合液中Pb 和Bi 含量的常用方法。
原理是在指定pH 值下将Pb 和Bi 与奥司他林(Cu)及其络合物(焦磷酸铜)一起反应,从而产生复杂配合物,进而测定混合液中Pb 和Bi 的浓度。
实验中,首先在相同体积的混合液中预先加入滴定用的奥司他林水溶液,然后用少量的有机溶剂(Thl0)调节 pH 值,再加入一定量的焦磷酸铜,当pH 值接近7 时勾兑,做滴定,看吸光度最大值是否相等,如相等,则铅铋混合液中Pb 和Bi 的比值可由全量计算出来。
具体实验程序如下:(1)准备实验材料:Pb(II)、Bi(III)的溶液、奥司他林水溶液、Th10有机溶剂以及焦磷酸铜。
(2)在指定体积的混合液中加入适量的奥司他林水溶液,并调节pH值至7左右(这是必须的)。
(3)加入一定量的焦磷酸铜,直至出现勾兑状态,注意温度要控制在20℃—25℃之间。
(4)在滴定过程中用吸光度仪定期采集数据,并将所得结果写入报告中。
(5)在滴定过程中监测颜色变化,观察消耗液液面贴近瓶口,以确保所得结果的准确性。
(6)根据所得结果,得出铅铋混合液中Pb 和Bi 的浓度,以及 Pb 和Bi 的比值。
进行铅铋混合液的连续测定时,应采取的安全防护措施有:(1)实验时要佩戴安全眼镜和专业实验服,禁止吸烟和饮酒;(2)实验期间要注意化学品的相容性,不要将化学品混合使用;(3)在实验室通风良好,光线明亮;(4)实验室环境要保持干净,定期清扫;(5)要保证操作者的手部及嘴部卫生,以免受化学物质的污染;(6)操作时,要正确有序地放置器皿,动作要细心、安静,不要冲击;(7)在实验室中不要点火,禁止随意摆放有可燃物;(8)实验室里不要进食,以免污染实验样;(10)秩序清洁的工作台和仪器保持洁净,及时清理、定期检查,以确保可靠的结果。