高考化学一轮复习 第15讲 元素周期律与元素周期表作业
- 格式:doc
- 大小:282.50 KB
- 文档页数:10

江苏省苏州市高考化学一轮基础复习:专题15 元素周期表和元素周期律姓名:________ 班级:________ 成绩:________一、单选题 (共8题;共16分)1. (2分)砷为第四周期ⅤA族元素,依据它在周期表中的位置,推测砷不可能具有的性质是()A . 砷在通常状况下是固体B . 砷常见的化合价有-3、+3、+5C . 砷的最高价氧化物的水化物砷酸(H3AsO4)的酸性比磷酸(H3PO4)弱D . 砷化氢(AsH3)不如NH3稳定,还原性比NH3弱2. (2分)四种短周期元素在周期表中的位置如图,其中只有M为金属元素。
下列说法错误的是()A . 原子半径Z<MB . Y的最高价氧化物对应水化物的酸性比X的弱C . X的最简单气态氢化物的热稳定性比Z的弱D . Z位于元素周期表中第二周期、第ⅥA族3. (2分)(2018·太原模拟) X、Y、Z、W是原子序数依饮增大的四种短周期元素,A、B、C、D、F是由其中的两种或三种元素组成的化合物,E是由元素Z形成的单质,0.1mol/LD溶液的pH=13(25℃)。
它们满足如图转化关系,则下列说法正确的是()A . 元素Z的最高正价为+6B . F中含有共价键和离子键C . 常温下,X、Y、Z、W四种元素组成的盐溶液的pH一定小于7D . 0.1molB与足量C完全反应共转移电子数为0.2×6.02×10234. (2分)(2018·宜宾模拟) 短周期元素R、T、Q、W在周期表中的相对位置如图所示,其中Q原子的质子数是其最外层电子数的三倍。
下列说法正确的是()A . 原子半径:R>TB . 氧化物对应水化物的酸性:W>QC . 最简单气态氢化物的热稳定性:R>QD . Q与W形成的化合物中,各原子的最外层都满足8电子稳定结构5. (2分)某元素X气态氢化物与该元素最高价氧化物的水化物反应生成盐,则该元素不可能具有的性质是()A . 在周期表中处于第3周期 VIIAB . 在周期表中处于第2周期VA族C . 氢化物比PH3稳定D . 常见化合价有﹣3、+2、+3、+5价6. (2分) (2017高二下·驻马店期末) 现有三种元素的基态原子的电子排布式:①1s22s22p63S23p4;②1s22S22P63s23P3;(B)1s22s22p5。

课时作业15元素周期表元素周期律一、单项选择题(本题包括6个小题,每小题只有1个选项符合题意)1.硒是人体必需的微量元素,如图是硒在周期表中的信息,关于硒元素的说法错误的是()A.位于第四周期B.质量数为34C.原子最外层有6个电子D.相对原子质量为78.962.下列说法正确的是()A.元素周期表每一周期元素原子的最外层电子排布均是从n s1过渡到n s2n p6B.所有的非金属元素都分布在p区C.原子核外电子排布式为1s1的原子与原子核外电子排布式为1s22s1的原子的化学性质相同D.元素周期表中ⅢB到ⅡB的10个纵行的元素都是金属,所以统称为过渡金属元素3. B和Al为同族元素,下列说法错误的是()A.BF3和AlF3都可以与F-形成配位键B.H3BO3为三元酸,Al(OH)3呈两性C.共价键的方向性使晶体B有脆性,原子层的相对滑动使金属Al有延展性D.B和Al分别与N形成的共价晶体,均具有较高硬度和熔点4.如图是第三周期11~17号元素某些性质变化趋势的柱形图,下列有关说法中正确的是()A.y轴表示的可能是第一电离能B.y轴表示的可能是电负性C.y轴表示的可能是原子半径D.y轴表示的可能是形成基态离子转移的电子数5.元素周期表是安置元素的一座“大厦”,已知原子的下列结构或性质,能确定其在周期表中的“单元号和房间号”即位置的是()A.某元素原子的第二电子层电子轨道表示式为B.某元素在某种化合物中的化合价为+4C.某元素的原子最外层上电子数为6D.某元素的原子价层电子排布式为5s25p16.Goodenough等人因在锂离子电池及钴酸锂、磷酸铁锂等正极材料研究方面的卓越贡献而获得2019年诺贝尔化学奖。
下列说法正确的是()A.基态Fe2+与Fe3+中未成对的电子数之比为6∶5B.同一周期中,第一电离能:I1(B)>I1(Be)>I1(Li)C.第一电离能:I1(Li)>I1(Na),原因是Na的电子层数多,原子半径大D.Co位于元素周期表中的ds区二、不定项选择题(本题包括4个小题,每小题有1个或2个选项符合题意)7.下列说法不正确的是()A.某价电子排布式为4f75d16s2的基态原子,该元素位于周期表中第六周期第ⅢB族B.在元素周期表中,s区、d区和ds区的元素都是金属元素C.当碳原子的核外电子排布由转变为时,释放能量,由激发态转化成基态D.非金属元素形成的共价化合物中,原子的最外层电子数不一定是2或88.现有三种元素的基态原子的电子排布式如下:①1s22s22p63s23p4;②1s22s22p63s23p3;③1s22s22p5。

元素周期表元素周期律一、元素周期表1.原子序数按照元素在周期表中的顺序给元素所编的序号。
原子序数=质子数=核电荷数=核外电子数。
2.元素周期表的编排原则(1)周期:按原子序数递增顺序从左到右排列,把电子层数相同的元素排成一横行。
(2)族:把不同横行中最外层电子数相同的元素,按电子层数递增的顺序从上到下排成一纵行。
3.元素周期表的结构(1)周期(7个横行,7个周期)。
短周期长周期序号 1 2 3 4 5 6 7元素种28818183232数0族元素21018365486118(2)族(18个纵行,16个族)。
【微点拨】1.在周期表中,同一列元素的原子最外层电子数不一定相等,如0族氦原子最外层2个电子,其余最外层8个电子;2.在短周期中,第ⅡA族和第ⅢA族不相邻。
二、元素周期律1.定义元素的性质随着原子序数的递增而呈周期性变化的规律。
2.实质元素原子核外电子排布的周期性变化。
3.同主族元素性质的递变规律(1)对于元素Li、Na、K。
①原子半径由小到大的顺序为Li<Na<K;②金属性由强到弱的顺序为K>Na>Li;③单质与水反应的剧烈程度由强到弱的顺序为K>Na>Li;④最高价氧化物对应水化物的碱性由强到弱的顺序为KOH>NaOH>LiOH。
(2)对于元素Cl、Br、I。
①原子半径由小到大的顺序为Cl<Br<I;②非金属性由强到弱的顺序为Cl>Br>I;③单质与氢气化合由易到难的顺序为Cl2>Br2>I2;④其氢化物的稳定性由弱至强的顺序为HI<HBr<HCl;⑤最高价氧化物对应水化物的酸性由弱至强的顺序为HIO4<HBrO4<HClO4。
4.同周期元素性质的递变规律现有元素:Na、Mg、Al、S、Cl。
(1)五种元素的原子半径由大到小的顺序为Na>Mg>Al>S>Cl。

元素周期律和元素周期表1.短周期主族元素X、Y、Z、W原子序数依次增大,X原子的最外层有6个电子,Y是迄今发现的非金属性最强的元素,在周期表中Z位于ⅠA族,W与X属于同一主族。
下列说法正确的是()A.元素X、W的简单阴离子具有相同的电子层结构B.由Y、Z两种元素组成的化合物是离子化合物C.W的简单气态氢化物的热稳定性比Y的强D.原子半径:r(X)<r(Y)<r(Z)<r(W)解析X为ⅥA族元素,由原子序数关系可知为氧元素,Y为氟元素,Z为钠元素,W为硫元素。
O2-为10e-,S2-为18e-,电子层结构不同,A错误;NaF为活泼金属与活泼非金属形成的离子化合物,B正确;氟的非金属性强,气态氢化物更稳定,C错误;原子半径:Na>S>O>F,D错误。
答案 B2.下列有关性质的比较,不能..用元素周期律解释的是()A.酸性:H2SO4>H3PO4B.非金属性:Cl>BrC.碱性:NaOH>Mg(OH)2D.热稳定性:Na2CO3>NaHCO3解析A项,同周期元素自左向右其最高价氧化物对应水化物酸性增强,酸性:H2SO4>H3PO4,能用元素周期律解释;B项,同主族元素自上而下非金属性逐渐减弱,非金属性Cl >Br,能用元素周期律解释;C项,同周期元素自左向右其最高价氧化物对应水化物碱性减弱,碱性:NaOH>Mg(OH)2,能用元素周期律解释;D项,碳酸盐的热稳定性大于其碳酸氢盐的热稳定性,如热稳定性:Na2CO3>NaHCO3,与元素周期律无关。
答案 D3.短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示。
已知Y、W的原子序数之和是Z的3倍,下列说法正确的是()A.原子半径:X<Y<ZB.气态氢化物的稳定性:X>ZC.Z、W均可与Mg形成离子化合物D.最高价氧化物对应水化物的酸性:Y>W解析由题意可知,短周期元素X、Y、Z、W分别位于2、3周期,设Z的原子序数为x,则Y、W的原子序数分别为x-1、x+9,则有x-1+x+9=3x,解得x=8,则元素X、Y、Z、W分别为Si 、N 、O、Cl。
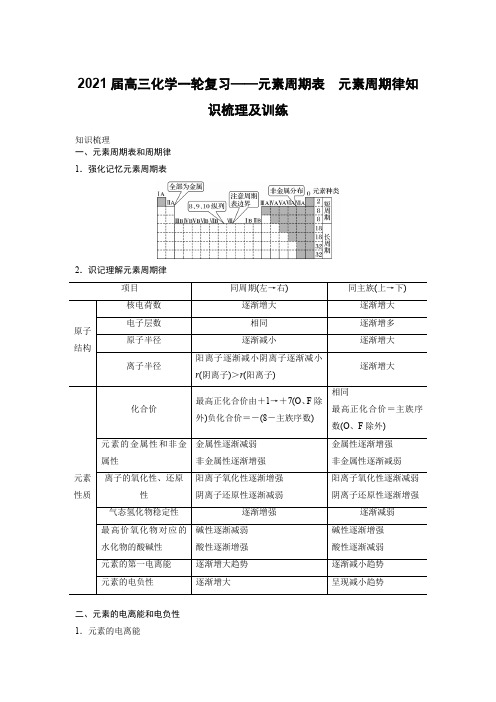
2021届高三化学一轮复习——元素周期表元素周期律知识梳理及训练知识梳理一、元素周期表和周期律1.强化记忆元素周期表2.识记理解元素周期律项目同周期(左→右)同主族(上→下)原子结构核电荷数逐渐增大逐渐增大电子层数相同逐渐增多原子半径逐渐减小逐渐增大离子半径阳离子逐渐减小阴离子逐渐减小r(阴离子)>r(阳离子)逐渐增大元素性质化合价最高正化合价由+1→+7(O、F除外)负化合价=-(8-主族序数)相同最高正化合价=主族序数(O、F除外)元素的金属性和非金属性金属性逐渐减弱非金属性逐渐增强金属性逐渐增强非金属性逐渐减弱离子的氧化性、还原性阳离子氧化性逐渐增强阴离子还原性逐渐减弱阳离子氧化性逐渐减弱阴离子还原性逐渐增强气态氢化物稳定性逐渐增强逐渐减弱最高价氧化物对应的水化物的酸碱性碱性逐渐减弱酸性逐渐增强碱性逐渐增强酸性逐渐减弱元素的第一电离能逐渐增大趋势逐渐减小趋势元素的电负性逐渐增大呈现减小趋势二、元素的电离能和电负性1.元素的电离能第一电离能:气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量叫做第一电离能。
常用符号I1表示,单位为kJ·mol-1。
(1)原子核外电子排布的周期性随着原子序数的增加,主族元素原子的外围电子排布呈现周期性的变化:每隔一定数目的元素,主族元素原子的外围电子排布重复出现从n s1到n s2n p6的周期性变化(第一周期除外)。
(2)元素第一电离能的周期性变化随着原子序数的递增,元素的第一电离能呈周期性变化:同周期从左到右,第一电离能有逐渐增大的趋势,稀有气体的第一电离能最大,碱金属和氢的第一电离能最小;同主族从上到下,第一电离能有逐渐减小的趋势。
说明同周期元素,从左到右第一电离能呈增大趋势。
同能级的轨道为全满、半满时第一电离能较相邻元素要大,即第ⅡA族、第ⅤA族元素的第一电离能分别大于同周期相邻元素。
如Be、N、Mg、P。
(3)元素电离能的应用①判断元素金属性的强弱电离能越小,金属越容易失去电子,金属性越强;反之,则越弱。

考点规范练15 元素周期表 元素周期律(时间:45分钟 满分:100分)一、选择题(本题共10小题,每小题5分,共50分。
每小题只有一个选项符合题目要求)1.下列关于113号元素(Nh)、115号元素(Mc)、117号元素(Ts)和118号元素(Og)的说法正确的是( )。
A.113号元素的氧化物为两性氧化物B.115号元素位于第六周期第ⅤA 族C.117号元素的某种原子,核内含176个中子,此原子是 117176Ts 号元素的原子最外层有8个电子项,同主族元素从上到下金属性逐渐增强,113号元素的金属性远远强于铝元素的,其氧化物不;B 项,115号元素位于第七周期第ⅤA 族;C 项,117号元素的某种原子,核内含176个中子,此原子是 117293Ts;D 项,118号元素位于第七周期0族,原子最外层有8个电子。
2.(2020全国Ⅰ改编)1934年约里奥-居里夫妇在核反应中用α粒子(即氦核 24He)轰击金属原子 Z W X,得到核素 Z+2 30Y,开创了人造放射性核素的先河:Z W X+24He Y +01n其中元素X 、Y 的最外层电子数之和为8。
下列叙述正确的是( )。
A .Z W X 的相对原子质量为26B.X 、Y 均可形成三氯化物C.X 的原子半径小于Y 的原子半径,可确定W =27。
根据X 、Y 的最外层电子数之和为8,Y 原子的质子数比2,可以得出X 原子最外层电子数为3,Y 原子最外层电子数为5,可以判定X 为铝元素,Y 为磷元素。
由上述分析可知A 项错误;Al 、P 两元素均可形成三氯化物AlCl 3和PCl 3,B 项正确;Al 、P 两元素位于同一周期且原子序数P 大于Al,故原子半径Al 大于P,C 项错误;磷元素的常见含氧酸有H 3PO 4、H 3PO 2、HPO 2,D 项错误。
3.X 、Y 、Z 、W 四种元素在元素周期表中的相对位置如图所示,Y 、Z 的质子数之和为21,下列说法正确的是( )。
2014届高三一轮达标作业(有详解)15 元素周期律一、选择题(本题共10个小题,每小题5分,共50分)1.(2012·山东高考)下列关于原子结构、元素性质的说法正确的是()A.非金属元素组成的化合物中只含共价键B.ⅠA族金属元素是同周期中金属性最强的元素C.同种元素的原子均有相同的质子数和中子数D.ⅦA族元素的阴离子还原性越强,其最高价氧化物对应水化物的酸性越强2.下列各组物质性质比较中,正确的是()A.氢化物的沸点:HI>HBr>HCl>HFB.离子的半径:K+>Cl->S2-C.分子的稳定性:HF>HCl>HBr>HID.单质的熔点:Li<Na<K<Rb解析:A项中HF分子间含有氢键,其沸点反常;B项中半径由大到小为S2->Cl->K+;C项正确;D项中单质熔点由高到低顺序为Li>Na>K>Rb。
答案:C3.(2013·南昌模拟)现有四种短周期元素的原子半径及主要化合价数据如下表所示元素甲乙丙丁原子半径/nm 0.186 0.102 0.152 0.074主要化合价+1 +6、-2 +1 -2下列叙述不.正确的是()A.甲单质的熔点比丙单质的熔点高B.甲单质可用电解其熔融盐的方法冶炼而得C.常温下,丁的两种氢化物均为液体D.乙的简单离子是四种元素各自形成的简单离子中半径最大的解析:由主要化合价及原子半径知丁为氧元素,乙为硫元素,甲为钠元素,丙为锂元素。
金属熔点同主族从上到下逐渐减小,故A错;可用电解熔融NaCl的方法制备钠,B正确;常温下H2O、H2O2均为液体,C正确;S2-的半径是四种简单离子中最大的,D正确。
答案:A4.X、Y、Z、W均为短周期元素,它们在元素周期表中相对位置如图所示。
若Z原子的最外层电子数是第一层电子数的3倍,下列说法中正确的是() A.X的最常见气态氢化物的水溶液显酸性B.最高价氧化物对应水化物的酸性W比Z强C.Z的单质与氢气反应较Y剧烈D.X的原子半径小于Y5.(2013·中原模拟)某同学在研究前18号元素时发现,可以将它们排成如下图所示的“蜗牛”形状,图中每个弧线上的“·”代表一种元素,其中O点代表氢元素。
元素周期律和元素周期表(精练)完卷时间:50分钟一、选择题(每小题只有一个正确选项,共12*5分)1.(2020年全国统一考试化学试题(新课标Ⅲ))W、X、Y、Z为原子序数依次增大的短周期元素,四种元素的核外电子总数满足X+Y=W+Z;化合物XW3与WZ相遇会产生白烟。
下列叙述正确的是A.非金属性:W> X>Y> Z B.原子半径:Z>Y>X>WC.元素X的含氧酸均为强酸D.Y的氧化物水化物为强碱【答案】D【解析】根据题干信息可知,W、X、Y、Z为原子序数依次增大的短周期元素,化合物XW3与WZ相遇会产生白烟,则WX3为NH3,WZ为HCl,所以W为H元素,X为N元素,Z为Cl元素,又四种元素的核外电子总数满足X+Y=W+Z,则Y的核外电子总数为11,Y为Na元素。
根据上述分析可知,W为H元素,X为N元素,Y 为Na元素,Z为Cl元素,则A.Na为金属元素,非金属性最弱,非金属性Y<Z,A选项错误;B.同周期元素从左至右原子半径依次减小,同主族元素至上而下原子半径依次增大,则原子半径:Na>Cl>N>H,B 选项错误;C.N元素的含氧酸不一定全是强酸,如HNO2为弱酸,C选项错误;D.Y的氧化物水化物为NaOH,属于强碱,D选项正确;答案选D。
2.(北京市2020年普通高中学业水平等级性考试)已知:33As(砷)与P为同族元素。
下列说法不正确的是A.As原子核外最外层有5个电子B.AsH3的电子式是C.热稳定性:AsH3<PH3D.非金属性:As<Cl【答案】B【解析】A.As与P为同族元素,为VA族元素,则其原子核外最外层有5个电子,A说法正确;B.AsH3属于共价化合物,电子式与氨气相似,为,B说法不正确;C.非金属的非金属性越强,其气体氢化物越稳定,非金属性As<P,热稳定性:AsH3<PH3,C说法正确;D.同周期元素,原子序数越小,非金属性越强,非金属性:As<Cl,D说法正确;答案为B。
元素周期表和元素周期律1.短周期元素甲、乙、丙、丁的原子半径依次增大,其氢化物中甲、乙、丙、丁的化合价如表所示。
下列说法中正确的是( )A.B.元素非金属性:甲<乙C.氢化物的沸点:甲>丁D.丙所形成的单质可能互为同位素1.解析:根据元素周期律中的原子半径规律和化合价规律判断甲是氧元素,乙是氮元素,丙是碳元素,丁是硫元素,N的含氧酸有HNO2、HNO3,S的含氧酸有H2SO3、H2SO4,酸性强弱无法判断,A项错误;O的非金属性大于N的非金属性,B项错误;H2O的沸点大于H2S 的沸点,C项正确;C的单质可能为同素异形体,同位素是同种元素不同原子的互称,D项错误。
答案:C2.下表为几种短周期元素的性质:(10-1nm) 最高或最低化合价-2 +2 +1+5-3+7-1+1+5-3+3A.元素④的原子序数小于元素⑦的原子序数B.②、③处于同一周期C.上述八种元素中,最高价氧化物对应水化物酸性最强的元素是⑤D.⑧号元素原子结构示意图为:2.解析:①~⑧都为短周期元素,①有最低价-2价,处于ⅥA 族,没有最高价,则①为O;④、⑦都有最低价-3价,最高价+5价,处于ⅤA族,且④的原子半径较大,则④为P、⑦为N;⑤有+7、-1价,处于ⅦA族,且原子半径比①大,则⑤为Cl;③、⑥都有+1价,处于ⅠA族,⑥的原子半径较大,且③不是所有元素中原子半径最小的元素,则③为Li、⑥为Na;②有+2价,处于ⅡA族,原子半径大于Li,则②为Mg。
⑧有+3价且原子半径比O大,比P小,则⑧为B。
④为P、⑦为N,P的原子序数大于N,故A项错误;②为Mg,③为Li,二者为不同周期的元素,B项错误;⑤为Cl,八种元素中,元素的非金属性最强,其最高价氧化物对应水化物的酸性最强,C项正确;⑧为B,其原子序数为5,D项错误。
答案:C3.X、Y、Z、W四种短周期主族元素,原子序数依次增大,其中X的简单气态氢化物可与其最高价含氧酸反应生成离子化合物,Y与Z同主族,W的最高价含氧酸是同周期元素中最强的无机酸。
第15讲元素周期律与元素周期表A组基础题组1.(2018北京西城期末)下列事实不能..用元素周期律解释的是( )A.酸性:HClO4>H2SO3B.碱性:NaOH>Mg(OH)2C.气态氢化物的稳定性:H2O>H2SD.Cl2从NaBr溶液中置换出Br22.(2017北京朝阳一模,7)下列有关性质的比较,用元素周期律解释的是( )A.金属性:Na>MgB.酸性:H2SO4>H2SiO3C.稳定性:HCl>HBrD.同浓度溶液的碱性:Na2CO3>NaHCO33.(2018北京东城期末)下列说法正确的是( )A.Si、P、S、Cl原子半径依次增大B.HF、HCl、HBr、HI稳定性依次减弱C.C、N、O、F元素的最高正化合价依次升高D.NaOH、Mg(OH)2、Al(OH)3碱性依次增强4.(2017北京大兴一模,10)四种短周期主族元素W、X、Y、Z的原子序数依次增大,W、X的简单离子具有相同电子层结构,X的原子半径在短周期主族元素原子中最大,Y的核外电子数是W的2倍且同主族。
下列说法不正确...的是( )A.简单离子半径:X<W<ZB.W、X、Y元素形成的盐溶于水,溶液一定呈中性C.W与X形成的常见化合物中阴、阳离子个数比均为1∶2D.1 mol Z的单质与足量的NaOH溶液反应转移电子数为N A5.(2018北京朝阳期末)根据元素周期律,由下列事实进行归纳推测,推测不合理...的是( )6.(2017北京房山期末,23)四种短周期元素X 、Y 、Z 、W 的部分信息如下表:据此回答以下问题:(1)Y 元素在周期表中的位置是 ,其单质的电子式是 ; (2)W 最低价氢化物的水溶液呈弱酸性,其原因用化学用语解释是 ;(3)X 、Y 、Z 组成的某种盐的水溶液的pH<7,其原因用化学用语解释是 ,在该溶液中各种离子浓度的大小关系是 ;(4)用适当催化剂及电极材料,以HCl-NH 4Cl 溶液为电解质溶液,构成如图所示的新型电池。
Ⅰ.该电池的正极反应式是 ;Ⅱ.分离出物质A的化学式是。
7.(2017北京海淀期中,15)W、X、Y、Z是原子序数依次增大的四种短周期元素。
W的气态氢化物能使紫色石蕊溶液变蓝,W和X两种元素的最高价氧化物的水化物均能与Y的氢氧化物发生反应,W、X、Y、Z的最外层电子数之和为16。
(1)W单质的电子式是。
(2)请用化学用语解释W的气态氢化物能使紫色石蕊溶液变蓝的原因: 。
(3)已知As元素的原子序数为33,与W在同一主族,As在元素周期表中的位置是。
(4)W的最高价氧化物的水化物与Y的氢氧化物发生反应的离子方程式是。
(5)X与Z的单质之间发生反应的化学方程式是。
(6)已知Q与Z是位于相邻周期的同主族元素。
某温度下,两种元素的气态单质与H2发生化合反应生成气态氢化物的平衡常数分别为K Q=5.6×107,K Z=9.7×1012。
Q的元素符号是,理由是。
B组提升题组8.(2017北京怀柔零模,8)X、Y、Z为短周期元素,电子层数相同,原子序数依次增大,三种元素的最高价氧化物对应的水化物两两之间均可发生反应。
下列说法中正确的是( )A.原子半径:Z>Y>XB.X的最高价氧化物对应的水化物中只含有共价键C.X、Z形成的化合物一定为离子化合物D.工业上常用Y的氯化物为原料制取单质Y9.(2017北京朝阳期中,9)短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中Y原子的最外层电子数是其电子层数的3倍。
下列说法正确的是( )A.Y和Z的最高正化合价相同B.气态氢化物的热稳定性:XH3<H2Y<H2ZC.原子半径的大小:r(W)>r(Y)>r(Z)D.W的最高价氧化物对应水化物的酸性比Z的强10.(2017北京海淀期中,9)X、Y、Z、M、R为五种短周期元素,其原子半径和最外层电子数之间的关系如下图所示。
下列说法不正确...的是( )A.简单阳离子半径:X<RB.最高价含氧酸的酸性:Z<YC.M的氢化物常温常压下为气体D.X与Y可以形成正四面体结构的分子11.(2017北京海淀一模,8)某温度时,ⅥA元素单质与H2反应生成气态H2X的热化学方程式如下:O2(g)+H2(g) H2O(g) ΔH=-242 kJ·mol-1S(g)+H2(g) H2S(g) ΔH=-20 kJ·mol-1Se(g)+H2(g) H2Se(g) ΔH=+81 kJ·mol-1下列说法正确的是( )A.稳定性:H2O<H2S<H2SeB.降温有利于Se与H2反应生成H2SeC.O2(g)+2H2S(g) 2H2O(g)+2S(g) ΔH=-444 kJ·mol-1D.随着核电荷数的增加,ⅥA族元素单质与H2的化合反应越容易发生12.(2017北京石景山一模,8)X、Y、Z、W为短周期元素,X2-和Y+核外电子排布相同,X、Z位于同一主族,Z、W位于同一周期,W的最外层电子数是X、Y的最外层电子数之和。
下列说法的是( )A.原子半径:Y>Z>XB.X分别与Y、Z形成的化合物均至少有两种C.最高价氧化物对应水化物的酸性:W>ZD.氢元素在其与X、Y、Z分别形成的化合物中,化合价均为+113.(2018北京海淀期末,7)四种短周期主族元素W、X、Y、Z的原子序数依次增大,W元素的最外层电子数是其电子层数的二倍;X的原子半径是短周期主族元素原子中最大的;Y是地壳中含量最多的金属元素;X与Z形成的离子化合物的水溶液呈中性。
下列实验操作对应的实验现象中,不正确...的是( )14.(2017北京西城二模,8)下列事实用元素周期律解释的是( )A.酸性:HClO4>H2SO4B.Na、Mg与水反应,Na更剧烈C.气态氢化物的稳定性:HF>HClD.向Na2SO3溶液中加盐酸,有气泡产生15.(2017北京西城期末,12)4种短周期元素在周期表中的相对位置如下图所示,Y元素原子最外层电子数是其电子层数的3倍。
下列说法中,正确的是( )A.X的氢化物可用作制冷剂B.Y与氢元素形成的物质中只含有极性共价键C.4种元素中原子半径最大的是WD.4种元素中Z的最高价氧化物对应水化物的酸性最强16.X、Y、Z是同周期的短周期元素,原子序数依次增大。
Y为地壳中含量最高的金属元素,且X、Y、Z的最高价氧化物对应水化物两两之间可以相互反应。
(1)Y元素在周期表中的位置是。
(2)X、Y的最高价氧化物对应水化物之间发生反应的离子方程式是。
(3)Z与碳和氟可组成氟利昂CZ3F,它在紫外线作用下破坏臭氧层的反应过程如下:①CZ3F CZ2F·+Z·②Z·+O3 O2+ZO·③ZO·+O·Z·+O2反应①中破坏的化学键属于(填“极性”或“非极性”)共价键;臭氧转化(O3+ O· 2O2)的催化剂是。
(4)下列说法正确的是(选填字母)。
a.X与氧可形成碱性氧化物b.常温下与水反应的难易可证明金属性X>Yc.Z元素单质的水溶液中,Z的存在形式只有Z2和Z-d.X、Y、Z形成的简单离子的半径由大到小的顺序为X+>Y3+>Z-(5)Y、石墨与含YC的离子液体可构成充电电池,其工作原理如图所示:充电时石墨电极与外加电源的(填“正”或“负”)极相连;放电时的负极反应式是。
答案精解精析A组基础题组1.A A项,非金属元素的非金属性越强,最高价氧化物对应的水化物酸性越强,亚硫酸中硫元素的化合价为+4价,不是最高价;B项,金属元素的金属性越强,最高价氧化物对应的水化物碱性越强,由于钠的金属性强于镁,所以NaOH的碱性强于Mg(OH)2;C项,非金属元素的非金属性越强,气态氢化物的稳定性越强,由于氧元素的非金属性强于硫元素,所以水的稳定性强于硫化氢;D项,非金属元素的非金属性越强,单质的氧化性越强,由于氯气的氧化性强于溴单质,所以氯气可以与溴化钠反应置换出溴单质。
2.D A项,同周期主族元素随着原子序数的递增金属性递减,故金属性:Na>Mg;B项,元素非金属性越强,最高价氧化物的水化物的酸性越强,S的非金属性强于Si,故酸性:H2SO4>H2SiO3;C项,元素非金属性越强,其气态氢化物的稳定性越强,Cl的非金属性强于Br,故稳定性:HCl>HBr;D项,相同浓度时,碳酸钠溶液的碱性强于碳酸氢钠溶液,是因为碳酸钠的水解程度大于碳酸氢钠,与元素周期律无关。
3.B A项,同一周期元素,从左往右原子半径逐渐减小,故Si、P、S、Cl原子半径依次减小;B项,元素的非金属性越强,气态氢化物的稳定性越强,故HF、HCl、HBr、HI稳定性依次减弱;C项,F元素无正价;D项,元素的金属性越强,最高价氧化物对应水化物的碱性越强,故NaOH、Mg(OH)2、Al(OH)3碱性依次减弱。
4.B X的原子半径在短周期主族元素原子中最大,则X是Na元素;Y的核外电子数是W的2倍且同主族,则W是O元素、Y是S元素;主族元素W、X、Y、Z的原子序数依次增大,则Z是Cl元素。
A项,简单离子半径:Na+<O2-<Cl-;B项,Na2SO3溶液呈碱性;C项,Na与O形成的常见化合物为氧化钠、过氧化钠,其中阴、阳离子个数比均为1∶2;D项,氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,1 mol氯气参与反应转移电子数为N A。
5.D D项,碳元素在元素周期表中位于第二周期ⅣA族,石墨易导电,是导体。
6.答案(1)第二周期ⅤA族∶N⋮⋮N∶(2)H 2S H++HS-(3)N+H 2O NH3·H2O+H+c(N)>c(N)>c(H+)>c(OH-)(4)N 2+8H++6e-2N NH4Cl解析由表中信息可知,X为H,Y为N,Z为O,W为S。
(1)Y为N元素,位于周期表中第二周期ⅤA族,其单质的电子式为∶N⋮⋮N∶;(2)W为S,对应的氢化物为H 2S,其为弱酸,在水溶液中部分电离,电离方程式为H2S H++HS-;(3)X、Y、Z组成的某种盐的水溶液的pH<7,则对应的盐为硝酸铵,其为强酸弱碱盐,N水解使其呈酸性,水解方程式为N+H 2O NH3·H2O+H+;溶液中离子浓度大小关系为c(N)>c(N)>c(H+)>c(OH-); (4)氮气在正极获得电子,酸性条件下生成N,电极反应式为N 2+8H++6e-2N。
7.答案(1)∶N⋮⋮N∶(2)NH 3+H2O NH3·H2O N+OH-(3)第四周期第ⅤA族(4)3H++Al(OH)3 Al3++3H2O(5)2Na+Cl2 2NaCl(6)Br 由K Q<K Z可知Q的气态氢化物的稳定性弱于Z,故Q的非金属性弱于Z解析由题意知,W为N,X为Na,Y为Al,Z为Cl。