人教版第一册必修高中化学元素周期表
- 格式:doc
- 大小:80.50 KB
- 文档页数:4




统编人教版高中化学必修第一册《第一节原子结构与元素周期表》优质课公开课课件、教案1. 核外电子排布的表示方法(1)原子结构示意图①小圆圈和圆圈内的符号及数字表示原子核及核内质子数。
②弧线表示电子层。
③弧线内数字表示该层中的电子数。
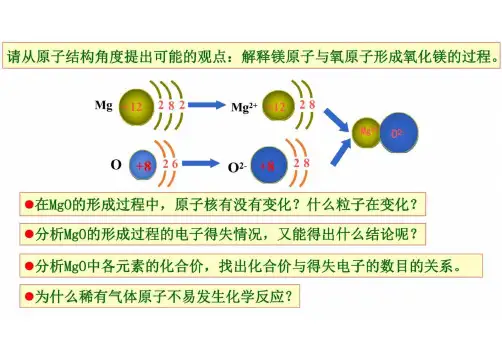
(2)离子结构示意图①当主族中的金属元素原子失去最外层所有电子变为离子时,电子层数减少一层,形成与少一个电子层的稀有气体元素原子相同的电子层结构。
②非金属元素的原子得电子形成简单离子时,形成与电子层数相同的稀有气体元素原子相同的电子层结构1.下列表示物质结构的化学用语或模型正确的是A.HF的电子式:B.O的核外电子排布:分子的球棍模型:C.S2-离子的结构示意图:D.CH4【答案】B【解析】A、HF为共价化合物,电子式为,故A错误;B、O为8号元素,核外有8个电子,其中第一层有2个电子,第二层有6个电子,核外电子排布为故B正确;C、S为16号元素,核内有16个质子,S2-离子的结构示意图为,故C错误;D、为甲烷的比例模型,CH4分子的球棍模型为,故D错误;答案选B。
2、明确几个量的关系(1)质量数(A)=质子数(Z)+中子数(N),质量数可近似地代替原子的相对原子质量。
(2)原子的核外电子总数=质子数=核电荷数=原子序数。
(3)阳离子M n+的核外电子数=质子数-n;阴离子N n-的核外电子数=质子数+n。
2.某物质H2RO3分子中共有x个电子,R原子的质量数为A,则R原子核内含有_______个质子,________个中子。
【答案】x-26 A-x+26【分析】根据分子中各种元素的原子核外电子数的和等于总电子数,原子核外电子数等于其原子核内质子数,原子的质量数等于其质子数与中子数的和计算。
【详解】H原子核外只有1个电子,O原子核外有8个电子,则根据H2RO3分子中共有x个电子,可得该物质分子中R原子核外电子数为(x-1)×2-8×3=x-26;由于原子的质量数等于其质子数与中子数的和,R原子的核外电子数等于x-26,则其原子核内质子数也等于x-26,其质量数为A,故该原子核内中子数为A-( x-26)= A-x+26。



元素周期表说课稿一、说教材教材内容与地位:“元素周期表”是新人教版高中化学必修教材(第一册)第四章第一节第二课时的内容。
课程标准要求学生“认识原子结构、元素性质与元素在元素周期表中位置的关系”。
元素周期表、表中元素信息及元素周期律内容描述等都属于元素周期表(律)的表层知识。
元素周期表作为元素周期律的表征模型,元素周期表(律)的本质在于科学家们建立了基于元素原子结构周期表位置元素性质之间的关系的系统模型,反映了不同元素之间的内在联系教学目标:(1)通过分析未知元素卡片上各个元素的信息,建立族和周期的位置变量在不同元素的原子结构和元素性质之间的关联,寻找元素周期表的编排原则,初步建构元素周期表模型。
(2)通过评价不同编排原则,指出所建模型的局限性,优化模型,体会门捷列夫元素周期表模型建立的本质。
(3)通过猜测未知元素的质子数并绘制原子结构示意图,应用原子结构解释元素性质及其变化规律,认识原子结构以及元素在元素周期表中的位置关系,从核外电子排布的角度理解元素周期表周期、族、元素、核素和同位素的含义。
(4)通过应用模型给未知元素定位,熟悉元素周期表的结构,能运用元素周期表的结构分析、推知元素的位置,用周期和族的符号表征元素在周期表中的位置。
实现元素周期表模型中“位-构-性”3者之间的相互关联和推理。
教学重难点:1.元素周期表的发展历史2.元素周期表的结构3.核素、同位素的定义二、说教法目前教学实践中,大部分教师只是关注元素周期表的表层知识,制作元素周期表的教学活动对象一般为学生熟知的前20号元素,编排原则大多是通过分析原子结构示意图或化学史直接获得,信息单一易得。
教学活动中既没有体现元素周期表模型建构中的科学思维的变化,也没有揭示建构历程中的科学本质。
教学过程中缺乏对元素周期表知识的深层含义的挖掘,对元素周期表模型演变过程中的教育价值体现不够。
元素周期表模型的生成和完善经历160余年,其中不乏各式各样的尝试与归纳,故本节课尝试基于建模思想来进行教学,着重围绕模型的生成性和变化性等2个维度,通过建模实践活动发展学生对元素周期表模型的认知,让学生关注模型建立过程中科学思维的发展,理解元素周期表模型建立的本质。



(新)高一化学必修一化学元素周期表(按章
节归纳)
第一章:绪论
- 科学研究的基本方法和手段
- 化学的定义和分类
- 化学元素及其符号的来源和命名
第二章:化学元素与元素周期表
- 原子的结构
- 元素的定义和分类
- 元素的周期性和周期表的构成
- 元素的分类和性质
第三章:周期律及元素周期表
- 元素周期律的发现
- 量子数和电子排布规律
- 元素的周期性规律和周期表的应用
- 周期表指标的解读和使用
第四章:原子结构与元素周期表
- 原子的结构和组成
- 原子半径的变化规律
- 原子的电离能和电子亲和能
第五章:化学键
- 化合价
- 共价键和离子键
- 价电子的变化
第六章:周期律与化学键
- 周期律与离子键能和晶体结构
- 周期律与共价键的极性和分子结构
第七章:离子及离子键
- 离子的定义和性质
- 离子键的性质和应用
第八章:元素周期表及化学键小结- 元素周期表的发展历程
- 难以归入现有分类的元素
- 化学键的研究方法和应用
这份文档按照《高一化学必修一》课本的章节归纳了化学元素周期表的相关内容。
通过学习这份文档,你将了解元素周期表的构成、元素的分类和性质、化学键的形成规律以及元素周期表在化学研究中的应用。
在学习化学的过程中,这份文档将会为你提供有关化学元素周期表的重要知识点和基本理论。
希望对你的学习有所帮助!。
第2课时元素周期表核素核心微网络素养新要求1.认识原子结构、元素性质以及元素在元素周期表中位置的关系。
2.知道元素周期表的结构。
3.知道元素、核素的含义。
学业基础——自学·思记·尝试一、元素周期表1.元素周期表的出现与演变2.原子序数(1)原子序数;按照元素在周期表中的顺序给元素的编号。
(2)原子序数与原子结构的关系:对于原子:原子序数=核电荷数=________=________。
3.元素周期表的编排原则4.元素周期表的结构5.认识元素周期表的相关信息元素周期表中每个格中的信息(以Fe为例):特别提醒(1)元素所在周期序数=原子的电子层数;主族元素所在族序数=原子的最外层电子数。
(2)族包括三种类型:主族、副族和0族。
主族元素的族序数后标A,如第ⅠA族;副族元素的族序数后标B(除了第Ⅷ族),如第ⅡB族。
(3)元素在周期表中的位置包括所在周期和族,二者缺一不可,如硫元素在元素周期表中位于第三周期第ⅥA族。
(4)稀有气体元素的原子最外层电子数为8(第一周期的氦最外层电子数为2),元素的化学性质不活泼,通常很难与其他物质发生化学反应,把它们的化合价定为0,因而叫作0族。
(5)元素周期表中从第ⅢB族到第ⅡB族,其中包括了第Ⅷ族,共10个纵列,全部是金属元素,统称为过渡元素。
(6)为了使元素周期表的结构美观,分别将第六、七周期的各15种元素统称为镧系元素(57~71号)、锕系元素(89~103号),镧系元素和锕系元素各占一格,并在元素周期表的下方单独列出。
(7)有些族的元素存在别称,如除氢外的第ⅠA族:碱金属元素;第ⅦA族:卤族元素;0族:稀有气体元素。
二、核素1.元素元素是具有相同________(即核电荷数)的同一类原子的总称。
由此可知同种元素原子的原子核内质子数一定________,但中子数______________。
例如氢元素原子的原子核内质子数与中子数的情况如表:特别提醒(1)元素是宏观概念,只论种数不论个数,其存在形式有游离态和化合态,如H2中的H与HCl中的H虽然存在形式不同,但都属于氢元素。
元素周期表
【教学目标】
1、了解元素周期表的结构以及周期、族等概念。
2.使学生理解同周期、同主族元素性质的递变规律,并能运用原子结构理论解释这些递变规律。
3.使学生了解原子结构、元素性质及该元素在周期表中的位置三者间的关系,初步学会运用周期表。
【教学重点】元素周期表的结构,元素的性质、元素在周期表中的位置与原子结构的关系
【教学过程】
一、元素周期表的结构:
⑴元素周期表的编排。
①按原子序数递增的顺序,从左至右排列;
②将电子层数相同的元素排在一横行;
③将不同横行中最外层电子数相同的元素,按电子层数的递增的顺序,由上而下排成一纵行。
由此可见,元素在周期表中的周期数,与其电子层数相同;主族元素的族系数,与其最外层电子数相同。
即
周期数 = 电子层数。
族系数(指主族)= 最外层电子数。
⑵周期表的结构概括:
练1、A、B、C三种短周期元素,B分别与A和C相邻,它们的原子序数之和为27。
则B元素可能是。
(答:碳或镁)
练2、根据下列关系,分别指出B元素与A元素的原子序数差。
①A、B同主族,分别在第三和第四周期,原子序数差为;
②A 、B 同周期,分别在ⅡA 和ⅢA 族,原子序数差为 ; ③A 、B 均在第五周期,分别为ⅢB 和ⅡB ,原子序数差为 ; ④A 、B 同周期,分别在Ⅷ和0族,原子序数差为 ; [答:①8或8;②1或11或25;③9;④10或9或8。
] (3)元素周期表中元素的金属性与非金属性的递变
二、由原子序数推导元素在周期表中的位置方法: ⑴根据每个周期排布元素的种类数〔一(2)、二(8)、三(8)、四(18)、五(18)、六(32)〕的特点,用递减法推出位置数。
如推32X 在周期表中的位置:32-2(一)-8(二)-8(三)=14(四),14-10=4(10为过渡元素的种类数),4即为主族族序数。
所以35X 处于第四周期第ⅣA 族。
⑵根据元素原子的序数画出原子结构简图,如35X 的位置: 由可知处于第四周期ⅦA 族。
另外同族上下相邻的两元素的序数相差8(二~三周期)、相差18(三~四~五周期)、相差32(五~六~七周期)等特点也应熟悉。
三、利用元素在周期表中的位置判断元素的性质。
同周期元素的性质有一定的递变规律,同主族元素的性质有很大的相似性,又有一定的递变规律。
根据这些规律,并参照已知元素的性质,就可推测未知元素的性质。
列表如下: 项目 同周期(从左到右) 同族主(从上到
下)
价电子(最外层电子)数 由1逐渐增到7 相同 主要化合价 最高正价由+1→+7 负价由-4-→1→0 最高正化合价相
同
原子半径 逐渐减小(惰性气体除外)
逐渐增大
金属性与非金属性 金属性减弱,非金金属性增强,
族 周期
1 2 B
3 Al Si
4 Ge As
5 Sb Te
6 Po At
7
IA IIA IIIA IV A V A VIA VIIA O
非金属性逐渐增强
金属性逐渐增强
金属
性逐渐增
非金
属性
逐渐
稀
有
气
体
;若发现原子序数为114的元素,则它在元素周期表中的位置是。
练4、某非金属元素X的最高价氧化物对应水化物的化学式是HnXOm,则x元素位于元素周期表中第族。
它的最高价氧化物化学式为,气态氢化合物的化学式为。
(答:31;第七周期第ⅣA 族)
练5、下列有关物质性质的比较正确的是
(A)金属性:K>Ca>Mg (B)酸性:H2SO4>HClO4>HClO
(C)酸性:HF>HCl>HBr (D)原子半径:S>P>N
(E)碱性:NaOH>Mg(OH)2>Ca(OH)2 (F)热稳定性:H2O>HF>H2S (答:A)
四、主族元素知识的有关规律:
⑴最外层电子数等于电子层数的元素原子有:H、Be、Al、Ge。
⑵最外层电子数是电子层数2倍的元素原子有:He、C、S、Kr,3倍的元素原子为:O。
⑶最高正价数与最低负价代数和为零的短周期元素有:C、si。
⑷最高正价数是最低负价数绝对值3倍的短周期元素原子是:S。
⑸除H外,原子半径最小的元素是:F。
⑹短周期中离子半径最大的元素是:S。
⑺最高正化合价数不等于族序数的元素是:O、F。
⑻各周期气态氢化合物的质子数、电子数都与该周期稀有气体元素原子核外电子数相同。
如:SiH4、PH3、H2S、HCl,都含有18个质子,18个电子。
⑼具有10个电子数的微粒:
①分子(5种):Ne、HF、H2O、NH3、CH4;
②阳离子(5种):Na+、Mg2+、Al3+、NH4+、H3O+;
③阴离子(5种):N3-、O2-、F-、OH-、NH2-;。