2018-2019学年高中化学必修一人教版检测:第二章 第三节 第1课时 氧化还原反应 Word版含答案
- 格式:doc
- 大小:989.00 KB
- 文档页数:7

第二节离子反应第二课时离子反应及其发生的条件[A篇知识对点训练]知识点1 离子反应1.下列物质混合发生化学反应,且属于离子反应的是 ( )A.NaOH溶液和K2SO4溶液混合B.锌片投入稀硫酸中C.KClO3和MnO2固体混合物加热制O2D.H2和O2反应生成水答案 B解析A项不具备复分解反应发生的条件;B项离子反应是Zn+2H+===Zn2++H2↑;C项不是在溶液中进行的反应;D项不是离子反应。
2.关于离子方程式Cu2++2OH-===Cu(OH)2↓的说法正确的是( )A.可表示CuSO 4溶液和Ba(OH)2溶液的反应B.可表示某一个具体的反应,也可以表示一类反应C.离子方程式中的OH-可代表弱碱或强碱D.该反应可看到Cu(OH)2白色沉淀答案 B解析A项中还有SO2-4+Ba2+===BaSO4↓;C项离子方程式中的OH-只能代表强碱;D项Cu(OH)2为蓝色沉淀。
3.下列化学反应的离子方程式错误的是( )A.BaCl2溶液与K2SO4溶液的反应:Ba2++SO2-4===BaSO4↓B.NaOH溶液与硝酸的反应:OH-+H+===H2OC.Na2CO3溶液与硫酸的反应:CO2-3+2H+===CO2↑+H2OD.碳酸钙与盐酸的反应:CO2-3+2H+===CO2↑+H2O答案 D解析D项中因碳酸钙为不溶于水的固体,应写化学式,正确的离子方程式为CaCO3+2H+===Ca2++CO2↑+H2O。
4.不能用离子方程式CO2-3+2H+===CO2↑+H2O表示的反应是 ( )A.Na2CO3+2HCl===CO2↑+H2O+2NaClB.NaHCO3+HCl===NaCl+CO2↑+H2OC.K2CO3+H2SO4===K2SO4+CO2↑+H2OD.K2CO3+2HNO3===2KNO3+CO2↑+H2O答案 B解析NaHCO3在水溶液中只能电离出Na+和HCO-3,而不是CO2-3,所以离子方程式为HCO-3+H+===H2O+CO2↑。
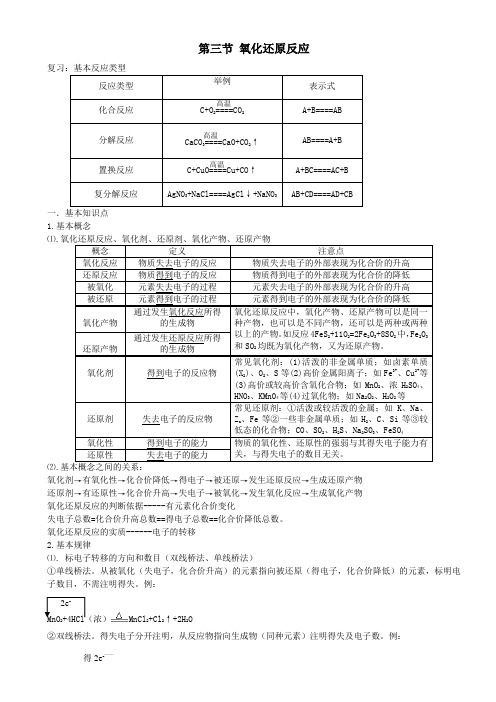
第三节 氧化还原反应一.基本知识点 1.基本概念⑴.氧化还原反应、氧化剂、还原剂、氧化产物、还原产物⑵.基本概念之间的关系:氧化剂→有氧化性→化合价降低→得电子→被还原→发生还原反应→生成还原产物 还原剂→有还原性→化合价升高→失电子→被氧化→发生氧化反应→生成氧化产物氧化还原反应的判断依据-----有元素化合价变化失电子总数=化合价升高总数==得电子总数==化合价降低总数。
氧化还原反应的实质------电子的转移 2.基本规律⑴. 标电子转移的方向和数目(双线桥法、单线桥法)①单线桥法。
从被氧化(失电子,化合价升高)的元素指向被还原(得电子,化合价降低)的元素,标明电子数目,不需注明得失。
例:MnO 2+4HCl (浓)MnCl 2+Cl 2↑+2H 2O②双线桥法。
得失电子分开注明,从反应物指向生成物(同种元素)注明得失及电子数。
例: 得2e -——2e -—MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O注意两类特殊的化学反应。
①歧化反应,同种元素同价态在反应中部分原子化合价升高,部分原子化合价降低。
②归中反应。
不同价态的同种元素的原子在反应中趋于中间价态,解此类题最好将该元素的不同价态用数轴标出,变化的区域只靠拢,不重叠。
⑵. 物质的氧化性强弱、还原性强弱的比较。
氧化性→得电子性,得到电子越容易→氧化性越强还原性→失电子性,失去电子越容易→还原性越强①根据金属活动性顺序来判断:一般来说,越活泼的金属,失电子氧化成金属阳离子越容易,其阳离子得电子还原成金属单质越难,氧化性越弱;反之,越不活泼的金属,失电子氧化成金属阳离子越难,其阳离子得电子还原成金属单质越容易,氧化性越强。
②根据非金属活动性顺序来判断:一般来说,越活泼的非金属,得到电子还原成非金属阴离子越容易,其阴离子失电子氧化成单质越难,还原性越弱。
③根据氧化还原反应发生的规律来判断: 氧化还原反应可用如下式子表示:规律:反应物中氧化剂的氧化性强于生成物中氧化产物的氧化性,反应物中还原剂的还原性强于生成物中还原产物的还原性。




第二章综合测试一、选择题(本题包括16小题,每题3分,共48分,每题只有一个选项符合题意)1.下列物质在一定条件下均能产生氧气,其中最适合用作宇航员(宇航员呼吸所需的氧气主要来自太空服中的呼吸面具)出舱时的供氧剂的是( ) A .22Na OB .22H OC .3KClOD .3HNO2.化学知识在生产和生活中有着重要的应用。
下列说法中正确的是( ) ①钠的还原性很强,可以用来冶炼金属钛、但、锯、钻等 ②K Na 、合金可作原子反应堆的导热剂③发酵粉中主要含有碳酸氢钠,能使焙制出的糕点疏松多孔④22Na O 既可作呼吸面具中2O 的来源,又可漂白织物、麦秆、羽毛等 ⑤碳酸钠在医疗上是治疗胃酸过多的一种药剂 ⑥明矾常作为消毒剂 A .①②③④ B .①②③④⑤ C .①②③④⑥ D .①②③④⑤⑥3.下列反应与22224Na O SO Na SO 相比较,22Na O 的作用相同的是( )A.2222322Na O2CO2Na CO O++B.2232422Na O2SO2Na SO O++↑C.22242422Na O H SO Na SO H O++D.22232423Na O Cr O2Na CrO Na O++4.已知A是一种金属单质,B显淡黄色,其转化关系如图所示,则C的以下性质错误的是()A.溶液呈碱性B.与澄清石灰水反应产生白色沉淀C.与足量盐酸反应放出气体D.受热易分解5.下表中,对陈述Ⅰ、Ⅱ的正确性及两者间是否具有因果关系的判断都正确的是()6.将一定物质的量的233Na CO NaHCO 、组成的混合物溶于水,配成1L 溶液,取出50mL 溶液,然后滴加一定物质的量浓度的盐酸与它反应,得到的图像如下,下列说法正确的是( )A .标注NaCl 的直线代表产生的2CO 的物质的量B .原混合物中23Na CO 与3NaHCO 的物质的量之比为1:2C .盐酸的浓度是10.05mol L -⋅D .盐酸加到150mL 时,放出2CO 气体2.24L (标准状况下)7.某同学欲称量NaOH 的质量,他先用托盘天平称量烧杯的质量,天平平衡后的状态如图所示。
第二章 化学物质及其变化 第三节 氧化还原反应 第1课时 氧化还原反应1.下列有关氧化还原反应的叙述正确的是( ) A .元素化合价升高的反应是还原反应B .物质在反应中失去电子,此物质中的某一元素化合价降低C .有电子转移的反应是氧化还原反应D .有化合价升降的反应不一定是氧化还原反应 答案:C2.下列反应中,一定发生电子转移的是( ) A .NH 4HCO 3=====△NH 3↑+CO 2↑+H 2O B .2KMnO 4=====△ K 2MnO 4+MnO 2+O 2↑ C .Ca(OH)2+CO 2===CaCO 3↓+H 2O D .Zn(OH)2+H 2SO 4===ZnSO 4+2H 2O解析:因为发生电子转移的反应一定是氧化还原反应,所以此题实际是判断反应是否是氧化还原反应,其关键是分析反应前后各元素的化合价是否发生变化。
B 项反应中锰元素的化合价由+7价降低为+6价和+4价,氧元素的化合价由-2价升高为0价,发生了电子转移,A 、C 、D 项反应中各元素的化合价均无变化。
答案:B3.下列变化过程中,属于还原反应的是( ) A .HCl →Cl 2 B .Na →Na +C .CO →CO 2D .Fe 3+→Fe答案:D4.下列各氧化还原反应方程式表示的变化过程正确的是( )答案:D5.(1)分析下列反应,指明是氧化还原反应或非氧化还原反应,是氧化还原反应的还要用双线桥法标出电子转移的方向和数目,指出被氧化和被还原的元素。
①2Na +Cl 2=====点燃2NaCl________________________________; ②NaOH +HCl===NaCl +H 2O_________________________。
(2)分析下列反应,指明是氧化还原反应或非氧化还原反应,是氧化还原反应的还要用单线桥法标出电子转移的方向和数目。
①BaCl 2+Na 2SO 4===BaSO 4↓+2NaCl________; ②Zn +2HCl===ZnCl 2+H 2↑________________。
解析:分析各个反应中物质所含元素的化合价的变化,物质所含元素化合价升高,被氧化;物质所含元素化合价降低,被还原。
在用箭头标出电子转移的情况时,要注意单、双线桥法的特点及各自的注意事项。
答案:(1)①氧化还原反应②非氧化还原反应(2)①非氧化还原反应 ②氧化还原反应(时间:40分钟 满分:100分)一、选择题(每小题8分,共48分)1.我们生活在千变万化的物质世界里。
下列变化中,没有发生氧化还原反应的是( )解析:钢水浇铸是物理变化。
答案:C2.我国“四大发明”在人类发展史上起到了非常重要的作用,其中黑火药的爆炸反应为2KNO 3+S +3C=====点燃K 2S +N 2↑+3CO 2↑,该反应中被还原的元素是( )A .CB .NC .N 和SD .N 和C解析:被还原的元素的化合价降低,根据反应方程式,硝酸钾中N 元素的化合价由+5价降低为0价,S 元素的化合价由0价降低为-2价,C 元素的化合价由0价升高为+4价,因此被还原的元素是N 和S ,故C 正确。
答案:C3.下列化学反应中,既是离子反应,又是氧化还原反应的是( ) A .2NaOH +H 2SO 4===Na 2SO 4+2H 2O B .Fe +H 2SO 4===FeSO 4+H 2↑ C .BaCl 2+H 2SO 4===BaSO 4↓+2HClD .H 2+CuO=====△Cu +H 2O解析:A 、C 两项中的反应是复分解反应,不存在电子的转移,不是氧化还原反应,D 项中的反应是氧化还原反应,但不是离子反应。
答案:B4.下列表示氧化还原反应实质正确的是( )答案:B5.下列各反应中,氧化反应与还原反应在同种元素中进行的是( ) A .Cl 2+2NaOH===NaCl +NaClO +H 2O B .2KClO 3=====MnO 2△2KCl +3O 2↑C .2CO +O 2=====点燃2CO 2 D .2H 2O=====电解 2H 2↑+O 2↑解析:A 项,氯元素的化合价一部分由0价升高到+1价,被氧化,同时还有一部分由0价降低到-1价,被还原,氧化反应与还原反应均在氯元素中进行;B 项,氯元素由+5价降低到-1价,被还原,氧元素由-2价升高到0价,被氧化,氧化反应与还原反应未在同种元素中进行;C 项,碳元素由+2价升高到+4价,被氧化,氧元素由0价降低到-2价,被还原,氧化反应与还原反应未在同种元素中进行;D 项,氢元素由+1价降低到0价,被还原,氧元素由-2价升高到0价,被氧化,氧化反应与还原反应未在同种元素中进行。
答案:A6.下列反应属于氧化还原反应,但水既不被氧化又不被还原的是( ) A .2H 2O +2F 2===4HF +O 2 B .2H 2O +2Na===2NaOH +H 2↑ C .3NO 2+H 2O===2HNO 3+NO D .2H 2O=====通电O 2↑+2H 2↑解析:A 项,H 2O 中氧元素化合价升高,水被氧化;B 项,H 2O 中氢元素化合价降低,水被还原;C 项,只有NO 2中氮元素化合价发生变化,水既不被氧化又不被还原;D 项,水中的氢元素被还原,氧元素被氧化。
答案:C二、非选择题(包括3个小题,共52分)7.(21分)化学反应按照不同的分类方法,可以分为化合、分解、置换、复分解,或者分为氧化还原反应和非氧化还原反应。
有下列一组反应:①CO 2+C=====高温2CO②Cu 2(OH)2CO 3=====△2CuO +H 2O +CO 2↑ ③2NaOH +Cl 2===NaCl +NaClO +H 2O ④2CO +O 2=====点燃2CO 2⑤3Fe +4H 2O(g)=====高温Fe 3O 4+4H 2 ⑥CuO +CO=====△Cu +CO 2 ⑦4NH 3+3O 2(纯)=====点燃2N 2+6H 2O ⑧2H 2O=====电解2H 2↑+O 2↑⑨2Al +2NaOH +2H 2O===2NaAlO 2+3H 2↑ ⑩SO 2+H 2O===H 2SO 3 ⑪H 2O 2+SO 2===2H ++SO 2-4(1)其中属于化合反应的有_______,属于置换反应的有_______。
(2)在化学反应前后元素的化合价没有变化的是________。
(3)上述反应中,既是分解反应又是氧化还原反应的是________。
(4)上述反应中,既是溶液中的离子反应,又是氧化还原反应的是________。
(5)根据你的理解,氧化还原反应的实质是________。
A.分子中的原子重新组合B.氧元素的得失C.电子的得失或共用电子对的偏移D.化合价的改变(6)根据反应⑪,你认为离子反应发生的条件应该怎样补充?______________________________________________________。
答案:(1)①④⑩⑪⑤⑦(2)②⑩(3)⑧(4)③⑨⑪(5)C (6)溶液中有离子参加或生成的氧化还原反应一定是离子反应8.(20分)Ⅰ.(10分)过氧化氢(H2O2)可作为采矿业的废液消毒剂,如消除采矿废液中有剧毒的氰化钾(KCN,其中N元素为-3价),化学方程式为KCN+H2O2+H2O===A+NH3↑(已配平),请回答下列问题:(1)生成物A的化学式是________。
(2)该反应是否是氧化还原反应?________(填“是”或“不是”)。
若是,请指出被还原的元素;若不是,请说明理由:____________________________________________。
Ⅱ.(10分)已知铜在常温下能被浓硝酸溶解,其反应的化学方程式如下:Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O(1)用双线桥法表示电子得失的方向和数目:______________________________________________________。
(2)用单线桥法表示电子得失的方向和数目:______________________________________________________。
(3)若3 mol Cu参加反应,则该过程转移的电子是________mol。
解析:Ⅰ.(1)根据质量守恒定律可知,A由1个K原子、3个O原子、1个C原子和1个H 原子构成,故为KHCO3。
(2)反应物H2O2中氧元素的化合价由-1价降为-2价,氧元素被还原;反应物KCN中碳元素的化合价由+2价升高为+4价,碳元素被氧化,故该反应是氧化还原反应。
Ⅱ.(1)该反应中Cu的化合价变化是0价→+2价,1 mol Cu失去2 mol电子;HNO3中氮元素部分化合价由+5价→+4价,生成1 mol NO2,转移1 mol电子。
(2)结合(1)的分析及单线桥法的注意事项,即可写出。
(3)1 mol Cu失去2 mol电子,故3 mol Cu失去6 mol电子。
答案:Ⅰ.(1)KHCO3(2)是氧元素化合价由-1价降为-2价,被还原Ⅱ.(1)(3)69.(11分)下面实验是探究氧化还原反应的实质的实验,按要求填空回答。
(1)实验步骤:①把几颗锌粒放到盛有少量CuSO4溶液的烧杯中,观察现象。
②按下图所示连接装置进行实验。
将锌片和石墨电极插入到CuSO4溶液中,观察实验现象。
(2)实验现象:①锌粒表面________。
②电流计的指针________;石墨电极上附着了红色的固体。
(3)现象分析:红色固体是Cu,其生成说明Zn与CuSO4发生了化学反应,反应的化学方程式为_____________________________。
电流计的指针________,说明电路中有电流流过,金属和石墨导体中有电子流过。
(4)实验结论:Zn与CuSO4发生了氧化还原反应,此过程中有________。
解析:通过电流计指针发生偏转,说明整个电路中有电流产生,即所有固体导体中有电子的定向移动;通过石墨电极上附着红色固体且是铜,说明CuSO4溶液中Cu2+向石墨电极定向移动且在石墨电极上获得了电子,从而得出(4)的实验结论。
答案:(2)①形成了红色固体②发生偏转(3)Zn+CuSO4===ZnSO4+Cu 发生偏转(4)电子转移。