第5章多相平衡
- 格式:docx
- 大小:50.75 KB
- 文档页数:6

第五章相平衡§5.1 引言相平衡是热力学在化学领域中的重要应用之一。
化工中很多分离提纯过程,例如精馏、吸收、结晶、萃取等,都涉及到物质在不同相中的分配,它们主要利用物质的挥发性或溶解度等方面的差异,以达到分离提纯的目的,相平衡亦可为此提供理论依据。
因此研究相平衡有着重要现实意义。
一、相(phase)体系内部物理和化学性质完全均匀的部分称为相。
相与相之间在指定条件下有明显的界面。
(1)气体,不论有多少种气体混合,只有一个气相。
(2)液体,按其互溶程度可以组成一相、两相或三相共存。
(3)固体,一般有一种固体便有一个相。
两种固体粉末无论混合得多么均匀,仍是两个相(固体溶液除外,它是单相)。
体系中相的总数用Φ表示。
二、相变物质从一个相流动到另一个相的过程,称为相变化,简称相变。
相变包括气化(boil)、冷凝(condensation)、熔化(melt)、凝固(freeze)、升华(sublimation)、凝华以及晶型转化等。
三、相图(phase diagram)将多相体系的状态随组成、温度、压力等强度性质的改变而发生的过程用图形表示,称为相图。
根据组成相的物态不同分为气-液相图、液-液相图和液-固相图。
根据用途不同可将相图分为温度-蒸汽压图(T-p图,P314 图5.1)、蒸汽压-组成图(p-x图,P318 图5.3):恒定温度,研究P-x,y之间的关系。
称为压力组成图。
温度-组成图(T -x 图,P321 图5.5):在恒定压力下表示二组分系统气-液平衡时温度与组成关系的相图。
研究T-x ,y 之间的关系。
和温度-蒸汽压-组成图(T -p -x 图,P322 图5.6),T-x-y ,x-y ,p-x-y 相图等。
四、自由度(degrees of freedom )确定平衡体系的状态所必须的压力、温度和浓度等独立强度性质的数目称为自由度,用字母f 表示。
如果已指定某个强度性质,除该性质以外的其它强度性质数称为条件自由度,用*f 表示。

一、选择题1.在含有C(s)、H 2O(g)、CO(g)、CO 2(g)、H 2(g)五个物种的平衡体系中,其独立组分数C 为( a )(√a )3 (b) 2 (c) 1 (d) 42.二元合金处于低共熔温度时物系的自由度f 为 ( b )(a) 0 (√b) 1 (c) 2 (d) 33.298K 时蔗糖水溶液与纯水达渗透平衡时,整个体系的组分数、相数、自由度数为( b )(a )C=2 Φ=2 f*=1 (√b) C=2 Φ=2 f*=2 (c) C=2 Φ=1 f*=2 (d) C=2 Φ=1 f*=34.FeCl 3 和H 2O 能形成FeCl 3·6H2O ,2FeCl 3·7H 2O ,2FeCl 3·5H 2O ,FeCl 3·2H 2O 四种水合物,该体系的独立组分数C 和在恒压下最多可能的平衡共存相数Φ分别为( c )(a )C=3 Φ=4 (b) C=2 Φ=4 (√c) C=2 Φ=3 (d) C=3 Φ=55.对于恒沸混合物,下列说法中错误的是( d )(a )不具有确定组成 (b )平衡时气相和液相组成相同 (c )其沸点随外压的改变而改变 (√d )与化合物一样具有确定组成6.单组分体系的固液平衡线斜率dp/dT 的值( d )(a )大于零 (b )等于零 (c )小于零 (√d )不确定7.A ,B 两种液体混合物在T ﹣x 图上出现最高点,则该混合物对拉乌尔定律产生 ( b )(a )正偏差 (√b )负偏差 (c )没偏差 (d )无规则8.下列过程中能适用方程式2ln RT H dT p d ∆= 的是( a ) (√a) I 2(s)=I 2(g) (b) C(石墨)=C(金刚石)(c) Hg 2Cl 2(s)=2HgCl(g) (d) N 2(g,T 1,P 1)=N 2(g,T 2,P 2)9.某一固体在25℃和101325Pa 压力下升华,这意味着( b )(a)固体比液体密度大 (√b )三相点压力大于101325Pa(c)三相点温度小于25℃ (d) 三相点压力小于101325Pa10.在低温下液氦(I)和液氦(II)有一晶体转变,属于二级相变过程,对二级相变的特征描述在下列说法中那一点是错误的( d )(a) 无相变热(b)相变时无熵变化(c)相变时二相密度相同(√d) 相变时两相的热容相同二、填空题1.下列化学反应,同时共存并达到平衡(温度在900K-1200K范围内)CaCO3(s)=CaO (s)+ CO2(g)CO2(g)﹢H2(g)=CO(g)+ H2O (g)H2O(g)+ CO(g)+ CaO(s)=CaCO3(s)+ H2(g)该体系的自由度f为3。


第五章相平衡一、选择题1、下列体系中哪一个是均相体系:( )(A)水雾和水蒸气混合在一起; (B)乳状液(C)水和被水饱和的空气 (D)两种不同的金属形成的固熔体2、克拉佩龙方程表明:( )(A)两相平衡时的平衡压力随温度而变化的变化率(B)任意状态下压力随温度的变化率(C)它适用于任何物质的两相平衡(D)以上说法都不对3、压力升高时,单组分体系的熔点将如何变化:()(A) 升高(B) 降低(C) 不变(D) 不一定4、对于下列平衡系统:①高温下水被分解;②同①,同时通入一些H2(g) 和O2(g);③H2 和O2同时溶于水中,其组元数K和自由度数f的值完全正确的是:()(A) ①K = 1,f= 1 ②K = 2,f= 2 ③K = 3,f = 3 ;(B) ①K = 2,f= 2 ②K = 3,f= 3 ③K = 1,f = 1(C) ①K = 3,f= 3 ②K = 1,f= 1 ③K = 2,f = 2(D) ①K = 1,f= 2 ②K = 2,f= 3 ③K = 3,f = 35、水可形成H2SO4·H2O(s)、H2SO4·2H2O(s)、H2SO4·4H2O(s)三种水合物,问在 101325 Pa 的压力下,能与硫酸水溶液及冰平衡共存的硫酸水合物最多可有多少种? ( )(A) 3 种(B) 2 种(C) 1 种(D) 不可能有硫酸水合物与之平衡共存6、298 K 时,蔗糖水溶液与纯水达渗透平衡时,整个体系的组分数、相数、自由度为:()(A) C= 2,φ= 2,f*= 1 (B) C= 2,φ = 2,f*= 2 (C) C= 2,φ= 1,f*= 2 (D) C= 2,φ = 1,f*= 37、如右图所示,当水处在三相点平衡时,若系统发生绝热膨胀,水的相态将如何变化? ( )(A)气相、固相消失,全部变成液态;(B)气相、液相消失,全部变成固态;(C)液相消失,固相、气相共存;(D)固相消失,液相、气相共存8、对简单低共熔体系,在最低共熔点,当温度继续下降时,体系存在( )(A)一相 (B)二相 (C)一相或二相 (D)三相9、已知纯A和纯B的饱和蒸气压p A*<p B*,且A和B所组成的体系具有最高恒沸点。




第五章多相平衡一、简答题1、指出下列平衡体系中的物种数、组分数、相数和自由度数:①Ca(OH)2(s)与CaO(s)和H2O(g)呈平衡。
②在A和B形成的二元凝聚体系中,在转熔点发生转溶反应:B(晶) + L( 熔液) = A m B n( 晶)③CaSO4与其饱和水溶液达平衡。
④5克氨气通入1升水中,在常温常压下与蒸气平衡共存。
⑤I2在液态水和CCl4中分配达平衡(无固体存在)⑥将固体NH4HCO3(s)放入真空容器中恒温至400K, NH4HCO3(s)按下式分解达平衡NH4HCO3(s) = NH3(g) + H2O(g) + CO2(g)⑦NaH2PO4溶于水中与蒸气呈平衡,求最大物种数、组分数和自由度数。
⑧Na+、Cl-、K+、NO3-、H2O(l)达平衡。
⑨NaCl (s)、KCl(s)、NaNO3(s)与KNO3(s)的混合物与水平衡。
⑩含有KCl和NaCl的水溶液与纯水达渗透平衡。
⑾含有CaCO3(s) CaO(s) CO2(g)的体系与CO2(g)和N2(g)的混合物达渗透平衡。
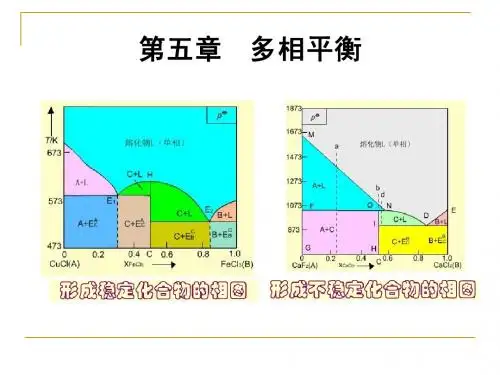
2、FeCl3和H2O能形成四种水合物∶FeCl3.6H2O(s)、2FeCl3.7H2O(s)、2FeCl3.5H2O(s)和FeCl3.2H2O(s),在恒定温度和压力下平衡共存的最多相为多少?3、H2SO4与H2O可形成H2SO4. H2O(s)、, H2SO4.2H2O(s)、与H2SO4.4H2O(s)三种水合物,在p0下,常压下,将一定量的H2SO4溶于H2O 中,当达三相平衡时,能与冰、H2SO4水溶液平衡共存的硫酸水合盐的分子中含几个水分子?4、A、B二元相图如图所示,写出相区1~10的相组成;并说明温度线T1~T5各有几相组成。
(L 液相;α、β、γ 固溶体)5、某纯物质的相图如下,在图中标出物质各态所占的区间,并判断随压力的上升,此物质的凝固点是上升还是下降,并解释其原因6、有三元体系相图如上,请指出图中各区域存在的相,相数和自由度。

第五章 多相平衡一、填空题1、一定温度下,蔗糖水溶液与纯水达到渗透平衡时的自由度数等于__________。
2、纯物质在一定温度下两相共存时的自由度数等于__________。
3、NaCl(S)和含有稀盐酸的NaCl 饱和水溶液的平衡系统,其独立组分数是_______。
4、设下列化学反应同时共存时并达到平衡(900-1200K ):()()()g CO s CaO s CaCO 23+=()()()()g O H g CO g H g CO 222+=+()()()g H s CaCO s CaO g CO g O H 232)()(+=++则该系统的自由度数为______。
5、含KNO 3和NaCl 的水溶液与纯水达到渗透平衡时,其组分数为____,相数为___, 自由度数为____。
6、在氢和石墨的系统中,加一催化剂,H 2和石墨反应生成n 种碳氢化合物,此系统的独立 组分数为______。
7、完全互溶的双液系中,在x B =0.6处,平衡蒸气压有最高值,那么组成为x B =0.4的溶液在 气液平衡时,x B (g )、x B (l )、x B (总)的大小顺序为______。
将x B =0.4的溶液进行 精馏时,塔顶将得到______。
8、对于渗透平衡系统,相律的形式应写成______。
9、NH 4Cl 固体分解达到平衡时,())()(s Cl NH 34g NH g HCl +=,系统的独立组分数为___,自由度为___。
10、将AlCl 3溶于水中,全部水解,生成Al(OH)3沉淀,此系统自由度数f=____。
11、已知100o C 时水的饱和蒸气压为101.325KPa,用公式_________可求出25oC 时 水的饱和蒸气压。
二、单选题1、右图为H 2OA.-(NH 4)2SO 4B.的沸点-组成图。
如何从w B =0.4 的溶液中提取较多的精制(NH 4)2SO 4固体?( )A.降温至-18.3℃以下B.在密闭容器中平衡蒸发C.在敞开容器中定温蒸发再降温至-18.3℃以上D.先蒸发一部分水份,再降温至-18.3℃以下2、如右图所示,当水处在三相点平衡时,若系统发生绝热膨胀,水的相态将如何变化? ( )A.气相、固相消失,全部变成液态;B.气相、液相消失,全部变成固态;C.液相消失,固相、气相共存;D.固相消失,液相、气相共存3、对简单低共熔体系,在最低共熔点,当温度继续下降时,体系存在( )A.一相B.二相C.一相或二相D.三相4、已知纯A和纯B的饱和蒸气压p A*<p B*,且A和B所组成的体系具有最高恒沸点。
第五章难溶强电解质的多相离子平衡习题解析1、如何应用溶度积常数来比较难溶强电解质的溶解度?答:(1)对于相同类型的难溶强电解质来说,由于溶度积与溶解度的关系表达式相同,所以可以根据溶度积直接比较它们的溶解度的大小。
K sp 越大,S 越大,反之亦然。
(2) 对于不同类型的难溶电解质来说,其溶度积与溶解度的关系表达式是各不相同的,因此,不能根据溶度积来直接比较它们的溶解度的大小,但可以通过用溶度积常数来计算它们的溶解度,然后再比较它们的溶解度大小。
2、溶度积常数与温度和离子浓度有关吗?答:溶度积常数在一定温度下是一个常数,它是溶液处在平衡状态(或饱和溶液状态)时的有关离子幂的乘积,所以溶度积常数与温度有关,温度不同溶度积常数也不同。
但它与离子的浓度无关,在一定温度下,不管溶液中离子浓度怎么变化,溶度积常数都是不变的。
3、同离子效应和盐效应对难溶强电解质的溶解度有什么影响?答:同离子效应就是在难溶电解质溶液中,加入与难溶电解质具有共同离子的强电解质,而使难溶电解质的溶解度降低的效应,它对难溶电解质溶解度的影响是使其溶解度大大地降低;而盐效应就是在难溶电解质溶液中,加入与难溶电解质不具有共同离子的强电解质,由于强电解质的加入,增大了离子强度而使难溶电解质溶解度略微增大的效应,它对难溶电解质溶解度的影响是使其溶解度稍有增加。
当两种效应共存时,同离子效应起主要作用,可忽略盐效应作用的影响。
4、难溶强电解质的溶度积越大,其溶解度也越大吗?为什么?答:不能简单地用溶度积的大小来比较溶解度的大小,对于同类型的难溶电解质,可以直接用溶度积的大小来比较溶解度的大小。
而对于不同类型的难溶电解质,要通过计算来比较溶解度的大小,不能直接根据溶度积的大小来比较。
所以难溶电解质的溶度积越大,其溶解度不一定也越大。
5、解释为什么BaSO4 在生理盐水中的溶解度大于在纯水中的,而AgCl 的溶解度在生理盐水中却小于在纯水的。
答:BaSO4 在纯水中的溶解度小于在生理盐水中的溶解度,这是因为在生理盐水中有NaCl 电解质而产生盐效应,致使BaSO4 在生理盐水中的溶解度稍有增加。
第五章 相平衡一、基本公式和内容提要基本公式1. 克劳修斯—克拉贝龙方程m mH dp dT T V ∆=∆相相(克拉贝龙方程,适用于任何纯物质的两相平衡) 2ln m H d p dT RT∆=相(克劳修斯—克拉贝龙方程,适用与其中一相为气相,且服从理想气体状态方程的两相间平衡)2.特鲁顿(Trouton)规则1188vap mvap m bH S J mol k T --∆=∆≈⋅⋅(T b 为该液体的正常沸点)3.相律 f+Φ=C+n C=S-R-R ′f+Φ=C+2 (最普遍形式)f* +Φ=C+1 (若温度和压力有一个固定,f * 称为“条件自由度”)*4. Ehrenfest 方程2112()p p C C dp dT TV αα-=-(C p ,α为各相的恒压热容,膨胀系数) 基本概念1. 相:体系中物理性质和化学性质完全均匀的部分,用Φ表示。
相的数目叫相数。
2. 独立组分数C =S -R -R ′,S 为物种数,R 为独立化学反应计量式数目,R ′ 为同一相中独立的浓度限制条件数。
3. 自由度:指相平衡体系中相数保持不变时,所具有独立可变的强度变量数,用字母 f 表示。
单组分体系相图相图是用几何图形来描述多相平衡系统宏观状态与 T 、p 、X B (组成)的关系。
单组分体系,因 C =1 ,故相律表达式为 f =3-Φ。
显然 f 最小为零,Φ 最多应为 3 ,因相数最少为 1 ,故自由度数最多为 2 。
在单组分相图中,(如图5-1,水的相图)有单相的面、两相平衡线和三相平衡的点,自由度分别为 f =2、f =1、f =0。
两相平衡线的斜率可由克拉贝龙方程求得。
图5-1二组分体系相图根据相律表达式f=C-Φ+2=4-Φ,可知f最小为零,则Φ最多为 4 ,而相数最少为 1 ,故自由度最多为 3 。
为能在平面上显示二组分系统的状态,往往固定温度或压力,绘制压力-组成(p-x、y)图或温度-组成(T-x、y)图,故此时相律表达式为f*=3-Φ,自然f*最小为 0 ,Φ最多为 3,所以在二组分平面图上最多出现三相共存。
第五章多相平衡
一、选择题
1 •在含有C(s)、H 20(g)、CO(g)、C02(g)、H 2(g)五个物种的平衡体系中,其独立 组
分数C 为(a )
(諾)3 (b) 2 (c) 1 (d) 4
2•二元合金处于低共熔温度时物系的自由度 f 为(b )
(a) 0 (』)1 (c) 2 (d) 3
3. 298K 时蔗糖水溶液与纯水达渗透平衡时,整个体系的组分数、相数、自由度 数为
(b )
(a) C=2
0=2 f*=1 (』)C=2 0=2 f*=2
(c) C=2 0=1 f*=2 (d) C=2 0=1 f*=3
4. F eCb 和 H 2O 能形成 FeCb 6H2O , 2FeCb 7 H 2O , 2FeCl 3 5 H 2O , FeCb 2H 2O
四种水合物,该体系的独立组分数C 和在恒压下最多可能的平衡共存相数 ①分 别
为(c )
(a ) C=3 0=4 (b) C=2 0=4 (V c) C=2 0=3 (d) C=3 0=5
5 •对于恒沸混合物,下列说法中错误的是( d )
6 •单组分体系的固液平衡线斜率 dp/dT 的值(d )
(a )大于零 (b )等于零 (c )小于零 (V d )不确定
7. A ,B 两种液体混合物在T - x 图上出现最高点,则该混合物对拉乌尔定律产 生
(b )
9 •某一固体在25C 和101325Pa 压力下升华,这意味着(b )
(a)固体比液体密度大 (V b )三相点压力大于101325Pa
(c) 三相点温度小于25C (d) 三相点压力小于101325Pa
10•在低温下液氦(I)和液氦(II)有一晶体转变,属于二级相变过程,对二级相
变的特征描述在下列说法中那一点是错误的(d )
(a)无相变热 (c)相变时二相密度相同 二、填空题
1 •下列化学反应,同时共存并达到平衡(温度在900K-1200K 范围内)
CaCO 3(s)= CaO (s)+ CO 2(g)
CO 2(g )+ H 2(g)= CO(g)+ H 2O (g)
H 2O(g)+ CO(g)+ CaO(s)= CaCO 3(s)+ H 2(g)
该体系的自由度f 为 3。
2.
在N 2(g)和O 2(g)共存的体系中加入一种固体催化剂, 可生成多种氮的氧化物, (a )不具有确定组成 (c )其沸点随外压的改变而改变
(b) 平衡时气相和液相组成相同
(V d )与化合物一样具有确定组成 (a )正偏差 (V b )负偏差 (c )没偏差 (d )无规则 8•下列过程中能适用方程式 (V a) 12(沪 12(g) (c) Hg 2Cl 2(s)=2HgCI(g) 込二兰的是(a ) dT RT (b) C(石墨)=C(金刚石)
(d) N 2(g,「,P 1)= N (g,T ,P ) (b )相变时无熵变化
(V d)相变时两相的热容相同
则体系的自由度为_3 _______ 。
3. NaCl(s)和含有稀盐酸的NaCl饱和水溶液的平衡体系,其独立组分数为—2_
4 •右图为二组分A和B的T-x图,当组成为M的溶液缓缓冷却至温度T i时,液体中A的活度随标准态的选择而异。
当以纯固体A为标准态
时a A_=_1, 当以过冷液体为标准态时,3A_V 1 (填〉、
二、V)。
5. Al2(SO4)3的不饱和溶液,此体系最大物种数为
6_,组分数为_3_,自由度数为_3_。
6. CaCO3(s)、BaCO3(s)、BaO(s)和CO2(g)构成的多
相平衡体系的组成分数为_3_,相数为_4_,自由度
数为 1 。
7. 298K时A B和C彼此不发生化学反应,三者所成的溶液与固相A和由B和C
组成的气相同时平衡,贝够体系的自由度f为_2_,平衡共存的最大相数①
为_5_,在恒温条件下如果向溶液中加组分A,则体系的压力将_不变—,若向溶液中加入B,则体系的压力将—增大_。
8. 水在三相点附近的蒸发热和熔化热分别为45和6kJ.mol-1,贝吐匕时冰的升华
热为—51JcJ.mol -。
三思考题指出下列平衡体系中的物种数、组分数、相数和自由度数。
1. Ca(OH)2 与Ca(s)和H2O(g)呈平衡
2. 在A和B形成的二元凝聚体系中,在转熔点发生转熔反应:
B(晶)+ L(熔液)=A m B n(晶)
3. CaSC4与其饱和水溶液达平衡
4. 5gNH3通入1升水中,在常温常压下与蒸气平衡共存
5. 12在液态水和CCl4中分配达平衡(无固体存在)
6. 将固体NH4HCO3(s)放入真空容器中恒温至400K,NH4HCO3(s)按下式分解达平衡:NH4HCO3(S) = NH3(g) + H2O(g) + CO2(g)
7. NaH2PO4溶于水中与蒸气呈平衡,求最大物种数、组分数和自由度数
8. Na+、Cl-、K+、NOJ、H2O(l)达平衡
9. NaCI(s)、KCl(s)、NaNO3(s)与KNO3(s)的混合物与水平衡
10. 含有NaNO3和NaCI的水溶液与纯水达渗透平衡
11. 含有CaCO3(s)、CaO(s)、CO2(g)的体系与CO2(g)和N2(g)的混合物达渗透平衡解:
S R R'C①f
1.310231
2.310231
3.210222
4.310222
5.300323
6.41212f*=0
7.200222
8.S=5[Na+、CI-
、K+、NO3-、H2O]R=0 R'=1 {[+]=[-]}
C=S-R-R'=5-0-仁4 ①=1 液相)f=C
-① +2 =41+2=5
9.S=9[四种离
子、四种固态盐、H2O]R=4[四个平衡]R'=1 {[+]=[-]}
C=S-R-R'=9-4-仁4 ①=(4 个固相,一个液相)f=C-① +2 =4-5+2=1 或S=5[Na+、Cl-、K+、NO『、H2O] R=0 R'=1 {[+]=[-]}
R=1[CaCO3(s)=CaO(s)+CO2(g)]
R'=0
C=3
①=4(二固、二气)
f=C-①+3=3-4+3=2
四计算题
1. 对HAc 和C 6H 6组成的相图(P 171习题27)
(1) 指出各区域所存在的相和自由度数。
(2) 从图中看出最低共熔温度为-8C ,最低共熔 混
合物的组成为含C 6H 6 64% (质量百分数), 试问将
含苯75%和25%的溶液各100g 由20 C 冷却时,
首先析出的固体物质为何物?最多能 析出多少?
⑶叙述将含苯75%及25%的溶液冷却到 -10C ,
此过程的相变化,并画出其步冷曲线。
解:(1) A 区:液相 +HAc(s),①=2, f=1 ;
B 区:液相,①=1, f=2 ;
C 区:液相 +C 6H 6(S ),①=2, f=1 ;
D 区:C 6H 6(S )+HA C (S ),①=2, f=1;
⑵将含C 6H 60.75的溶液冷却时,首先析出苯,设为
W 1
(100-75)W 1=(75-64)(100-W 1)
W 1=30.6g
将含C 6H 60.25的溶液冷却时,首先析出 HAc ,设
为W 2
(64-25) (100-W 2)=25W 2
W 2=60.9g
(3) 步冷曲线如图。
25%溶液:a —a 1是单相(液), f=2,到a 1点时,
C=S-R-R'=5-0-1=4 10. 3 0 ①=(4个固相,一个液相) f=C-①+2 =4-5+2=1 0 3 2 4 T 、P] T . p 2 I
KN6 - NaCl : H 2
O(1) H 3O(l) I
_________________ I _________________ 注意:在渗透平衡时,原来的相律 f=C-①+2就不能 用了。
因为在该相律推导过程中,假设了各相压力 均相等。
相律公式中的2表示温度和压力。
在渗透 平衡中二相上方压力不等 p i 工P 2,原来的相律相应 改为f=C-①+3。
11. S=4 Pi I co 2(g); CaO(s): CaCO 3(s):
COi(g) Nj(g)
开始析出HAc(s); a1—a2是继续冷却,HAc(s)不断
a-4
析出,溶液组成沿FE线向E移动;a2—a是HAc(s)和C6H6(s)同时析出,①=3,
f=0。
温度不变至液相消失;a3—a4是两固相共存,互比量不变,温度下降至-10C。
75%溶液冷却过程分析同上。
2. 在NaCI-H20系统中,有一低共熔点,其温度为-21T C,含NaCl为0.233 (质量分数)。
在低共熔点析出的固体为冰和NaCl 2H2O混合物。
-9C为NaCl 2H2O
的不相合溶点,在-9C时NaCl 2H2O发生转熔反应,分解为无水NaCl和组成为0.27的NaCl溶液。
无水NaCl的溶解度变化很小,但温度升高时溶解度略有增加。
试根据上述知识大概画出NaCl-H2O的相图。
解:不稳定化合物的组成为:
58.45
(NaCl) 100% =62%
94.49
确定好 E 点[-21.1 C,w(NaCl)=0.233]、不相合溶点G 点[-21.1 C,
w(NaCl)=0.233]和S点[9C,w(NaCl)=0.27]后,画出相图如图所示。