第五章 多相平衡
- 格式:pdf
- 大小:208.52 KB
- 文档页数:12


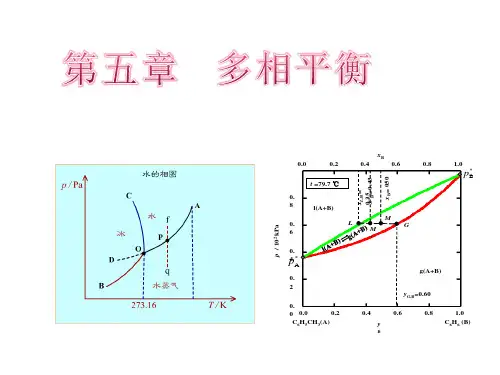
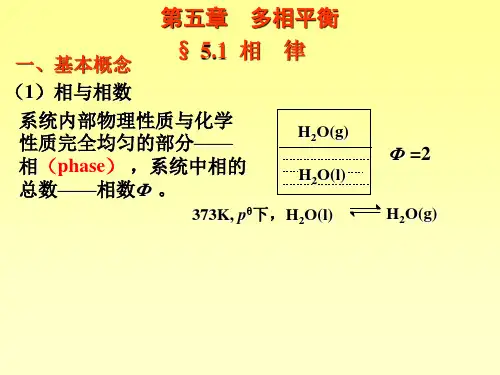






第五章多相体系—相平衡Heterogeneous SystemPhase EquilibriumIntroduction: 多相体系的分离& 提纯第一节相律1.1 基本概念相:体系中物理性质与化学性质完全均匀的部分相数:一个体系所含相的数目,用符号P表示气体:一般只有一相;(P=1)液体:完全互溶,只有一相;部分互溶,有几层就有几相;(P=1,2,3……)固体:有几种固体就有几相。
固态溶液:“固溶体”(P=1)相变化过程(相变);相平衡状态;相界面独立组分数:形成一个热力学平衡体系所需要的最少物种数,简称组分数,用符号C 表示。
组分数=物种数-独立的化学平衡数-独立的限制条件数C =S -R -R ´S :物种数,即体系所含物质的数目R :独立的化学平衡反应数R ´:独立的限制条件数,比如浓度,比例等例如,由NH 4Cl(s)、HCl(g)和NH 3(g)构成的体系,①体系的S=3②三种物质之间又存在化学反应NH 4Cl(s)=HCl(g)+NH 3(g) R=1③若该混合物是由NH 4Cl(s)分解而得,则体系中HCl(g)与NH 3(g)的浓度比保持1:l ,即存在关系式y HCl = y NH 3,则R'=1因此:由NH 4Cl(s)分解而得到的混合物,C=3-1-1=1,该体系为单组分体系独立组分数:形成一个热力学平衡体系所需要的最少物种数,简称组分数,用符号C表示。
组分数=物种数-独立的化学平衡数-独立的限制条件数C=S -R-R´S:物种数,即体系所含物质的数目R:独立的化学平衡反应数R´:独立的限制条件数,比如浓度,比例等例如:N2+3H2= 2NH3高温、催化剂存在时S = 3, R = 1, R´= 0, 则:C=3-1-0 = 2 (双组分系统)高温、催化剂存在且N2:H2=1 : 3 时S = 3, R = 1, R´= 1, 则:C=3-1-1 = 1 (单组分系统)自由度数:确定和保持平衡状态所需的独立改变的变量的数目,称为自由度数,用F 表示。