物理化学简明教程(第四版)第五章+多相平衡
- 格式:ppt
- 大小:2.83 MB
- 文档页数:76









![物理化学答案——第五章-相平衡[1]](https://uimg.taocdn.com/dfd716cccf2f0066f5335a8102d276a2002960b8.webp)
物理化学答案——第五章-相平衡[1]第五章相平衡⼀、基本公式和内容提要基本公式1. 克劳修斯—克拉贝龙⽅程mmH dp dT T V ?=?相相(克拉贝龙⽅程,适⽤于任何纯物质的两相平衡)2ln mH d p dT RT=相(克劳修斯—克拉贝龙⽅程,适⽤与其中⼀相为⽓相,且服从理想⽓体状态⽅程的两相间平衡)2.特鲁顿(Trouton)规则1188vap mvap m bH S J mol k T --?=?≈??(T b 为该液体的正常沸点)3.相律f+Φ=C+n C=S-R-R ′ f+Φ=C+2 (最普遍形式)f* +Φ=C+1 (若温度和压⼒有⼀个固定,f * 称为“条件⾃由度”)*4. Ehrenfest ⽅程2112()p p C C dpdT TV αα-=-(C p ,α为各相的恒压热容,膨胀系数)基本概念1.相:体系中物理性质和化学性质完全均匀的部分,⽤Φ表⽰。
相的数⽬叫相数。
2.独⽴组分数C =S -R -R ′,S 为物种数,R 为独⽴化学反应计量式数⽬,R ′为同⼀相中独⽴的浓度限制条件数。
3.⾃由度:指相平衡体系中相数保持不变时,所具有独⽴可变的强度变量数,⽤字母 f 表⽰。
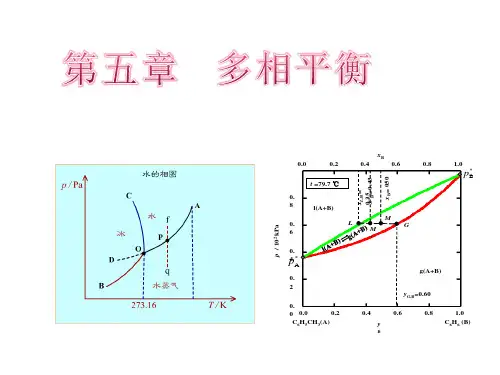
单组分体系相图相图是⽤⼏何图形来描述多相平衡系统宏观状态与 T 、p 、X B (组成)的关系。
单组分体系,因 C =1 ,故相律表达式为 f =3-Φ。
显然 f 最⼩为零,Φ最多应为 3 ,因相数最少为 1 ,故⾃由度数最多为 2 。
在单组分相图中,(如图5-1,⽔的相图)有单相的⾯、两相平衡线和三相平衡的点,⾃由度分别为 f =2、f =1、f =0。
两相平衡线的斜率可由克拉贝龙⽅程求得。
图5-1⼆组分体系相图根据相律表达式f=C-Φ+2=4-Φ,可知f最⼩为零,则Φ最多为 4 ,⽽相数最少为 1 ,故⾃由度最多为 3 。
为能在平⾯上显⽰⼆组分系统的状态,往往固定温度或压⼒,绘制压⼒-组成(p-x、y)图或温度-组成(T-x、y)图,故此时相律表达式为f*=3-Φ,⾃然f*最⼩为 0 ,Φ最多为 3,所以在⼆组分平⾯图上最多出现三相共存。