- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
•
C+O2=CO2
[1]
•
CO+0.5O2=CO2
[2]
•
C+0.5O2=CO
[3]
•
C+CO2=2CO
[4]
• 以上四个反应中,只有两个是独立的,其它的可以由此两个独立反应组合
得到,如反应(3)可由反应(1)减反应(2)得到:
• •∴
•
C+O2-CO-0.5O2=CO2-CO2 C+0.5O2=CO
相平衡条件
B
B
BΦ
化学平衡条件 BB 0
B
2020/6/19
-- 11 --
§5.3 相律及其应用
相律(phase rule)
相律是相平衡体系中,揭示相数 , 独立组分
数C 和自由度 f 之间关系的规律.
f = C -Φ + 2
式中 2 通常指 T, p 两个变量. 相律最早由Gibbs提
• 体系在一般情况下的独立变量数为3, 如T,p和NaCl的浓度.
2020/6/19
-- 10 --
§5.2 多相体系平衡的一般条件
多相平衡系统中, 相与相之间没有任何限制, 它 们之间可有热交换、功的传递及物质交流. 即每个 相是互相敞开的, 对具有Φ个相系统的热力学平衡, 实际上包含了如下四个平衡条件:
热平衡条件 T T TΦ 压力平衡条件 p p pΦ
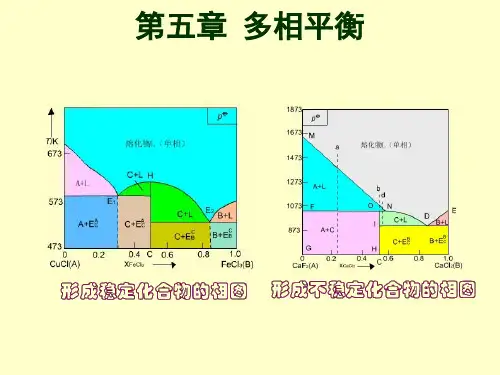
第五章 多相平衡
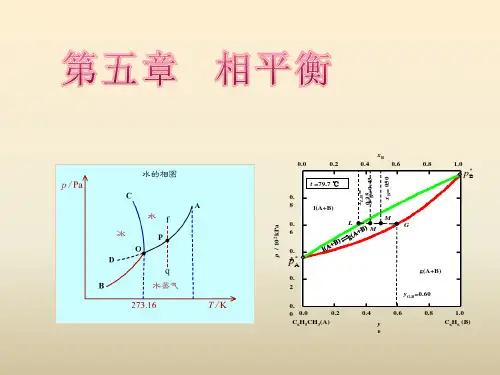
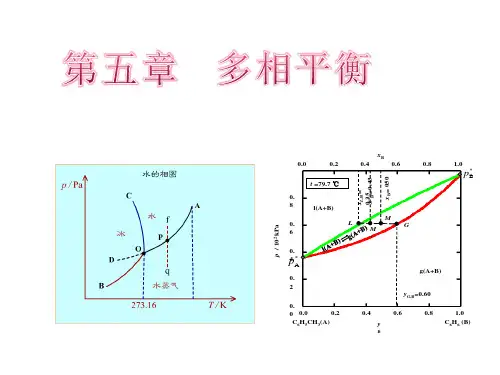
§5.1 基本概念 §5.2 多相体系平衡的一般条件 §5.3 相律及其应用 §5.4 单组分系统相图 §5.5 二组分系统的相图
§5.6 三组分系统的相图
2020/6/19
-- 1 --
相平衡是热力学在化学领域中的重要应用之一。 研究多相体系的平衡在化学、化工的科研和生产中 有重要的意义,例如:溶解、蒸馏、重结晶、萃取、 提纯及金相分析等方面都要用到相平衡的知识。
• • 体系:
CaCO3(s) = CaO(s) + CO2(g) S=3, R=1, =3.
• 有关系: n(CaO)=n(CO2) • 但因两者分别存在于固相和气相,不在同一相中,所以不能构
成浓度限制条件, 故R’=0. 体系的组分数为:
•
C=S-R-R’=3-1-0=2
2020/6/19
-- 9 --
2020/6/19
-- 3 --
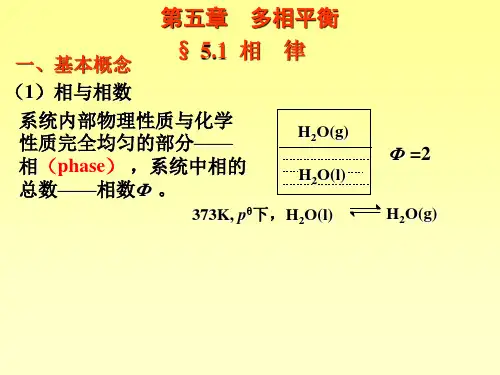
§5.1 基本概念
1 相(phase)
多相平衡系统中物理和化学性质完全均匀 (分 散度达到分子数量级)的部分.
相数 (number of phase): 系统中包含的相的总数 称为相数, 用Φ 表示.
体系含有两个以上的相为多相体系.
2020/6/19
-- 4 --
应用举例: 气体: 不论有多少种气体混合, 只有一个气相. 液体: 按其互溶程度可以组成一相、两相或三 相共存。
能够表示系统中各相组成所需要的最少独立物 种数, 用C 表示.
即
C S RR'
R — 表示独立的化学平衡数目.
R’— 表示化学平衡中同一相浓度限制条件的个 数.
2020/6/19
-- 6 --
• 例: 由O2,C,CO,CO2组成体系,求体系的独立化学反应数R?
• 解: 对于由O2,C,CO,CO2组成体系,存在如下化学反应:
故题给体系的化学反应限制条件R=2.
2020/6/19
-- 7 --
• 例如: 一气体体系,开始为纯NH3气体, 求组分数?
•
达下列反应达平衡: 2NH3 = N2 + 3H2
• 平衡后有3个物种: N2, H2, NH3
• 存在一个化学反应: R=1.
• 因体系中的H2和N2是由NH3分解而来,故两者的物质的量的比
4 自由度(degrees of freedom)
在不引起旧相消失和新相形成的前提下,可以在一 定范围内独立变动的强度性质,用f 表示。这些强 度变量通常是压力、温度和浓度等。
如果已指定某个强度变量,除该变量以外的其它强
度变量数称为条件自由度,用 f *表示。
例如:指定了压力,
f * f 1
指定了压力和温度, f ** f 2
• 例: 将NH4HS放入抽空的瓶中分解,求体系的 f ?
• 解: 有反应:
NH4HS(s) = NH3(g) + H2S(g)
•
S=3
•
R=1
分解反应平衡
•
R’= 1 [p(NH3)=p(H2S)]
•
∴ C=3-1-1=1
•
f = C- + 2=1-2 + 2=1
• 即此体系的温度和压力两变量中只有一个是独立的. 如当体
系的温度固定时, 因为NH4HS的分解压力一定,故体系的压力 恒定; 反之,若体系的压力一定,体系的温度必也被确定.
2020/6/19
-- 14 --
• 例: 求食盐水溶液的自由度?
• 解: (1) S=2
•
R=0 无化学反应
•
R’=0 无浓度限制条件
•
C= S-R-R’= 2-0-0= 2
•
f = C- + 2 = 2-1+2 = 3
相变过程和相平衡的特点:在一定条件下,各 组分能在不同的相间发生转移,并达到动态平衡。
2020/6/19
-- 2 --
本章主要讨论两方面的内容: 相律 多相平衡系统所遵循的规律.
相图 多相平衡系统的状态随温度、压力、浓度 变化的几何图, 即状态图.
本章内容是在相律的指导下研究各种不同平衡 系统的相图. 学习时要掌握用相律讨论相图的方法, 能够读懂相图.
出,所以又ቤተ መጻሕፍቲ ባይዱ为Gibbs相律.
如果除T, p 外, 还受其它力场影响, 则 2 改用 n 表
示, 即:
f = C-Φ + n
2020/6/19
-- 12 --
相律公式的应用 指导平衡系统的研究和分析相图 ① 确定系统的自由度数目. ② 确定给定系统允许存在的最大相数目.
2020/6/19
-- 13 --
固体: 一般有一种固体便为一个相. 两种固体 粉末无论混合得多么均匀, 仍是两个相 (固体溶液 除外,它是单相).
2020/6/19
-- 5 --
2 物种数(number of substance)
系统中所含的的化学物质数成为“物种数”, 用 S 表示.
3 组分数(number of components)
是一常数: n(H2):n(N2)=3:1 R’=1
Q C S R R' 3111
2020/6/19
-- 8 --
• 注意: 浓度限制条件只有在同一相中才能使用,若两组分分别
出现于不同的相中,虽然两者的量之间存在某恒定的关系,也
不能构成浓度限制条件.
• 例: 由CaCO3分解得到的体系,有反应: