气体的pVT性质
- 格式:ppt
- 大小:1.30 MB
- 文档页数:59



第一章气体的pVT性质1.1物质的体膨胀系数与等温压缩率的定义如下试推出理想气体的,与压力、温度的关系。
解:根据理想气体方程1.5两个容积均为V的玻璃球泡之间用细管连结,泡内密封着标准状态下的空气。
若将其中的一个球加热到100 ︒C,另一个球则维持0 ︒C,忽略连接细管中气体体积,试求该容器内空气的压力。
解:由题给条件知,(1)系统物质总量恒定;(2)两球中压力维持相同。
标准状态:因此,1.9 如图所示,一带隔板的容器内,两侧分别有同温同压的氢气与氮气,二者均可视为理想气体。
(1)保持容器内温度恒定时抽去隔板,且隔板本身的体积可忽略不计,试求两种气体混合后的压力。
(2)隔板抽取前后,H2及N2的摩尔体积是否相同?(3)隔板抽取后,混合气体中H2及N2的分压立之比以及它们的分体积各为若干?解:(1)等温混合后即在上述条件下混合,系统的压力认为。
(2)混合气体中某组分的摩尔体积怎样定义?(3)根据分体积的定义对于分压1.11 室温下一高压釜内有常压的空气,为进行实验时确保安全,采用同样温度的纯氮进行置换,步骤如下:向釜内通氮气直到4倍于空气的压力,尔后将釜内混合气体排出直至恢复常压。
重复三次。
求釜内最后排气至恢复常压时其中气体含氧的摩尔分数。
解:分析:每次通氮气后至排气恢复至常压p,混合气体的摩尔分数不变。
设第一次充氮气前,系统中氧的摩尔分数为,充氮气后,系统中氧的摩尔分数为,则,。
重复上面的过程,第n次充氮气后,系统的摩尔分数为,因此。
1.13 今有0 ︒C,40.530 kPa的N2气体,分别用理想气体状态方程及van der Waals 方程计算其摩尔体积。
实验值为。
解:用理想气体状态方程计算气(附录七)用van der Waals计算,查表得知,对于N2,用MatLab fzero函数求得该方程的解为也可以用直接迭代法,,取初值,迭代十次结果1.16 25 ︒C时饱和了水蒸气的湿乙炔气体(即该混合气体中水蒸气分压力为同温度下水的饱和蒸气压)总压力为138.7 kPa,于恒定总压下冷却到10 ︒C,使部分水蒸气凝结为水。


第一章 气体的PVT 性质主要内容1. 理想气体状态方程及微观模型2. Daltonp 定律与Amagat 定律3. 实际气体的PVT 性质4. 范德华方程5. 实际气体的液化与临界性质重点1. 重点掌握理想气体状态方程及微观模型2. 重点掌握Daltonp 定律与Amagat 定律3. 重点掌握实际气体的液化与临界性质难点1. 理想气体模型及其理论解释2. 实际气体的液化与临界性质教学方式1. 采用CAI 课件与黑板讲授相结合的教学方式2. 合理运用问题教学或项目教学的教学方法教学过程一、理想气体状态方程17世纪中期,为了寻找气体的状态方程,通过大量实验得出:状态方程: pV =nRT (其中压力越低越符合条件)R =0lim m p pV R T p T→=↓↑ R=8.314J/K ⋅mol 理想气体定义与模型定义:在任何温度及任何压力下都能严格服从上面的状态方程的气体就定义为理想气体。
上式就称为理想气体的状态方程。
模型:分子为质点,无体积;分子间无相互作用力。
二、Daltonp 定律与Amagat 定律1. Daltonp 定律与分压力混合气体的总压力等于混合气体中各组分气体在与混合气体有相同温度和相同体积条件下单独存在时所产生的压力之和(只适用于理想气体)。
B Bp p =∑ B B p y p =(适用于任何气体)分压力B p 是它的摩尔分数B y 与混合气体的总压力p 之积。
2. Amagat 定律混合气体的总压力等于混合气体中各组分气体在与混合气体有相同温度和相同体积条件下单独存在时所产生的压力之和(只适用于理想气体)。
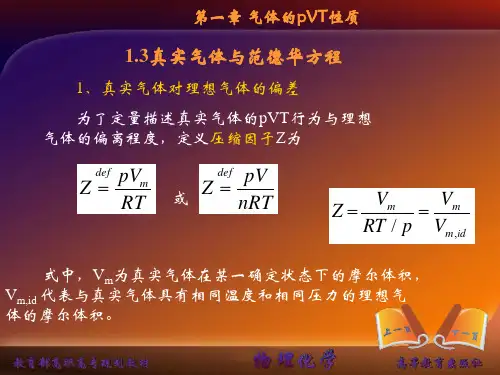
BB V V =∑ (只适用于理想气体)//B B B V y nRT p n RT p ==(只适用于理想气体)三、实际气体的PVT 性质,///m m m m idV V Z pV nRT pV RT RT p V ==== m V 实际气体在某一确定状态下的摩尔体积,m id V 代表与实际有相同温度和相同压力的理想气体的摩尔体积用大小相等分子间的引力与斥力作比理想气体易压缩同温同压下,实际气体比理想气体难压缩同温同压下,实际气体111=<>Z四、范德华方程RT b V V a p m m=-+))((2 22()()n a p V nb nRT V+-= 五、实际气体的液化与临界性质 1. c T T >,任何p 均不液化同一温度,p ↑,偏离↑ 同一压力,T ↓,偏离↑ 2. c T T <3. c T T =,临界点定义 临界温度c T临界压力c P临界摩尔体积c V。





第1章气体的pVT性质思考题1.如何使一个尚未破裂而被打瘪的乒乓球恢复原状?采用了什么原理?2.在两个密封、绝热、体积相等的容器中,装有压力相等的某理想气体。
试问这两容器中气体的温度是否相等?3.两个容积相等的玻璃球内充满N2(g),两球中间用一玻管相通,管中间有一水银滴将两边的气体分开。
当左球的温度为273K,右球的温度为293K时,水银滴处在中间达成平衡。
试问:(1)若将左球的温度升高10K,中间水银滴向哪边移动?(2)若两球同时都升高10K,水银滴向哪边移动?4.在大气压力下,将沸腾的开水迅速倒入保温瓶中,达该瓶容积的70%左右,迅速塞上软木塞防止漏气,然后放开手,请估计会发生什么现象?5.当纯物质的气、液两相处于平衡时,不断升高平衡温度,这时处于平衡状态的气液两相的摩尔体积V m(l)和V m(g)将如何变化?6.如何定义气体的临界温度和临界压力?7.处于临界点的各物质有何共同特性?概念题1.在温度、容积恒定的容器中,含有A和B两种理想气体,这时A的分压和分体积分别为p A和V A。
若在容器中再加入一定量的理想气体C,问p A和V A的变化。
(A)p A,V A都变大(B)p A,V A都变小(C)p A不变,V A变小(D)p A变小,V A不变2.在温度T、容积V恒定的容器中,含有A和B两种理想气体,它们的物质的量、分压和分体积分别为能n A,p A,V A和n B,p B,V B,容器中的总压力为p。
试判断下列公式中哪个是正确的?(A)p A V=n A RT(B)pV B=(n A+n B)RT(C)p A V A=n A RT(D)p B V B= n B RT3.已知H2(g)的临界温度和压力分别为T c=33.3K,p c=1.297×106Pa。
有一氢气钢瓶,在298K时瓶内的压力为98.0×106Pa,问这时氢气的状态。
(A)液态(B)气态(C)气—液两相平衡(D)无法确定4.在一个绝热真空容器中,灌满373K和压力为101.325kPa的纯水,不留一点空隙,这时水的饱和蒸气压为多少?(A)等于零(B)大于101.325kPa(C)小于101.325kPa(D)等于101.325kPa5.真实气体在下述哪个条件下可近似作为理想气体处理?(A)高温高压(B)低温低压(C)高温低压(D)低温高压6.真实气体液化的必要条件是什么?(A)压力大于p c(B)温度低于T c(C)体积等于V m,c(D)同时升高温度和压力7.在一个恒温、容积为2dm3的真空容器中,依次充入温度相同始态为100kPa,2dm3的N2(g)和200kPa,1dm3的Ar(g),设两者形成理想气体混合物,则容器中的总压力为多少?(A)100kPa(B)150kPa(C)200kPa(D)300kPa8.在298K时,往容积相等的A、B两个抽空容器中分别灌入100g和200g水,当达到平衡时,两容器中的水蒸气压力分别为p A和p B,则两者的关系为?(A)p A<p B(B)p A>p B(C)p A=p B (D) 无法确定9.在273K,101.325kPa时,摩尔质量为154g·mol-1的CCl4(l)的蒸气可近似看作理想气体,则气体的密度是多少(单位为g·dm-3)?(A)6.87(B)4.52(C)3.70(D)3.4410.某体积恒定的容器中装有一定量温度为300K的气体,现保持压力不变,要将气体赶出1/6,需将容器加热到的温度为多少?(A)350K(B)250K(C)300K(D)360K概念题:1。