01气体的pvt性质
- 格式:ppt
- 大小:1.56 MB
- 文档页数:105



第一章 气体的PVT 性质主要内容1. 理想气体状态方程及微观模型2. Daltonp 定律与Amagat 定律3. 实际气体的PVT 性质4. 范德华方程5. 实际气体的液化与临界性质重点1. 重点掌握理想气体状态方程及微观模型2. 重点掌握Daltonp 定律与Amagat 定律3. 重点掌握实际气体的液化与临界性质难点1. 理想气体模型及其理论解释2. 实际气体的液化与临界性质教学方式1. 采用CAI 课件与黑板讲授相结合的教学方式2. 合理运用问题教学或项目教学的教学方法教学过程一、理想气体状态方程17世纪中期,为了寻找气体的状态方程,通过大量实验得出:状态方程: pV =nRT (其中压力越低越符合条件)R =0lim m p pV R T p T→=↓↑ R=8.314J/K ⋅mol 理想气体定义与模型定义:在任何温度及任何压力下都能严格服从上面的状态方程的气体就定义为理想气体。
上式就称为理想气体的状态方程。
模型:分子为质点,无体积;分子间无相互作用力。
二、Daltonp 定律与Amagat 定律1. Daltonp 定律与分压力混合气体的总压力等于混合气体中各组分气体在与混合气体有相同温度和相同体积条件下单独存在时所产生的压力之和(只适用于理想气体)。
B Bp p =∑ B B p y p =(适用于任何气体)分压力B p 是它的摩尔分数B y 与混合气体的总压力p 之积。
2. Amagat 定律混合气体的总压力等于混合气体中各组分气体在与混合气体有相同温度和相同体积条件下单独存在时所产生的压力之和(只适用于理想气体)。
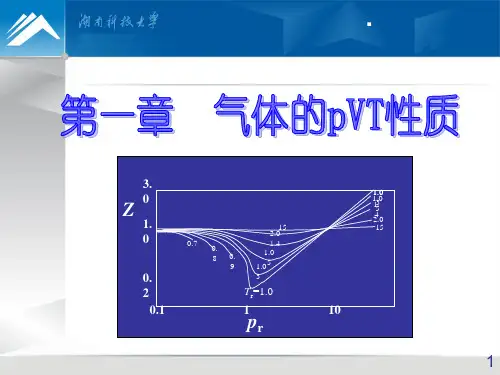
BB V V =∑ (只适用于理想气体)//B B B V y nRT p n RT p ==(只适用于理想气体)三、实际气体的PVT 性质,///m m m m idV V Z pV nRT pV RT RT p V ==== m V 实际气体在某一确定状态下的摩尔体积,m id V 代表与实际有相同温度和相同压力的理想气体的摩尔体积用大小相等分子间的引力与斥力作比理想气体易压缩同温同压下,实际气体比理想气体难压缩同温同压下,实际气体111=<>Z四、范德华方程RT b V V a p m m=-+))((2 22()()n a p V nb nRT V+-= 五、实际气体的液化与临界性质 1. c T T >,任何p 均不液化同一温度,p ↑,偏离↑ 同一压力,T ↓,偏离↑ 2. c T T <3. c T T =,临界点定义 临界温度c T临界压力c P临界摩尔体积c V。

绪论§01 物理化学课程的内容1. 物理化学是从物质的物理现象和化学现象的联系入手来探求化学变化基本规律的一门科学。
实验方法主要采用物理的方法。
2. 物理化学的主要任务:(1)化学变化的方向和限度问题。
一个化学反应在指定的条件下能否朝着预定的方向进行?如果能进行,将达到什么限度?外界条件对反应有何影响?如何控制外界条件使反应朝着我们预定的方向进 行?例:石墨制造金刚石。
上世纪末,所有实验都以失败告终,后通过热力学计算,只有 P>15000atm时,才有可能把石墨转变为金刚石。
还有合成氨 H2+N2 NH3 ,目前都是高温高压下生产,常温常压是否可能?化学热力学:方向和平衡。
(2)化学反应的速度和机理问题。
合成氨:常温常压下,理论上可行,但是没有找到合适的催化剂和最合适的反应途径。
化学动力学:主要解决反应的速度和历程问题。
(3)物质结构和性能之间的关系。
研究物质内部结构。
物理化学:化学热力学、化学动力学和结构化学§0-2 学习物理化学的要求和方法第一章 气体的 pVT 性质§1-1 理想气体的状态方程及微观模型f(p.V.T)=0 ; f(p.V.T.n)=0 这种函数关系称作状态函数。
1.理想气体状态方程波义耳(R.Boyle)定律:pV=C(n.T.恒定);盖·吕萨克定律(J.Gaylussac)V/T=C(n.p 恒 定);阿伏加德罗定律(A.Avogadro)V/n=C(T.p恒定)。
三经验定律结合PV=nRT说明:(1)是理想气体状态方程;(2)实际气体低压下近似适用;(3)R:摩尔气体常数;(4)法 定单位:p:Pa;V:m 3 ;n:mol; R:J·mol 1 ·k 1 ;T:K 。
例:推导理想气体状态方程。
解:f(p.V .n.T)=0 (状态方程)V=φ(p. T. n)dn n V dT T V dp p V dV T p n p nT , , , ÷ ø ö ç è æ ¶ ¶+ ÷ ø ö ç è æ ¶ ¶ + ÷ ÷ ø ö ç ç è æ ¶ ¶ = 波义耳定律:n,T 恒定 : p Vp C p V p C V nT - = - = ÷ ÷ ø ö ç ç è æ ¶ ¶ =2 , 盖·吕萨克定律: n,p 恒定: T V C T V T C V n p = = ÷ ø ö çè æ ¶¶× × = , 阿伏加德罗定律:T,p 恒定: n V C n V C n V T p = = ÷ ø ö çè æ ¶ ¶× × = ,dn n V dT T V dp p V dV + + - = , 0= - - + n dnT dT p dp V dV 0 ln ln ln ln = - - + n d T d p d V d , 0 ) / ln( = nT pV d nT pV / =常数, m V n V = / , m V :摩尔体积。


第一章 气体的pVT 性质无论物质是哪一种聚集状态,都有许多宏观性质,如压力p 、体积V 、温度T 、密度ρ、内能U 、熵S 等.在重多的宏观性质中,p 、V 、T 三者是物理意义非常明确、又易于直接测定的基本性质.当物质的量n 一定后,其pVT 性质不可能同时独立取值,而存在如下关系:0),,(=T V p f该函数称为状态方程.若考虑到物质的量n,则可表示为: 0),,,(=T V p n f鉴于液、固体的可压缩性一般甚小,即等温压缩率(系数) T T pVV )(1∂∂-=κ和体膨胀系数p V TVV a )(1∂∂=均较小,故在通常的物理化学计算中,常将其体积随压力和温度的变化忽略.与凝聚态相比,气体具有较大的等温压缩系数T κ和体膨胀系数V a ,其体积随温度和压力的变化较大,故一般只研究气体的pVT 性质.1.1 理想气体状态方程1.理想气体状态方程波义尔定律: 常数=pV (n,T 恒定)盖.吕萨克定律 常数=T V / (n,p 恒定)阿伏加德罗定律 常数=n V / (p,T 恒定)这三个定律都客观地反映了低压下气体服从的pVT 简单关系.将其结合可整理得到状态方程: nRT pV =此即理想气体状态方程.式中,R 是摩尔气体常数.其值经精确测定,为:11314510.8--⋅⋅=K mol J R .因摩尔体积n V V m /=,故理想气体状态方程又可写成:RT pV m = 因M m n =,Vm =ρ,故理想气体状态方程又可写成:RT Mm pV =或RT pM ρ=例: 试由上列三定律导出理想气体状态方程.解: 因任意体系均满足:0),,,(=n T V p f ,可改写成:),,(n T p f V =该式取全微分得:dn nVdT T V dp p V dV T p n p n T ,,,)()()(∂∂+∂∂+∂∂= 由波义尔定律得: 0=+Vdp pdV (T,n 恒定)此即: pV p V n T -=∂∂,)( 同理,由盖.吕萨克定律和阿伏加得罗定律可得: T V T V n p =∂∂,)(和 nV n V T p =∂∂,)( 代入全微分式得:dn nVdT T V dp p V dV ++-=)(此式即: ndn T dT p dp V dV +=+ 或 )ln()ln(nT d pV d =亦即: 0)ln(=nT pV d ,积分可得: 常数=nTpV又据阿伏加德罗定律知,当气体的p,V 一定时,体系的(V/n )为与气体各类无关的常数,故上式中的常数对任何气体都应具有相同的值,如用R 表示,则上式变为: nRT pV =这就是理想气体状态方程.2.理想气体凡在任何温度、压力下均服从方程nRT pV =的气体称理想气体. 按照上述定义,理想气体必须具备下列两个微观特征: (1).气体分子本身不占有体积,是没有大小的质点.因在T 恒定时,常数=m pV ,当0→p 时,必有0→m V (2).分子间无相互作用力.分子可近似被看作是没有体积的质点。

