第一章 气体的pVT性质
- 格式:pdf
- 大小:97.42 KB
- 文档页数:5



第一章气体的pVT性质1.1物质的体膨胀系数与等温压缩率的定义如下试推出理想气体的,与压力、温度的关系。
解:根据理想气体方程1.5两个容积均为V的玻璃球泡之间用细管连结,泡内密封着标准状态下的空气。
若将其中的一个球加热到100 ︒C,另一个球则维持0 ︒C,忽略连接细管中气体体积,试求该容器内空气的压力。
解:由题给条件知,(1)系统物质总量恒定;(2)两球中压力维持相同。
标准状态:因此,1.9 如图所示,一带隔板的容器内,两侧分别有同温同压的氢气与氮气,二者均可视为理想气体。
(1)保持容器内温度恒定时抽去隔板,且隔板本身的体积可忽略不计,试求两种气体混合后的压力。
(2)隔板抽取前后,H2及N2的摩尔体积是否相同?(3)隔板抽取后,混合气体中H2及N2的分压立之比以及它们的分体积各为若干?解:(1)等温混合后即在上述条件下混合,系统的压力认为。
(2)混合气体中某组分的摩尔体积怎样定义?(3)根据分体积的定义对于分压1.11 室温下一高压釜内有常压的空气,为进行实验时确保安全,采用同样温度的纯氮进行置换,步骤如下:向釜内通氮气直到4倍于空气的压力,尔后将釜内混合气体排出直至恢复常压。
重复三次。
求釜内最后排气至恢复常压时其中气体含氧的摩尔分数。
解:分析:每次通氮气后至排气恢复至常压p,混合气体的摩尔分数不变。
设第一次充氮气前,系统中氧的摩尔分数为,充氮气后,系统中氧的摩尔分数为,则,。
重复上面的过程,第n次充氮气后,系统的摩尔分数为,因此。
1.13 今有0 ︒C,40.530 kPa的N2气体,分别用理想气体状态方程及van der Waals 方程计算其摩尔体积。
实验值为。
解:用理想气体状态方程计算气(附录七)用van der Waals计算,查表得知,对于N2,用MatLab fzero函数求得该方程的解为也可以用直接迭代法,,取初值,迭代十次结果1.16 25 ︒C时饱和了水蒸气的湿乙炔气体(即该混合气体中水蒸气分压力为同温度下水的饱和蒸气压)总压力为138.7 kPa,于恒定总压下冷却到10 ︒C,使部分水蒸气凝结为水。

第一章 气体的PVT 性质主要内容1. 理想气体状态方程及微观模型2. Daltonp 定律与Amagat 定律3. 实际气体的PVT 性质4. 范德华方程5. 实际气体的液化与临界性质重点1. 重点掌握理想气体状态方程及微观模型2. 重点掌握Daltonp 定律与Amagat 定律3. 重点掌握实际气体的液化与临界性质难点1. 理想气体模型及其理论解释2. 实际气体的液化与临界性质教学方式1. 采用CAI 课件与黑板讲授相结合的教学方式2. 合理运用问题教学或项目教学的教学方法教学过程一、理想气体状态方程17世纪中期,为了寻找气体的状态方程,通过大量实验得出:状态方程: pV =nRT (其中压力越低越符合条件)R =0lim m p pV R T p T→=↓↑ R=8.314J/K ⋅mol 理想气体定义与模型定义:在任何温度及任何压力下都能严格服从上面的状态方程的气体就定义为理想气体。
上式就称为理想气体的状态方程。
模型:分子为质点,无体积;分子间无相互作用力。
二、Daltonp 定律与Amagat 定律1. Daltonp 定律与分压力混合气体的总压力等于混合气体中各组分气体在与混合气体有相同温度和相同体积条件下单独存在时所产生的压力之和(只适用于理想气体)。
B Bp p =∑ B B p y p =(适用于任何气体)分压力B p 是它的摩尔分数B y 与混合气体的总压力p 之积。
2. Amagat 定律混合气体的总压力等于混合气体中各组分气体在与混合气体有相同温度和相同体积条件下单独存在时所产生的压力之和(只适用于理想气体)。
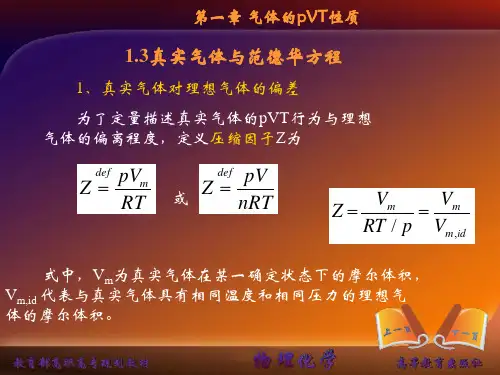
BB V V =∑ (只适用于理想气体)//B B B V y nRT p n RT p ==(只适用于理想气体)三、实际气体的PVT 性质,///m m m m idV V Z pV nRT pV RT RT p V ==== m V 实际气体在某一确定状态下的摩尔体积,m id V 代表与实际有相同温度和相同压力的理想气体的摩尔体积用大小相等分子间的引力与斥力作比理想气体易压缩同温同压下,实际气体比理想气体难压缩同温同压下,实际气体111=<>Z四、范德华方程RT b V V a p m m=-+))((2 22()()n a p V nb nRT V+-= 五、实际气体的液化与临界性质 1. c T T >,任何p 均不液化同一温度,p ↑,偏离↑ 同一压力,T ↓,偏离↑ 2. c T T <3. c T T =,临界点定义 临界温度c T临界压力c P临界摩尔体积c V。





一、填空题1.温度为400K ,体积为2m 3的容器中装有2mol 的理想气体A 和8mol 的理想气体B ,则该混合气体中B 的分压力p B =( )KPa 。
13.3022.在300K ,100KPa 下,某理想气体的密度ρ=80.8275×10-3kg ·m -3。
则该气体的摩尔质量M=( )。
3.恒温100°C 下,在一带有活塞的气缸中装有3.5mol 的水蒸气H 2O (g ),当缓慢地压缩到压力p=( )KPa 是才可能有水滴H 2O (l )出现。
4.恒温下的理想气体,其摩尔体积随压力的变化率Tmp V ⎪⎪⎭⎫ ⎝⎛∂∂ =( )。
5,一定的范德华气体,在恒容条件下,其压力随温度的变化率()=∂∂V T /p .6.理想气体的微观特征是:( )7. 在临界状态下,任何真实气体的宏观特征为:( )8. 在n,T 在一定的条件下,任何种类的气体当压力趋近于零时均满足:()=→pV p lim 0( ).9.实际气体的压缩因子定义为Z=( )。
当实际气体的Z>1时,说明该气体比理想气体( )三、问答题理想气体模型的基本假设是什么?什么情况下真实气体和理想气体性质接近?增加压力真实气体就可以液化,这种说法对吗,为什么?第二章 热力学第一定律――附答案一、填空题1. 理想气体向真空膨胀过程 , 下列变量中等于零的有 : 。
2. 双原子理想气体经加热内能变化为 ,则其焓变为 。
3. 在以绝热箱中置一绝热隔板,将向分成两部分,分别装有温度,压力都不同的两种气体,将隔板抽走室气体混合,若以气体为系统,则此过程 。
4. 绝热刚壁容器内发生CH 4+2O 2=CO 2+2H 2O 的燃烧反应,系统的 Q ___ 0 ; W ___ 0 ;∆U ___ 0;∆H ___ 05. 某循环过程 Q = 5 kJ, 则 ∆U + 2W + 3 ∆(pV) = __________.6. 298K 时, S 的标准燃烧焓为-296.8 kJ ⋅mol -1, 298K 时反应的标准摩尔反应焓 ∆r H m = ________ kJ ⋅mol -1 .7. 已知 的 , 则 的 。

物理化学复习提纲第一章气体的pVT性质1.什么叫理想气体,理想气体的微观特征是什么?在任何温度压力下均服从理想气体状态方程(PV=nRT)的气体称为理想气体。
理想气体在微观上具有以下两个特征:1、分子间无相互作用力。
2、分子本身不占有体积2.道尔顿分压定律的内容,及数学表达式是什么?它是由于什么气体?混合气体总压力等于混合气体中各组分气体在于混合其遗体具有相同温度和相同体积下单独存在时所产生的压力和;PB=nBRT/V,适用于理想气体。
3.什么叫气体的液化?理想气体能液化吗?一定温度范围内,施加足够大的压力,使气体凝聚成液体的过程;能。
4.什么叫饱和蒸气压?对于确定的物质饱和蒸气压只与什么有关?在一定的温度下,物质的液气平衡共存状态下的蒸汽所产生的压力叫饱和蒸汽压,温度。
5.什么叫液体的沸点?沸点与什么有关?沸腾是在一定温度下液体内部和表面同时发生的剧烈汽化现象。
液体沸腾时候的温度被称为沸点。
沸点随外界压力变化而改变,6.什么叫临界温度?使物质由气相变为液相所允许的最高温度叫临界温度。
7.范德华方程的两个常数a和b都与什么有关?a气体分子间引力的大小。
B气体分子本身体积的大小。
第二章热力学第一定律1.系统有哪几种?各自的特点是什么?敞开:既有能量又有物质,封闭:只有能量没有物质。
隔离:既没又没有。
2.什么叫广度性质,什么叫强度性质?就是具有加和性的物理量,与系统中物质的量有关,强度性质:就是不具有加和性的物理量,与系统中物质的量无关。
3.状态函数的特点是什么?1.状态函数的变化值只取决于系统的始态和终态,与中间变化过程无关;2,状态函数的微变dX为全微分。
3,具有单值性。
4.典型的单纯pVT过程有哪些?特点是什么?恒温、恒压、恒容、绝热、循环、5.反应进度的定义是什么?他与什么有关,与什么没关?反应进度是用来描述某一化学反应进行程度的物理量,它具有与物质的量相同的量纲,SI单位为mol,用符号ξ表示。