普通化学总复习 北京大学
- 格式:pdf
- 大小:218.52 KB
- 文档页数:40


普通化学复习资料3.1物质的结构与物质的状态3.1.1原子结构1.核外电子的运动特性核外电子运动具有能量量子化、波粒二象性和统计性的特征,不能用经典的牛顿力学来描述核外电子的运动状态。
2.核外电子的运动规律的描述由于微观粒子具有波的特性,所以在量子力学中用波函数Ψ来描述核外电子的运动状态,以代替经典力学中的原子轨道概念。
(1)波函数Ψ(原子轨道):用空间坐标来描写波的数学函数式,以表征原子中电子的运动状态。
一个确定的波函数Ψ,称为一个原子轨道。
(2)概率密度(几率密度):Ψ2表示微观粒子在空间某位置单位体积内出现的概率即概率密度。
(3)电子云:用黑点疏密的程度描述原子核外电子出现的概率密度(Ψ2)分布规律的图形。
黑点较密的地方,表示电子出现的概率密度较大,单位体积内电子出现的机会较多。
(4)四个量子数:波函数Ψ由n.l.m三个量子数决定,三个量子数取值相互制约:1)主量子数n的物理意义:n的取值:n=1,2,3,4……∞ ,意义:表示核外的电子层数并确定电子到核的平均距离;确定单电子原子的电子运动的能量。
n = 1,2,3,4, ……∞,对应于电子层K,L,M,N, ···具有相同n值的原子轨道称为处于同一电子层。
2)角量子数ι:ι的取值:受n的限制,ι= 0,1,2……n-1 (n个)。
意义:表示亚层,确定原子轨道的形状;对于多电子原子,与n共同确定原子轨道的能量。
…ι的取值: 1 , 2 , 3 , 4电子亚层:s, p, d, f……轨道形状:球形纺锤形梅花形复杂图3-13)磁量子数m:m的取值:受ι的限制, m=0 ,±1,±2……±ι(2ι+1个) 。
意义:确定原子轨道的空间取向。
ι=0, m=0, s轨道空间取向为1;ι=1, m=0 ,±1, p轨道空间取向为3;ι=2, m=0 ,±1,±2 , d轨道空间取向为5;……n ,ι相同的轨道称为等价轨道。

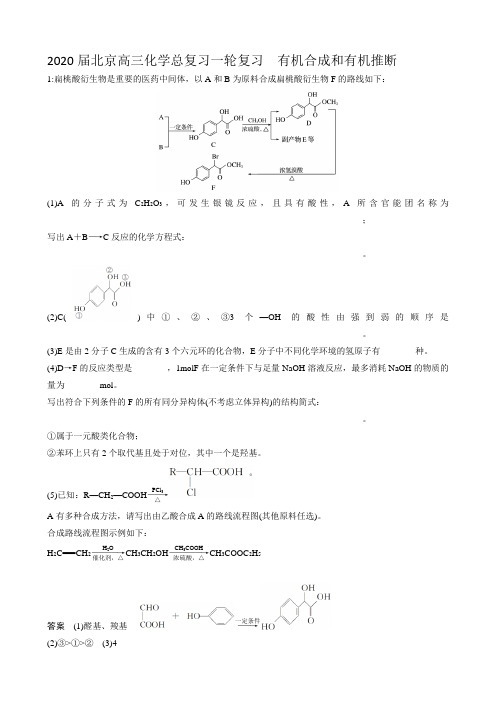
2020届北京高三化学总复习一轮复习 有机合成和有机推断1:扁桃酸衍生物是重要的医药中间体,以A 和B 为原料合成扁桃酸衍生物F 的路线如下:(1)A 的分子式为C 2H 2O 3,可发生银镜反应,且具有酸性,A 所含官能团名称为________________________________________________________________________; 写出A +B ―→C 反应的化学方程式:___________________________________________ ________________________________________________________________________。
(2)C()中①、②、③3个—OH 的酸性由强到弱的顺序是________________________________________________________________________。
(3)E 是由2分子C 生成的含有3个六元环的化合物,E 分子中不同化学环境的氢原子有________种。
(4)D →F 的反应类型是________,1molF 在一定条件下与足量NaOH 溶液反应,最多消耗NaOH 的物质的量为________mol 。
写出符合下列条件的F 的所有同分异构体(不考虑立体异构)的结构简式:_____________ ________________________________________________________________________。
①属于一元酸类化合物;②苯环上只有2个取代基且处于对位,其中一个是羟基。
(5)已知:R —CH 2—COOH ――→PCl 3△A 有多种合成方法,请写出由乙酸合成A 的路线流程图(其他原料任选)。
合成路线流程图示例如下:H 2C===CH 2――――→H 2O催化剂,△CH 3CH 2OH ―――――→CH 3COOH浓硫酸,△CH 3COOC 2H 5答案 (1)醛基、羧基 ――→一定条件(2)③>①>② (3)4(4)取代反应3(5)盐酸――→2、软质隐形眼镜材料W、树脂X的合成路线如下:(1)A 中含有的官能团名称是。

《普通化学》综合复习资料.doc《普通化学》综合复习资料⼀、判断题1、体系和环境Z间的能量交换⽅式有热传递和做功,另外还有其他的⽅式。
(X )2、BF3和NH3都是⾮极性分⼦。
(x )3、可逆反应达平衡时,正反应速率与逆反应速率相等。
(勺)4、在0.1mol dm-3H2S 溶液中,c(H+): c(S2_)=2: 1。
( x )5、分⼦品体熔沸点的⾼低,决定于分⼦内部共价键的强弱。
(x )6、同⼀聚集状态的物质的标准摩尔嫡值在低温时⼤于⾼温时的燔值。
(x )7、内轨型配合物的⼬⼼离⼦采⽤内层轨道进⾏杂化,(n-l)d轨道的能量⽐nd轨道低,所以内轨型配合物[Fe(CN)6⼴⽐外轨型配合物[FeF6]3-稳定。
(7 )8、在任意条件下,标准电极电势⼤的电对中氧化态物质在反应过程中做氧化剂。
(x )9、由于Si原⼦和Cl原⼦的电负性不同,所以SiC14分⼦具有极性。
(x )10、sp杂化轨道成键能⼒⽐杂化前的s 轨道和p轨道成键能⼒都强。
(7 )11、通常所谓的原⼦半径,并不是指单独存在的⾃由原⼦本⾝的半径。
(x )12、在放热反应中,温度升⾼不会影响反应的平衡常数。
(x )13、标准吉布斯函数变⼩于零的反应可以⾃发进⾏。
(x )14、同⼀⾮⾦属元素⾼价态的氯化物⽐低价态的溶沸点⾼。
(7 )15、AS〉。
的反应⼀定是⾃发反应。
(x )16、温度升⾼,化学反应速度加快的主要原因是温度升⾼,反应物分⼦的热运动速度加快,分⼦的碰撞频率增⼤。
(x )17、催化剂能够改变化学反应速率的原因是因为催化剂参加了化学反应,改变了化学反应的途径,降低了化学反应的活化能。
(P )18、化学反应的级数等于反应物分⼦在化学反应⽅程式中的计量系数之和。
(x )19、氯原⼦轨道的能级只与主量⼦数(n)有关。
(x )20、配合物⼬,配位数是指配位体的数⽬。
(x )21、原电池反应中,某电对的电极电势与电极反应的写法⽆关。
(7 )22、弱酸浓度越稀,解离度越⼤,溶液的pH值越⼩。

北京大学化学学院考试专用纸《普通化学》_05_级期终考试姓名:学号:院系:班级: 考试时间:2006年12月09 日命题教师:普通化学期末试卷(地空,05级,2006.01.09)学号:姓名:一.选择填空(每小题中,A、B、C三个选项,只有一个应选,将结果填入题二.放射性核素的衰变为一级反应。
人体内含有18%的C和0.2%的K,其中14C 和40K 为两种主要体内放射形核素。
已知天然条件下,12C和14C的原子数之比为1012:1.2, 且14C的半衰期为5730年,40K的天然丰度为0.0118% ,半衰期为1.26⨯109年。
问体重为75公斤的人死亡1年后体内残留的14C和40K的原子个数分别为多少?该人死亡1万年后,其体内剩余的14C和40K的原子个数分别为多少?若某核分析技术可探测到10个14C原子,则可判定的尸体的最多年限为多少年(12分)三.看图回答问题:(20分)(1)写出由两电对IO3-/I2,I2/I-组成的氧化还原反应的方程式;(2)当pH为a、b、c时分别指出所写反应进行的方向;(3)计算上面所写反应的平衡常数Kθ和ΔGθ(298K时)(4)计算pH=b时的b值。
此时反应的K为多少?(5)所写反应中,如起始的介质为1 mol∙dm-3 HF (Ka=3.5×10-4) 则反应的方向如何?(6)在图中用斜线条画出IO3―、I―的共同稳定区。
(7)已知pH>a时,金属阳离子A2+就会生成A(OH)2沉淀,根据图中的数据,求A(OH)2的K SP。
四.利用过量无色的Cu(NH3)2+、NH3混合溶液与O2发生反应生成有色的Cu(NH3)42+的方法,可以测量N2、O2混合气体中O2的含量。
取一体积为8.00dm3的容器使其充满N2、O2混合气(压力为101kPa,温度为250C),然后向其中加入500cm3的Cu(NH3)2+、NH3混合液。
经过不断的摇晃、振荡,使液气充分混合反应后,用比色法测得Cu(NH3)42+的浓度为2.10⨯10-3mol∙dm-3。
高中化学教辅书推荐篇一:高中化学参考书推荐※基础:1. 《高考学业水平考试课课通高一化学同步精讲与精炼(朱观华编,上海社会学院出版社)无论知识点还是题目都特基础,因此推荐大家在自己预习时候配套使用。
2. 《华东师大版一课一练》这个很基础,基本学校里的配套练习都用这个,我就不说了,大家都懂的。
※中等:1.《走进新课程课课练化学》(文汇出版社)这个是分年级的,和教材同步。
题目的设置上是层层递进的。
平时可以同步做。
2. 《新教材全解金牌教练》(吉林教育出版社)上海教材同步,内容递进,全面。
3. 《新标准精编教辅丛书最新版绿面书化学能力训练与提高》(上海教育出版社)中等难度,配有范例精讲,有题目多种解法,每个范例还有评注提出解题关键和注意点,并且配有训练题、单元测试,和上海教材配套。
关键还有个最大的好处,就是薄,刷起来比较有成就感。
还有解析非常详细。
4. 《高中知识清单》(首都师范大学,教育科学出版社)全国教材配套,概念配例题,比较详细,讲解清晰。
5. 《公式定理大全高中化学及时查》(机械工业出版社,冯建设主编)概念,基础,全国教材配套,上海可选用。
6. 《图解基础知识手册高中化学》(刘来刚主编吉林大学出版社)全国教材配套,知识点全面,总结归纳教好,疑点难点规律总结较好(基本为易错点、易考点),例题均有详细解析。
就是有些图总结的很怪:比如俯视仰视刻度线对于读数的影响,四大基本反应和氧化还原反应之间的关系,哈哈,可能是和我的习惯画法不同吧。
特点:除了正常目录(按知识体系分)之外,还有概念和知识点索引,是按拼音首字母排列的,方便查找。
以上4-6都属于真个高中知识点详析的书,建议从一开始学习的时候就可以同步的翻翻,做做题,高考复习的时候也可以用。
7. 《课标本教材完全解读王后雄学案》配苏教版(人教版等)高中化学分册分为必修1,必修2等篇二:高中化学竞赛用书推荐高中化学竞赛用书推荐常规/高考类:化学岛用户名:****************密码:woaihuaxuedao以下是另一个公邮密码:huaxuedaogongyou提供公共邮箱的目的还是方便大家交流,如果遇到超出流量限制的问题,可以直接把邮件转发出去。
※内能:体系中各种形式运动能量的总和,用U或E表示。
目前仍无法测量、计算一个体系内能的绝对值,但是内能变化的相对值(ΔU),可以通过两个状态之间能量的得失来求出,与过程无关。
※热力学第一定律:ΔU=Q+W W=-P外ΔV(只有体积功的时候)※通过不同途径从同样的初态膨胀或压缩到同样的终态环境对体系的功不同。
由此给出一个重要结论:压强-体积功是一个和途径有关的物理量。
※物理学上把一个体系能通过原途往返而环境无功损失的过程称为可逆过程;而把往返路径不一致因而环境有功损耗的过程叫做不可逆过程。
※对于理想气体体系的各种可逆过程(没有化学反应),功、热和体系内能变化之间的关系分别为: 1.等容过程:V=0,W=0,QV=n・CV T体系的内能变化为:U=QV=nCV T(Cv等容热容,书P123~125)2.等压过程:W=P V,QP=nCP T体系的内能变化为:U=P V+nCP T=n R T+n CP T=n(CP R)T=n CV T 3.等温过程:W=nRTln(V2/V1)U=0体系从环境吸收的热量则为Q=W=nRTln(V2/V1)4.绝热过程:Q=0,W=U,U n CV T,W=U=n CV T无论什么过程,没有化学反应的理想气体体系的内能变化都是:U n CV T(因为等温过程的T=0,所以U=0)※热容比=VPCC=VVCRC=1+VCR(可以得出CV=R/(1)所以绝热过程中环境对体系所作的功为:W=U=n CV T=nRT1)※对没有化学反应的理想气体体系:U=nCV T(W和Q不是状态函数,与具体过程有关)所有过程(可逆、不可逆过程)都必须服从热力学第一定律※化学反应的热效应(只考虑体积功):化学反应发生后,产物(终态)温度恢复到反应前反应物的温度(始态),过程中体系只对抗外压力做体积功,同时放出或吸收的热为此反应的反应热a)恒容反应热:等容过程W=-PΔV=0故ΔU=Qv,ΔU=Qv=nCvΔTb)恒压反应热:在等压过程中W=-PΔV,ΔU=Q+W=Qp-PΔV→Qp=ΔU-W=(U2+PV2)-(U1+PV1)说明等压反应热不仅与内能有关,也与体积变化有关Qp=nCpΔTΔU=-PΔV+nCpΔT对理想气体:ΔU=-nRΔT+nCpΔT=n(Cp-R)ΔT=nCvΔT※状态函数焓(H):H=U+PV;Qp=H2-H1=ΔH在等压过程中,体系吸收(或释放)的热量,全部用于增加(或减少)体系的焓。
北京大学化学与分子工程学院普通化学/ 第三章(2006)北京大学化学与分子工程学院普通化学/ 第三章(2006)化学动力学的三位先驱阿伦尼乌斯Svante August 范特霍夫Jacobus Henricus 奥斯特瓦尔德Wilhelm Ostwald 1853-1932普通化学/ 第三章(2006)Jiang Bian李远哲(1936-华裔美国化学家交叉分子束实验装置普通化学/ 第三章(2006)Jiang Ahmed H. Zewail 埃及裔美国化学家Caltech, USA 北京大学化学与分子工程学院普通化学/ 第三章(2006)Jiang 普通化学/ 第三章(2006)瞬时速率定义为平均速率的极值:若推广至一般情况:aA + bB →cC反应速率的定义:若反应分子一步(碰撞)直接转化为产物,则此方程即为质量作用定律。
上式中,a 为A 的反应级数,b 为B 的反应级数,为反应的总级数,k 为速率常数。
可以从基元反应出发写出反应速率的表达式。
、n要通过实验测定。
m、n分别为反应级数。
,n ≠b,则该反应必为非基元反应。
根据反应速率的定义:分别把上述实验结果代入进去,得到:n = 2普通化学/ 第三章(2006)一级反应的半衰期。
的定义:反应物减少一半所需的时间,符号作图,得一直线,其中直线的斜率为:普通化学/ 第三章(2006)北京大学化学与分子工程学院普通化学/ 第三章(2006)写出积分反应速率方程:) = 0.480 mg/100 cm 3和(A) = 0.222 mg/100 应当在下午2点42分之前注射第二针。
高能宇宙射线在大气层中产生中子,中子与反应生成。
t 1/2= 5730 a -14断代法:北京大学化学与分子工程学院指前因子(基元反应的活化能)普通化学/ 第三章(2006)为单位体积内分子的个数,即浓度。
为分子半径。
2A →B ,若假设两个反应分子碰撞是一个基元反应,即:所以化学反应速率为:同时,因为:把它带入上式,得到:24A RT d N M π=我们立刻发现它们是相似的,其中指前系数要。