1热力学第一定律2
- 格式:ppt
- 大小:1.46 MB
- 文档页数:46

热力学第一定律与第二定律热力学是研究能量与热的转化和传递规律的科学,它是自然科学中重要的分支之一。
在热力学中,第一定律和第二定律是两个基本的定律,它们定义了能量守恒和能量转化的方向,对于理解热力学系统的行为和实际应用具有重要意义。
1. 热力学第一定律热力学第一定律,也称为能量守恒定律,表明能量在系统与环境之间的传递和转化后总量保持不变。
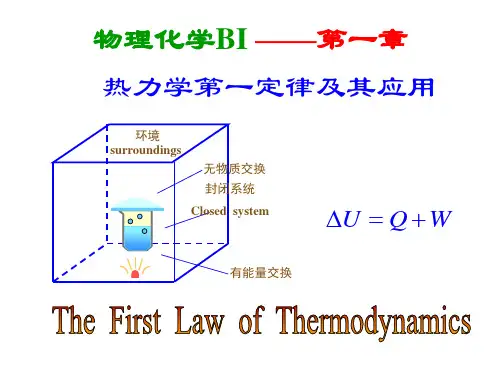
它可以通过下式表达:ΔU = Q - W其中,ΔU表示系统内能的变化,Q表示系统吸收的热量,W表示系统对外界做的功。
根据热力学第一定律,一个封闭系统的能量是守恒的,能量既不能被创造也不能被销毁,只能从一种形式转化为另一种形式。
热力学第一定律还可以用来推导出热机效率的表达式。
在一个热机中,根据热力学第一定律,系统吸收的热量等于系统对外界做的功加上系统内能的变化。
根据这个原理,我们可以得到热机效率的公式:η = 1 - Qc/Qh其中,η表示热机的效率,Qc表示热机向冷源放出的热量,Qh表示热机从热源吸收的热量。
这个公式表明,在一个热机中,不能把吸收的热量完全转化为功,一部分热量必须放出到冷源中,效率小于1。
2. 热力学第二定律热力学第二定律是热力学中最重要的定律之一,它表明热量不能自发地从低温物体传递到高温物体,而是自发地从高温物体传递到低温物体。
热力学第二定律有多种等效的表述方式,其中最常见的是克劳修斯表述和开尔文表述。
克劳修斯表述中,热量不会自发地从冷热源传递到热热源,即不存在一个热机,它只从一个热源吸热,然后完全转化为功,再把一部分热量放到冷热源上,不对环境产生任何影响。
这相当于说,在一个封闭系统中,不存在一个循环过程,使得系统对外界做的功等于输入的热量。
这个等效表述被称为克劳修斯表述。
开尔文表述中,不可能制造一个只从一个热源吸热,然后完全转化为功的热机,而不对环境产生任何影响。
这相当于说,在一个封闭系统中,不存在一个循环过程,使得系统吸收的热量完全转化为功,不放出热量到冷热源。


热力学第一定律与热力学第二定律的联系与区别热力学第一定律和热力学第二定律是热力学的两个基本定律,描述了热力学系统的动态过程和平衡状态。
热力学第一定律指出,在一个封闭系统中,热量总是从高温物体流向低温物体,直到系统达平衡状态,即温度保持不变。
这意味着热量不能自由流动,必须有外力强制它流动。
热力学第二定律则指出,热量不可能自发地从低温物体流向高温物体,即热量的总供应量等于总需求。
这意味着热量的流动必须是有方向的,并且热量的分配必须遵守热力学第二定律。
联系:
热力学第一定律和热力学第二定律都是关于热量流动的规律,它们都强调了热量在系统中的平衡和流动是有方向的。
区别:
1. 解释不同:热力学第一定律强调的是热量的流动方向,而热力学第二定律强调的是热量的流动必须遵守一定的规律。
2. 适用范围不同:热力学第一定律适用于任何可逆热力学过程,而热力学第二定律仅适用于封闭的系统。
3. 限制条件不同:热力学第一定律没有限制热量的供应量或需求,而热力学第二定律则规定了热量的总供应量必须等于总需求,从而限制了热量的流动。


热力学第一定律和第二定律热力学第一定律1. 内容:一般情况下,如果物体跟外界同时发生做功和热传递的过程,那么外界对物体做的功W,与物体从外界吸收的热量Q之和,等于物体的内能的增加量2. 数学表达式:W+Q=ΔU(1)Q取决于温度变化:温度升高,Q>0;温度降低,Q<0.(2)W取决于体积变化:V增大时,气体对外做功,W<0;V减小时,外界对气体做功,W>0.(3)特例:如果气体向真空扩散,那么W=0.(4)绝热过程Q=0,关键词是“绝热材料”或“变化迅速”。
3. 热力学第1定律的理解(1)做功改变物体的内能:外界对物体做功,物体内能增加;物体对外做功,物体内能减少。
在绝热过程,物体做多少功,改变多少内能。
(2)热传递改变物体的内能:外界向物体传递热量,即物体吸热,物体的内能增加;物体向外界传递热量,即物体放热,物体的内能减少。
传递多少热量,内能就改变多少。
(3)做功和热传递的实质,做功改变内能是能量的变化,用功的数值来度量;热传递改变内能是能量的转移,用热量来度量。
热力学第二定律1.热传导的方向性:热传导的过程可以自发地由高温物体向低温物体进行,但相反方向却不能自发地进行,即热传导具有方向性,是一个不可逆过程。
2.补充说明:(1)“自发地”过程就是不受外界干扰的条件下进行的自然过程;(2)热量可以自发地从高温物体向低温物体传递,却不能自发的从低温物体传向高温物体;(2)热力学第二定律的能量守恒表达式:ds≥δQ/T(3)热量可以从低温物体传向高温物体,必须有“外界的影响或帮助”,就是要由外界对其做功才能完成。
3.热力学第二定律的两种表述(1)克劳修斯表述:热量不能自发地从低温物体传向高温物体。
(2)开尔文表述:不可能从单一热源吸收热量,使之完全变为有用功,而不引起其他变化。

热力学基础知识热力学第一定律和第二定律热力学基础知识:热力学第一定律和第二定律热力学是物理学的一个重要分支,研究的是能量转化和能量传递规律。
在热力学中,有两个基本定律,即热力学第一定律和热力学第二定律。
这两个定律是热力学研究的基础,对我们理解自然界中的能量转化过程具有重要意义。
一、热力学第一定律热力学第一定律,也被称为能量守恒定律,是指在一个封闭系统内,能量既不能创造也不能毁灭,只能从一种形式转化为另一种形式。
它可以用一个简单的公式来表示:△U = Q - W其中,△U表示系统内部能量的变化,Q表示系统所吸收的热量,W表示系统所做的功。
根据热力学第一定律,能量的转化是相互平衡的。
系统吸收的热量等于所做的功加上内部能量的变化,这一平衡关系保证了能量守恒的原理。
它告诉我们,能量不会凭空消失,也不会突然出现,而是在转化过程中得以保存。
二、热力学第二定律热力学第二定律是热力学中的另一个重要定律,它研究的是能量转化的方向和过程中的不可逆性。
热力学第二定律有多种表述方式,其中最常见的是开尔文表述和克劳修斯表述。
1. 开尔文表述开尔文表述是基于热量不会自发地从低温物体转移到高温物体的原理,它给出了一个重要的结论:热量是自然界中不能自发转化为功的能量形式。
这一定律被称为热力学第二定律的开尔文表述。
2. 克劳修斯表述克劳修斯表述是基于热力学中的循环过程和热量无法从一个唯一的热源完全转化为功的原理。
克劳修斯表述给出了一个重要结论:不可能制造出一个热机,使之完全将吸收的热量转化为功,而不产生任何其他效果。
这一定律被称为热力学第二定律的克劳修斯表述。
热力学第二定律告诉我们,能量转化过程中总会产生一定的损失,而且损失不可逆。
这很好地解释了自然界中许多现象,如热量的自发流动、热机效率的限制等。
总结:热力学是研究能量转化和能量传递规律的科学,其中热力学第一定律和第二定律是基本定律。
热力学第一定律表明能量在系统中的转化是相互平衡的,能量守恒不变。



热学中的热力学第一定律与第二定律知识点总结热学是物理学中的一个重要分支,它研究的是热量的传递与能量的转化规律。
在热学中,热力学是一个核心概念,其中第一定律和第二定律是热力学的基本原理。
本文将对热学中的热力学第一定律和第二定律的知识点进行总结。
一、热力学第一定律热力学第一定律,也称作能量守恒定律,是热学中最基本的定律之一。
它表明在一个封闭系统中,能量的增加等于系统对外界做功与接受热量的总和。
1. 系统能量的变化根据热力学第一定律,系统的能量变化可以表示为:△U = Q - W其中,△U表示系统内能的变化,Q表示系统吸收的热量,W表示系统对外界做的功。
系统内能的变化等于系统吸收的热量减去系统对外界做的功。
2. 热力学过程中的能量转化在热力学过程中,能量可以以热量的形式传递或以功的形式进行转化。
根据热力学第一定律,系统对外界所做的功等于系统由外界吸收的热量减去系统内能的增加。
3. 等温过程和绝热过程等温过程是指系统和外界保持恒温的过程,这时系统内能的增加等于系统吸收的热量。
绝热过程是指系统与外界不进行任何热量的交换,这时系统对外界所做的功等于系统内能的增加。
二、热力学第二定律热力学第二定律是热学中另一个重要的定律,它表明热量自然地从高温物体转移到低温物体,而不会自发地由低温物体转移到高温物体。
1. 热量传递的方向根据热力学第二定律,热量只能由高温物体传递到低温物体,不会自发地由低温物体传递到高温物体。
这是因为热量自然地流动,而自然地流动的方式是从高温到低温。
2. 热力学过程的不可逆性根据热力学第二定律,热力学过程具有一定的不可逆性,即热量不可能完全转化为功而不产生其他形式的能量损失。
这是因为热量传递的过程中会有一定的熵增加,从而导致能量转化的不可逆性。
3. 热力学第二定律的表述热力学第二定律有多种不同的表述方式,其中最常见的是克劳修斯表述和开尔文表述。
克劳修斯表述强调了不可逆性的存在,开尔文表述则强调了热量流动的方向性。
热学热力学第一定律和第二定律在热学和热力学领域中,有两个重要的定律,即第一定律和第二定律。
这两个定律是基础性的原理,被广泛应用于能量转化和热力学系统的研究中。
本文将分别介绍热学热力学的第一定律和第二定律,并探讨它们的应用。
一、热学热力学第一定律热学热力学的第一定律,也被称为能量守恒原理,它表达了能量的守恒性质。
根据第一定律,能量在系统中的增加等于能量的输入减去能量的输出。
换句话说,能量不能被创造或毁灭,只能从一种形式转化为另一种形式。
第一定律的数学表达式为:ΔU = Q - W其中,ΔU表示系统内部能量的变化,Q表示系统吸收的热量,W 表示系统对外做的功。
如果ΔU为正值,代表系统内部能量增加;如果ΔU为负值,则代表系统内部能量减少。
根据第一定律,系统内的能量转化是通过热量和功的交换来实现的。
第一定律的应用非常广泛,可以用于解释许多物理和化学现象。
例如,在能量转化装置中,我们可以根据第一定律来计算输入和输出之间的能量差异,从而评估系统的能效。
此外,热力学中的一些重要概念,如内能、焓和熵,也是通过第一定律得出的。
二、热学热力学第二定律热学热力学的第二定律是关于热力学过程方向性的规律。
它指出自然界中存在一种趋势,即热量不能从低温物体传递到高温物体,除非外界做功。
这个原则被称为热力学第二定律。
第二定律有多种表达形式,其中最常见的表述是开尔文表述和克劳修斯表述。
开尔文表述简要地表达了热量自流向高温物体的趋势,而克劳修斯表述则通过热力学温标引入了熵的概念,更深入地解释了热力学第二定律。
根据热力学第二定律,热量无法完全转化为功,总是会有一部分热量以无法利用的形式散失。
这个过程被称为热力学不可逆过程。
热力学第二定律对于解释自然界中的许多现象非常重要,例如热机效率的限制、热传导的方向性以及自发反应的进行方向等等。
总结:热学和热力学的第一定律和第二定律是能量和热力学过程研究中的基础原理。
第一定律规定了能量在系统内部转化的性质,而第二定律则限制了热量的传递方式。