第四章__去极化腐蚀
- 格式:ppt
- 大小:466.50 KB
- 文档页数:63



1 电化学腐蚀的阴极过程是指:2介质中常见的阴极去极化剂及其还原反应有那些?3析氢腐蚀的必要条件是:金属的电极电势E M必须低于氢离子的还原反应电势(析氢电势E H)、即E M< E H4析氢过电势ηH与阴极电流密度ic之间存在下列关系i不同,或是不同金属材料的a H不同,这主要是因为不同金属上析氢反应的交换电流密度0H析氢反应机理不同引起的。
5析氢腐蚀速度可根据阴、阳极极化性能分为阴极控制、阳极控制和混合控制。
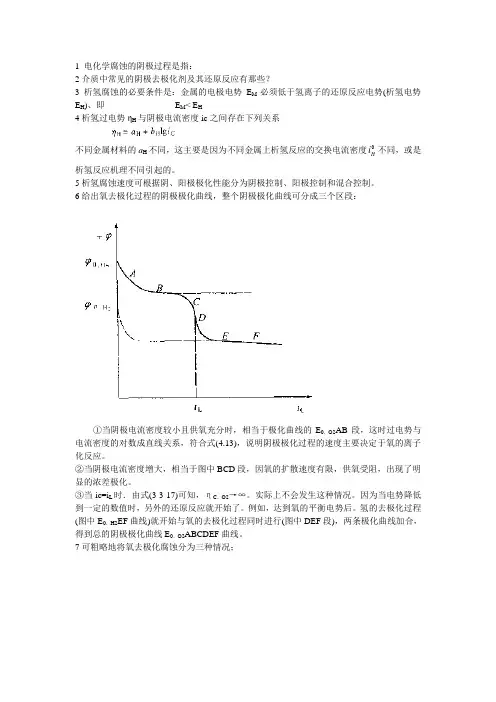
6给出氧去极化过程的阴极极化曲线,整个阴极极化曲线可分成三个区段:①当阴极电流密度较小且供氧充分时,相当于极化曲线的E0,O2AB段,这时过电势与电流密度的对数成直线关系,符合式(4.13),说明阴极极化过程的速度主要决定于氧的离子化反应。
②当阴极电流密度增大,相当于图中BCD段,因氧的扩散速度有限,供氧受阻,出现了明显的浓差极化。
③当ic=i L时.由式(3-3-17)可知,ηC,O2→∞。
实际上不会发生这种情况。
因为当电势降低到一定的数值时,另外的还原反应就开始了。
例如,达到氧的平衡电势后。
氢的去极化过程(图中E0,H2EF曲线)就开始与氧的去极化过程同时进行(图中DEF段),两条极化曲线加合,得到总的阴极极化曲线E0,O2ABCDEF曲线。
7可粗略地将氧去极化腐蚀分为三种情况;①如果腐蚀金属在溶液中的电势较高,腐蚀过程中氧的传递速度又很大,则金属腐蚀速度主要由氧在电极上的放电速度决定,这时阳极极化曲线与阴极极化曲线相交于氧还原反应的活化极化区(图4.8交点K)。
例如,铜在强烈搅拌的敞口溶液中的腐蚀。
②如果腐蚀金属在溶液中的电势很低,腐蚀过程中氧的传输速度太小,阴极过程将由氧去极化和氢离子去极化两个反应共同组成。
由图4.8中交点M可知,此时腐蚀电流大于氧的极限扩散电流。
例如,镁在中性介质中的腐蚀。
③如果腐蚀金属在溶液中的电势较低,且处于活性溶解状态,而氧的传输速度又有限,则金属腐蚀速度将由氧的极限扩散电流密度决定。
![[物理]第四章析氢腐蚀与吸氧腐蚀](https://uimg.taocdn.com/77bcf7d2ba4cf7ec4afe04a1b0717fd5360cb2f7.webp)



第四章电化学腐蚀动力学-1§4—1 电化学腐蚀速度与极化从热力学出发所建立起来的电位——pH图只能说明金属被腐蚀的趋势,但是在实际中需要解决的问题是腐蚀速度。
一. 腐蚀速度。
腐蚀速度的表示方法有三种。
1. 重量法:用腐蚀前后重量变化(只用均匀腐蚀,金属密度相同)增重法:V+ =(W1-W0)/S0t (g/m²h)失重法:V=(W0-W1)/S0t (g/m²h)式中:W0——式样原始重量。
W1——腐蚀后的重量(g,mg)S0——经受腐蚀的表面积(m²) t——经受腐蚀的时间(小时)2. 腐蚀深度法(均匀腐蚀时,金属密度不同)可用此法表示。
D深=V±/d =(W1-W0)/S0td (mm/年) 式中d为金属密度力学(或电阻)性能变化法。
(适用于晶间腐蚀,氢腐蚀等)Kσ=(σbº-σbˊ)/σbº×100% K R =(R1-R0)/R0×100%σbº,R0——式样腐蚀前的强度和电阻σbˊ,R1——式样腐蚀后的强度和电阻3. 用阳极电流密度表示V¯=Icorr×N/F =3.73*10¯4 Icorr×N (g/m²h)F——法拉第常数96500KN——金属光当量=W/n =金属原子量/金属离子价数二. 极化上一章讨论了金属电化学腐蚀的热力学倾向,并未涉及腐蚀速度和影响腐蚀速度的因素等人们最为关心的问题。
电化学过程中的极化和去极化是影响腐蚀速度的最重要因素,研究极化和去极化规律对研究金属的腐蚀与保护是很重要的。
金属受腐蚀的趋势大小是由其电极电位决定的,将两块不同金属置于电解质中,两个电极电位之差就是腐蚀原动力。
但是这个电位差数值是不稳定的,当电极上有电流流过时,就会引起电极电位的变化。
这种由于有电流流动而造成电极电位变化的现象称为电极的极化。


