化工材料基础知识培训教程
- 格式:pptx
- 大小:505.70 KB
- 文档页数:34


化工基础绪论培训课件1. 介绍本课程旨在为化工工作者提供化工基础知识的绪论培训。
通过学习本课程,学员将了解化工领域的基本概念和原理,建立起对化工工作的全面认识和理解。
2. 课程目标本课程的主要目标是:•介绍化工领域的基础概念和原理•帮助学员建立全面的化工知识体系•提供实际应用案例,帮助学员将理论知识与实践相结合•培养学员对化工工作的兴趣和热情3. 课程大纲本课程将涵盖以下几个主要主题:3.1 基本概念•化学与化工的关系•化工的定义和范围•化工工程的基本流程和环节3.2 化工原理•物质的组成和结构•化学反应和反应动力学•热力学和反应平衡•流体力学和传质现象3.3 化工设备•常见的化工设备和工艺流程•设备选择与设计原则•安全性和可靠性考虑3.4 化工应用•常见的化工应用领域•实际案例分析•行业前景和发展趋势4. 学习方法•理论讲解:通过讲解PPT和示意图,介绍化工基础的相关知识点;•实例解析:结合实际案例,分析化工领域的工作实践和应用;•互动讨论:开展小组讨论和问答环节,加深对知识的理解和掌握;•实验演示:展示一些典型的实验过程和结果,加强对理论的实际应用。
5. 考核与证书•课程结束后,学员将进行一次综合考评,包括选择题、简答题和实际应用题;•考试成绩满足及格标准的学员,将获得本课程的结业证书。
6. 培训师资本课程的培训师资由经验丰富的化工工程师组成,他们具备丰富的理论和实践经验,能够提供专业化工知识的培训和指导。
7. 结束语本课程将为学员提供一个全面了解化工基础知识的机会,帮助其在化工领域更好地发展和应用所学知识,提升自身的职业素质和竞争力。
欢迎大家参加本次培训!。

化工基础实验培训课件一、实验名称:溶液的配制与稀释1. 实验目的:•掌握溶液配制的基本原理和方法;•学会使用试剂的称量和溶解技巧;•熟悉溶液的稀释计算和操作。
2. 实验原理:溶液的配制是将固体试剂或浓溶液溶解于溶剂中,使其达到一定的浓度。
常见的溶液配制方法有: - 固体试剂配制溶液; - 浓溶液的稀释。
2.1 固体试剂配制溶液的步骤:1.称取固体试剂;2.将固体试剂溶解于溶剂中;3.转移溶液至容量瓶,并加溶剂至刻度线。
2.2 溶液的稀释计算公式:稀释前溶液的浓度(C1)与体积(V1),稀释后溶液的浓度(C2)与体积(V2)满足以下关系: > C1V1 = C2V23. 实验设备和试剂:•电子天平•磁力搅拌器•容量瓶•称量瓶•分液漏斗•蒸馏水•硫酸•纯净水4. 实验操作:4.1 固体试剂配制溶液:1.使用电子天平将所需质量的固体试剂称取到称量瓶中;2.磁力搅拌器搅拌试剂与溶剂,直到完全溶解;3.将溶液转移至容量瓶中,用洗涤瓶冲洗残留溶液;4.加溶剂至容量瓶刻度线。
4.2 溶液的稀释操作:1.准备一定体积的浓溶液,称取合适的量,并记录浓度和体积;2.用分液漏斗,依据公式 C1V1 = C2V2,计算所需的稀释体积;3.将浓溶液和稀释液体积混合,搅拌均匀。
5. 实验注意事项:•精确称取固体试剂;•搅拌时适量控制搅拌速度;•防止固体飞溅造成伤害;•避免误差产生,必须准确计算稀释体积。
二、实验名称:酸碱中和滴定实验1. 实验目的:•熟悉酸碱滴定的基本原理和操作方法;•学会使用标准溶液进行滴定分析;•理解滴定过程中的指示剂的选择和反应的化学机理。
2. 实验原理:酸碱中和滴定实验是通过加入酸碱指示剂,在滴定过程中确定反应的终点。
常见的酸碱中和滴定实验有:•强酸与强碱的中和滴定;•强酸与弱碱的中和滴定。
3. 实验设备和试剂:•滴定管•手动滴定器•酸碱指示剂•烧杯•稀硫酸•碳酸钠溶液4. 实验操作:4.1 强酸与强碱的中和滴定:1.使用滴定管吸取一定体积的酸溶液;2.加入适量的酸碱指示剂;3.使用滴定管,一滴一滴地滴加碱溶液,直到颜色变化;4.记录滴定时所使用的碱溶液体积。

1.离心式压缩机喘振的常见原因有哪些?如何处理?答:常见原因:①入口管道堵塞,入口气体压力下降;②入口气体温度过高;③出口压力升高;④开停车时操作不当。
处理方法:①停车清理入口管道;②降低入口气体温度;③适当降低出口压力;④精心操作,打开防喘振阀。
2. 操作条件对冷冻能力有什么影响?答:一定冷冻机在一定操作条件下(T1、T2、T3)冷冻能力不同。
①蒸发温度(T1)降低,相应压缩机进口压强降低使单位体积冷冻能力下降,此外,压缩比增大也会使冷冻能力下降。
(6分)②冷凝温度(T2)升高,使压缩比增大,降低冷冻能力。
③过冷温度(T3)升高,,使其焓值增大,降低冷冻能力。
总之,提高蒸发温度,降低冷凝温度及过冷温度可提高冷冻能力。
3. 催化剂性能的好坏从哪几方面衡量?答:催化剂的催化性能由活性、选择性、稳定性三大指标来衡量。
对氨合成反应来说选择性为100%,主要是从活性的高低,通常是用一定条件下反应得到出口含氨量多少确定。
稳定性是指催化剂寿命,包括耐热稳定性、抗毒稳定性和机械稳定性。
4. 氨分离器液位低或无液位时会出现哪些现象?如何处理?答:①氨分离器液位低限报警;②液氨中间槽超压;③循环机填料温度下降处理方法:①消除报警,关小或关死氨分离器放氨阀,提高液位;②降低液氨中间压力,调节好液位。
5. 循环机跳车时会出现哪些现象?处理方法有哪些??答:现象:催化剂层温度、压力急剧上升。
处理方法:①关循环机近路阀,系统近路阀;②关新鲜气入口阀,开新鲜气放空阀,通知压缩机岗位停止供气;③迅速开启备用循环机。
6. 在合成塔的操作中,为何要控制好催化剂层的入口温度?答:①催化剂层入口温度的变化,直接影响热点温度及整个催化剂层温度的变化②入口温度将升高,反应速度快,放出的热量多,热点及整个催化剂层的温度将升③反之,入口温度低,达不到催化剂的活性温度,反应速度急剧下降④催化剂层各点温度一齐下跌⑤以至无法进行生产7. 铁催化剂为什么要进行还原?怎样还原?答:①合成催化剂在还原前以铁的氧化物状态存在。
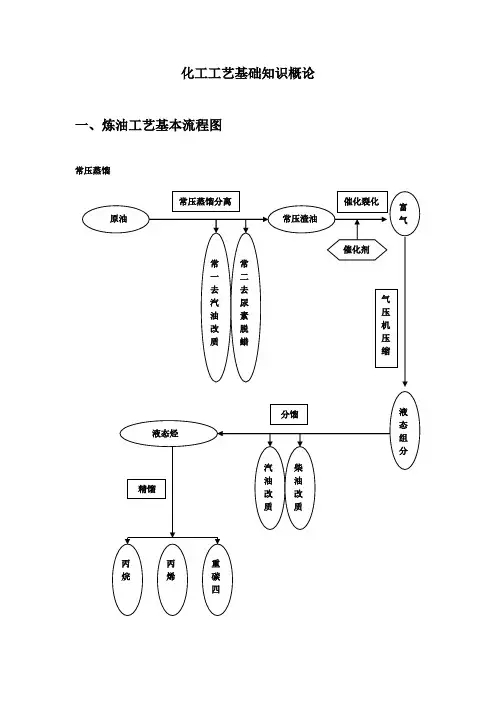
化工工艺基础知识概论一、炼油工艺基本流程图常压蒸馏二、化工基础概念介绍由常压蒸馏分离过程引出以下概念:分离:A 固液分离:常见化工操作形式:离心操作,过滤操作,干燥B 液液分离常见化工操作形式:萃取操作,蒸馏,精馏,1、萃取操作是向欲分离的液体混合和物(原料液)中,加入一种与其不互溶或部分互溶的液体溶剂(萃取剂),形成两相体系。
利用原料液中各组分在萃取剂中溶解度的差异,实现原料液中各组份一定程度的分离。
常称抽提。
2、过滤操作是用某种多孔物质作为介质来处理悬浮液以得到固液分离的操作。
3、精馏把液体混合物进行多次部分汽化,同时又把产生的蒸汽多次部分冷凝,使混合物分离为所要求组分的操作。
3.1精馏原理:为什么把液体混合物进行多次部分汽化同时又多次部分冷凝,就能分离为纯或比较纯的组分呢?对于一次汽化,冷凝来说,由于液体混合物中所含的组分的沸点不同,当其在一定温度下部分汽化时,因低沸点物易于气化,故它在气相中的浓度较液相高,而液相中高沸点物的浓度较气相高。
这就改变了气液两相的组成。
当对部分汽化所得蒸汽进行部分冷凝时,因高沸点物易于冷凝,使冷凝液中高沸点物的浓度较气相高,而为冷凝气中低沸点物的浓度比冷凝液中要高。
这样经过一次部分汽化和部分冷凝,使混合液通过各组分浓度的改变得到了初步分离。
如果多次的这样进行下去,将最终在液相中留下的基本上是高沸点的组分,在气相中留下的基本上是低沸点的组分。
由此可见,多次部分汽化和多次部分冷凝同时进行,就可以将混合物分离为纯或比较纯的组分。
液体气化要吸收热量,气体冷凝要放出热量。
为了合理的利用热量,我们可以把气体冷凝时放出的热量供给液体气化时使用,也就是使气液两相直接接触,在传热同时进行传质。
为了满足这一要求,在实践中,这种多次部分汽化伴随多次部分冷凝的过程是逆流作用的板式设备中进行的。
所谓逆流,就是因液体受热而产生的温度较高的气体,自下而上地同塔顶因冷凝而产生的温度较低的回流液体(富含低沸点组分)作逆向流动。


化工基础知识、安全知识培训(讲义)一、为什么要讲化工基础知识和安全知识?—-处理站是一个对工业废物特别是危险废物进行综合利用或无害化处理处置的环保专业机构,似乎与化工厂没有多大关系.事实上,而我们面对的废物都是化学废物,所采用的处理手段都是化工厂常用的化工手段,二者并没有实质的区别.从广义上讲,处理站可以说是一个特殊的化工厂。
因此,在从事废物处理前,掌握一定的化工基础知识很有必要。
我们常接触的化学品:三酸三碱、液氨、高锰酸钾、双氧水。
详见信息卡。
下面简单介绍酸碱类化工原料基础知识。
1、酸类这里主要介绍三种重要的无机强酸:硫酸、硝酸和盐酸。
(1)硫酸:分子式为H2SO4,分子量98。
07。
硫酸是用途十分广泛的基本化工原料,可用于制造各种硫酸盐类,如硫酸亚铁、硫酸铜、硫酸镍等。
A.物理性质:纯品为无色透明油状液体,工业品有时略带浅褐色。
浓度98.3%的硫酸在15℃时密度为1.84克/厘米3,沸点338℃,为不挥发性酸.浓硫酸在340℃以上时将分解成SO3和水。
B.化学性质:浓硫酸是一种无机强酸,有极强的脱水性和氧化性.浓硫酸能使棉布、纸、木料等碳水化合物脱水碳化,如与人体皮肤接触,能引起严重的化学烧伤.硫酸化学性质活泼,能与多种金属及氧化物、氢氧化物反应生成硫酸盐,与许多有机物在一定条件下也是会发生磺酸化反应。
浓度为75%以下的硫酸对钢铁有强烈的腐蚀作用。
C.注意事项:用水稀释浓硫酸时,千万注意应该把浓硫酸慢慢地注入水中,并且不断地搅拌,而不能把水注入浓硫酸中,以免暴沸或局部过热而溅出酸液。
(2)硝酸:俗称硝镪水,分子式为HNO3,分子量63。
01.广泛用于化肥、国防、染料、制药等工业.物理性质:纯品为无色透明发烟液体,是三种无机强酸之一.浓硝酸在常温下会分解出红棕色的NO2气体,加热或暴露在日光下可加速分解,因此有时见到的浓硝酸呈红棕色.熔点—42℃,沸点86℃.25℃时的密度为1。
50克/厘米3.硝酸与水能以任何比例混合。

化工基础知识培训内容一.基本概念1.温度:温度是表示物体冷热程度的物理量,微观上来讲是物体分子热运动的剧烈程度。
温度只能通过物体随温度变化的某些特性来间接测量,而用来量度物体温度数值的标尺叫温标。
2.压力:压力是指物体单位面积上所受的垂直力。
压力的单位是帕,符号是pa;1pa是1m2面积上受到1N(牛顿)的力时形成的压力即1Pa=1N/m21KPa(千帕)=1*103Pa ,1MPa=1*106Pa 。
与原工程大气压关系为:1MPa=10.194kg/cm2即1兆帕约等于10个工程大气压。
3.流量:所谓流量,是指单位时间内流经封闭管道或明渠有效截面的流体量,又称瞬时流量。
当流体量以体积表示时称为体积流量;当流体量以质量表示时称为质量流量。
单位时间通过流管内某一横截面的流体的体积,称为该横截面的体积流量。
简称为流量,用Q来表示。
4.液位:液位是指密封容器(池子)或开口容器(池子)中液位的高低。
5.空速:反应器空速:规定的条件下,单位时间单位体积催化剂处理的气体量,单位为m3/(m3催化剂·h),可简化为时间h-1。
反应器中催化剂的装填数量的多少取决于设计原料的数量和质量以及所要求达到的转化率。
三.设备铭牌参数含义1.设计压力:承压部件强度计算时所规定的计算压力。
就是设计的额定使用压力,超过此压力就过载,低于此压力就不满负荷。
2.使用压力:操作压力是低于设计压力的安全压力。
3.设计温度:设计温度为压力容器设计载荷条件之一,它是指容器在正常情况下,设定元件的金属温度(沿元件金属截面的温度平均值)。
当元件金属温度不低于0°C时,设计温度不得低于元件金属可能达到的最高温度;当元件金属温度低于0°C时,其值不得高于元件金属可能达到的最低温度。
GB150规定设计温度等于或低于-20°C的容器属于低温容器。
元件的金属温度可以通过传热计算或实测得到,也可按内部介质的最高(最低)温度确定,或再次基准上增加(或减少)一定数值。


化工基础实验培训讲义1. 实验介绍在化工实验中,通过实际操作和观察,学生可以加深对化学原理的理解,提高实验操作和实验设计的能力。
本讲义旨在为初学者提供化工基础实验的培训指南。
2. 实验目的本实验旨在使学生了解和掌握以下内容: - 基本的化工实验仪器和设备的使用方法 - 常用的实验操作技巧 - 实验数据处理和结果分析的基本方法3. 实验内容本实验包括以下几个部分:3.1 仪器和设备的使用方法•热水浴方法•磁力搅拌器的使用•pH计的使用3.2 常用的实验操作技巧•滴定法•干燥方法•蒸馏方法•过滤方法3.3 实验数据处理和结果分析•数据记录和计算•实验结果的处理和分析•实验误差和精确度的评估4. 实验步骤4.1 实验前准备在进行实验前,应对仪器设备进行检查和准备,包括: - 清洗和消毒实验器材 - 检查仪器的正常工作状态 - 准备实验所需试剂和溶液4.2 实验操作步骤1.将待测物质称取并加入试管中。
2.根据实验要求,添加适量的溶剂。
3.使用热水浴加热试管中的溶液。
4.启动磁力搅拌器,进行搅拌。
5.使用pH计测量溶液的pH值。
6.做滴定实验,记录滴定过程中的数据。
7.进行干燥实验,记录实验前后的质量变化。
8.进行蒸馏实验,记录实验过程中的温度变化。
9.进行过滤实验,记录实验前后的溶液颜色变化。
10.记录实验数据。
4.3 数据处理和结果分析步骤1.对实验数据进行整理和计算。
2.根据实验结果进行数据分析,比较不同实验条件下的结果差异。
3.评估实验的误差和精确度。
4.根据实验结果得出结论。
5. 实验安全注意事项•在操作实验时必须佩戴安全眼镜和实验手套。
•注意正确操作实验仪器和设备,避免发生意外。
•注意实验操作区域的通风情况,避免有害气体的吸入。
•严禁单独进行危险实验,必须有老师或实验员的指导下进行。
6. 实验常见问题及解答1.Q: 如何正确使用pH计? A: 首先,将pH计的电极清洗干净,并校准pH计。
然后将电极插入待测溶液中,等待数秒,读取pH值。
化工基础知识培训教材一、阀门管道(一)阀门阀门是介质流通或压力系统中的一种设施,它用来调节介质的流量或压力。
其功能包括切断或接通介质,控制流量,改变流量,改变介质流向,防止介质回流,控制压力或泄放压力。
1、阀门分类依照阀门的用途和作用来分,可分为:切断阀类(其作用是接通和截断管路内的介质,如球阀、闸阀、截止阀、蝶阀和隔膜阀);调节阀类(其作用是用来调节介质的流量、压力的参数,如调节阀、节流阀和减压阀等);止回阀类(其作用是防止管路中介质倒流,如止回阀和底阀);分流阀类(其作用是用来分配、分离或混合管路中的介质,如分配阀、疏水阀等);安全阀类依驱动形式来分,可分为:手动阀;动力驱动阀(如电动阀、气动阀);自动类(此类不手须外力驱动,而利用介质本身的能量来使阀门动作,如止回阀、安全阀、自力式减压阀和疏水阀等)依公称压力分类可分为:真空阀门(工作压力低于标准大气压);低压阀门(公称压力小于或等于1.6Mp);中压阀门(公称压力为2.5MPA、4.0MPA、6.4MPA);高压阀门(公称压力10MPA—80MPA);超高压阀门(大于100MPA)按温度等级分类可分为:超低温阀门(工作温度低于—80℃);低温阀门(工作温度介于—40℃~—80℃);常温阀门(工作温度高于—40℃,而低于或等于120℃);中温阀门(工作温度高于120℃,而低于450℃);高温阀门(工作温度高于450℃)通常分类法是按照既考虑工作原理和作用,又考虑阀门结构,此为国内通常分类法,可分为:闸阀;蝶阀;截止阀;止回阀;旋塞阀;球阀;夹管阀;隔膜阀;柱塞阀等。
2、各种阀门的优缺点:闸阀:闸阀是指关闭件(闸板)沿通道轴线的垂直方向移动的阀门,在管路上主要作为切断介质用,即全开或全关使用。
一般,闸阀不可作为调节流量使用。
它可以适用低温压也可以适用于高温高压,并可根据阀门的不同材质。
但闸阀一般不用于输送泥浆等介质的管路中。
优点:①流体阻力小;②启、闭所需力矩较小;③可以使用在介质向两方向流动的环网管路上,也就是说介质的流向不受限制;④全开时,密封面受工作介质的冲蚀比截止阀小;⑤形体结构比较简单,制造工艺性较好;⑥结构长度比较短。
有机化工知识培训教案水汽车间有机化工知识培训教案第一节热量传递的基本方式人们从长期的实践中,总结出热量由高温物体向低温物体的传热过程,其传递的基本方式有三种:热传导、对流传热和辐射传热。
一热传导(导热)导热是物体中温度较高部分的分子振动较剧烈,当与相邻的分子碰撞时,将能量传给相邻的分子。
反映在相邻部分温度升高,这样按顺序地将热量从高温向低温传递的方式称为热传导,简称导热。
由此可见,导热可以发生在固体、静止流体及没有传热方向上流动的流体内部。
导热的明显特点是:质点(分子或原子团)没有传热方向上的位移。
例如:把铁棒的一端放进火炉中烧,过一会儿,另一端便会烫手。
这表明热量已由一端传递到另一端,在此过程中并没有发现受热的质点发生位移。
这是一个典型的导热过程。
二对流传热对流传热是由于受热的质点位移,使热量发生空间位置的转移而进行传递。
这种传热方式称为对流传热。
可见对流传热只能发生在流体内部。
特点是质点有传热方向上的位移。
对流传热又分为自然对流和强制对流。
如果流体的质点位移没有外力作用,完全是由于流体各部分不同而造成的密度差异所引起的,则称为自然对流。
如果流体的运动是由于泵或搅拌机械的作用而产生的,则称为强制对流。
例如,在用水壶烧开水时,受热的部位仅仅是壶的底部,但过一段时间全壶都会沸腾。
这是因为,靠近壶底的水先受热,温度升高,密度变小,所以上升。
而壶上部的水温度低、密度大,故而下降,这样壶中的水因各部密度不同而形成循环流动,便是一个自然对流传热过程。
如果在上述过程中,边加热边用器械搅动,便形成一个强制对流传热过程。
三辐射传热辐射传热过程是物体以电磁波的形式向四周散发辐射能。
辐射能遇到另一个物体时,被全部或部分吸收,被吸收的辐射能重新变成热量,这一过程称为辐射传热,简称热辐射。
任何物体只要在0 K以上都能发射辐射能,温度越高,辐射能力越强。
辐射传热的特点是不需要任何物质为媒介,并伴随着能量形式的转换。
例如:太阳对大地的传热,在大气层外这一段不经任何介质,是太阳的热能先以电磁波形式辐射出来,被地球上的物体吸收后又转化成热能,实现热量传递。