第八章 润湿作用
- 格式:ppt
- 大小:562.50 KB
- 文档页数:31

Hefei University课程论文论文题目:__ _表面活性剂的润湿作用学科专业:_____ 物理化学(化工)______ 作者姓名:__________ _____导师姓名:__________ ___ _完成时间:_______ ______表面活性剂的润湿作用前言:润湿广泛存在于自然界的一种现象,最为普通的润湿是固体表面的气体被液体所取代,或是固-液界面上的一种液体被另一种液体取代。
例如:洗涤.印染.润滑.农药喷洒等;还有一些场合往往不希望润湿发生,例如:防水.防油.防锈等。
润湿:是指一种流体被另一种流体从固体表面或固-液界面所取代的过程。
即润湿过程往往涉及三相,其中至少两相为流体。
它可分为:浸湿、沾湿、铺展三种情况。
一、润湿过程沾湿:液体与固体接触,变液/气界面和固/气界面为固/液界面的过程,如图所示。
例如飞机在空中飞行,大气中的水珠是否会附着于机翼上而有碍飞行;农药喷雾能否有效地附着于植物的枝叶上?这都是与沾湿过程有关的问题。
浸湿:指固体浸入液体的过程。
该过程的实质是固/气界面为固/液界面所代替,而液体表面在过程中无变化(下图)。
洗衣服时把衣物浸泡在水中即为此过程。
铺展:实质是在以固/液界面代替固/气界面的同时,液体表面也同时扩展(下图)。
如农药喷雾于植物上,就要求农药能在植物的枝叶上铺展以覆盖最大面积。
二、接触角与润湿方程接触角:将液体滴于固体表面上,液体或铺展或覆盖于表面,或形成一液滴停于其上,此时在三相交界处,自固液界面经液体内部到气液界面的夹角。
润湿方程:Wa = γlg(cosθ + 1) ≥ 0 θ≤ 180 沾湿A = Wi = γlgcosθ≥ 0 θ≤ 90 浸湿S = γlg(cosθ -1) = 0 θ= 0 铺展习惯上将θ =90°定义润湿与否的标准。
θ > 90°为不润湿,θ < 90°为润湿。
Yang’s方程:γsg - γsl =γlgcosθ1805年提出,也称为润湿方程。




润湿作用润湿是有条件的,润湿能否进行,取决于界面性质及界面能的变化,其润湿的程度可以用接触角的大小来判断。
一、表面张力与表面过剩自由能表面张力与表面过剩自由能是描述物体表面状态的物理量。
液体表面或固体表面的分子与其内部分子的受力情形是不同的,因而所具有的能量也是不同的。
以液体为例,如图1-1所示,处在液相内部的分子,四周被同类分子所包围,受周围分子的引力是对称的,因而相互抵消,合力为零;处在液体表面的分子则不然,因为液相的分子密度远大于气相的分子引力,致使合力不再为零,而是具有一定的量值且指向液相的内侧。
由于这个拉力的存在,使得液体表面的分子,相对于液体内部分子处于较高能量态势,随时有向液体内部迁移的可能,处于一种不稳定的状态。
液体表面分子受到的拉力形成了液体的表面张力,相对于液体内部所多余的能量,就是液体的表面过剩自由能。
由于表面张力或表面过剩自由能的存在,在没有外力作用时,液体都具有自动收缩其表面成为球形的趋势,这是因为在体积一定的几何形体中球体的表面积最小。
图1-1液体表面分子与内部分子能量的不同图1-2表面张力实验示意图图1-2是表面张力实验的示意图。
Ⅱ形框架的AB边是可以上下滑动的,长度为ι。
将框架直立于液体中,AB边也被浸没。
缓慢地提起AB边,便在框架内形成一个逐渐扩展的液体薄膜。
随着液膜的扩展,提起长度为ι的AB边所需要的力也要逐渐增加。
设:当AB 边提升到高出液面h的位置时,为保持液膜平衡而不收缩,需要施加的力为F,则此力F应与液膜的两个表面所提供的力相平衡。
ι越长,F值越大。
因此,在AB边上,单位长度液面上受的力为:F=γ·2ι(1-1)比例系数γ定义为表面张力系数,表示垂直通过液体表面任一单位长度、与液面相切地收缩表面的力,常简称为表面张力。
表面张力的量纲是〔力/长度〕,常用的单位是N/m(牛顿/米)。
某一种液体,在一定的温度和压力下,有一定的γ值。
因为温度升高时,液体分子间的引力减少,共存的气相蒸气密度加大,所以表面张力总是随温度的升高而降低。


40润湿作用与接触角润湿是固体表面上的一种流体被另一种流体取代的现象,通常是指固体表面上气体被液体所取代。
这种现象在自然界和生产中十分普遍,诸如,土壤和植物对水的亲和、三次采油、织物的洗涤和印染、机械的润滑等等。
在界面化学的研究和应用中,这是十分重要的一个方面。
本专题将讨论润湿作用的最基本概念及理论。
1. 润湿的分类按照固体表面上气体被液体取代的不同特征,润湿作用可分为浸湿、沾湿和铺展三种类型。
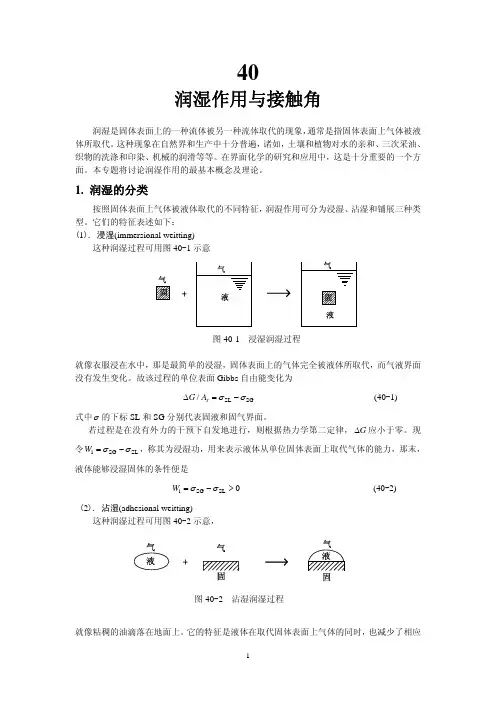
它们的特征表述如下:(1). 浸湿(immersional weitting)这种润湿过程可用图40-1示意图40-1 浸湿润湿过程就像衣服浸在水中,那是最简单的浸湿,固体表面上的气体完全被液体所取代,而气液界面没有发生变化。
故该过程的单位表面Gibbs 自由能变化为SG SL /σσ−=Δs A G (40-1)式中σ的下标SL 和SG 分别代表固液和固气界面。
若过程是在没有外力的干预下自发地进行,则根据热力学第二定律,G Δ应小于零。
现令SL SG i σσ−=W ,称其为浸湿功,用来表示液体从单位固体表面上取代气体的能力,那末,液体能够浸湿固体的条件便是0SL SG i >−=σσW (40-2)(2). 沾湿(adhesional weitting)这种润湿过程可用图40-2示意,图40-2 沾湿润湿过程就像粘稠的油滴落在地面上。
它的特征是液体在取代固体表面上气体的同时,也减少了相应的气液界面。
故该过程的单位表面Gibbs 自由能变化为LG SG SL /σσσ−−=Δs A G (40-3)若令SL SG LG a σσσ−+=W ,并称其为粘附功,则表明a W 愈大,SG LG σσ+与SL σ相差愈大,要想从单位固体表面拉开被黏附的液体就愈不容易,这就是说,液体与固体结合愈牢固。
故a W 反映了固液两相在界面上结合的能力。
倘若沾湿过程是在没有任何外力干预下自发地进行,则必0<ΔG ,因此,液体能够沾湿固体表面的条件是0SL SG LG a >−+=σσσW (40-4)(3) 铺展(spreading weitting)这种润湿过程可由图40-3示意,图40-3 铺展润湿过程就像水滴洒在水泥地上,那是最常见的润湿过程。


润湿作用关键词:表面张力比表面能第一节润湿作用润湿是有条件的,润湿能否进行,取决于界面性质及界面能的变化,其润湿的程度可以用接触角的大小来判断。
一、表面张力与表面过剩自由能表面张力与表面过剩自由能是描述物体表面状态的物理量。
液体表面或固体表面的分子与其内部分子的受力情形是不同的,因而所具有的能量也是不同的。
以液体为例,如图1-1所示,处在液相内部的分子,四周被同类分子所包围,受周围分子的引力是对称的,因而相互抵消,合力为零;处在液体表面的分子则不然,因为液相的分子密度远大于气相的分子引力,致使合力不再为零,而是具有一定的量值且指向液相的内侧。
由于这个拉力的存在,使得液体表面的分子,相对于液体内部分子处于较高能量态势,随时有向液体内部迁移的可能,处于一种不稳定的状态。
液体表面分子受到的拉力形成了液体的表面张力,相对于液体内部所多余的能量,就是液体的表面过剩自由能。
由于表面张力或表面过剩自由能的存在,在没有外力作用时,液体都具有自动收缩其表面成为球形的趋势,这是因为在体积一定的几何形体中球体的表面积最小。
图1-1液体表面分子与内部分子能量的不同图1-2表面张力实验示意图图1-2是表面张力实验的示意图。
Ⅱ形框架的AB边是可以上下滑动的,长度为ι。
将框架直立于液体中,AB边也被浸没。
缓慢地提起AB边,便在框架内形成一个逐渐扩展的液体薄膜。
随着液膜的扩展,提起长度为ι的AB边所需要的力也要逐渐增加。
设:当AB边提升到高出液面h的位置时,为保持液膜平衡而不收缩,需要施加的力为F,则此力F应与液膜的两个表面所提供的力相平衡。
ι越长,F值越大。
因此,在A B边上,单位长度液面上受的力为:F=γ·2ι(1-1)比例系数γ定义为表面张力系数,表示垂直通过液体表面任一单位长度、与液面相切地收缩表面的力,常简称为表面张力。
表面张力的量纲是〔力/长度〕,常用的单位是N/m(牛顿/米)。
某一种液体,在一定的温度和压力下,有一定的γ值。
