润湿作用
- 格式:doc
- 大小:292.00 KB
- 文档页数:14

固体表面上的原子或分子的价键力是未饱和的,与内部原子或分子比较有多余的能量。
所以,固体表面与液体接触时,其表面能往往会减小。
通常,暴露在空气中的固体表面积总是吸附气体的,当它与液体接触时,气体如被推斥而离开表面,则固体与液体直接接触,这种现象称为润湿。
一、润湿过程在清洁的玻璃板上滴一滴水,水在玻璃表面上立即铺展开来;而在石蜡上滴一滴水,水则不能铺展而保持滴状,如图1所示。
从水面与固体面的接触点沿水面引切线,切线与固体面之间的夹角θ称为接触角。
水与玻璃的接触角接近于零,而与石蜡的接触角约为1100。
接触角小的固体易为液体润湿,反之,接触角大的固体则不易被液体润湿。
因此,接触角的大小可作为润湿的直观尺度。
又如,在玻璃板上滴一滴酒精,酒精滴也会在玻璃板上铺展开来,其接触角为零,铺展情形与水的情况没有什么差异。
当固体物质不是玻璃时,其润湿情况有显著不同。
因此,在研究润湿时,接触角是一个重要判据。
为对润湿尺度给以更严格的规定,下面讨论润湿过程。
图1.接触角润湿即固体表面吸附的气体为液体所取代的现象,这就是说发生润湿时,固一气界面消失,形成新的固-液界面。
在这种过程中能量(自由能)必发生变化,自由能变量的大小可作为润湿作用的尺度。
固一气界面消失,新的固-液界面产生有多种方式,所以润湿的类型也相应有多种。
图2为三种类型润湿。
图2(a)为铺展润湿,水、酒精等在玻璃表面上铺展即为这种铺展润湿。
发生这种润湿时能量变化由式一决定:(式一)式中y s——固体的表面张力;Y L——液体的表面张力;Y SL——固体和液体的界面张力;W S——铺展功,亦称做铺展系数。
W S的物理意义从图可以清楚地看出:在固体表面上铺展的液体膜,在逆过程中减少单位面积所需的能量。
经过这种过程后,固体产生lcm2的新表面,同时消失1cm2液体表面和lcm2固-液界面,所以从式一由表面张力和界面张力立即算出W s。
在发生这种润湿的过程中,释放出的能量和W s相等,W s≥0时发生润湿。

第三章表面活性剂功能与应用一一润湿作用一、润湿功能例子:水润湿玻璃,加入表面活性剂润湿容易;水滴在石蜡上,石蜡几乎不被润湿,加入少量表面活性剂石蜡就容易被润湿了;较厚的毛毡或棉絮放入水中,很难渗透,加入一些表面活性剂就容易浸透了。
表面活性剂具有渗透作用或润湿作用所谓润湿是指一种流体被另一种流体从固体表面或固液界面所取代的过程。
润湿过程往往涉及三相,其中至少两相为流体。
1. 润湿过程润湿作用是一个过程。
润湿过程主要分为三类:沾湿、浸湿和铺展。
产生的条件不同。
其能否进行和进行的程度可根据此过程热力学函数变化判断。
在恒温恒压条件下可方便使用润湿过程体系自由能变化表征。
(1)沾湿主要指液-气界面和固-气界面上的气体被液体取代的过程,在此过程中消失的固-气界面的大小与其后形成的固-液界面的大小是相等的。
如喷洒农药,农药附着于植物的枝叶上。
沾湿附着发生条件:△ G= Y SL- Y SG丫LG V 0 W A= Y SG- Y SL+ Y LG> 0 (沾湿)式中:Y SG Y SL和Y LG分别为气-固、液-固和气-液界面的表面张力(2)浸湿浸湿是指固体浸入液体的过程,原有的固气界面空气被固液取代。
如洗衣时衣物泡在水中;织物染色前先用水浸泡过程浸湿发生条件:△ G = Y SL- Y SG< 0W i = Y SG- Y SL》0 (W:浸湿功)(3)铺展液体取代固体表面上的气体,固-气界面被固-液界面取代的同时液体表面能够扩展的现象。
铺展发生条件为:△ G= Y SL+Y LG-Y SG< 0S= Y S(- Y SL- Y LG》0 (S:铺展功)一般,若液体能够在固体表面铺展,则沾湿和浸湿现象必然能够发生。
从润湿方程可以看出:固体自由能Y SG越大,液体表面张力Y LG越低,对润湿越有利。
2. 接触角和润湿方程(杨氏方程)接触角:固、液、气三相交界处自固-液界面经过液体内部到气液界面处的夹角。

什么是润湿作用
润湿作用是指液体在与固体接触时,能够在固体表面上形成一层平均和连续的薄液体膜,使固体表面被液体湿润的现象。
润湿作用可以分为沾湿、浸湿和铺展三种类型。
润湿作用是一种流体从固体表面置换另一种流体的过程,在日常生活和生产实际中,如洗涤、印染、矿物浮选等,是最常见的现象之一。
因此,研究润湿现象有极强的现实意义。
此外,润湿作用在表面涂料、化妆品、医疗器械、涂层材料等领域也有广泛应用。
以上信息仅供参考,如有需要,建议查阅相关文献或咨询专业人士。



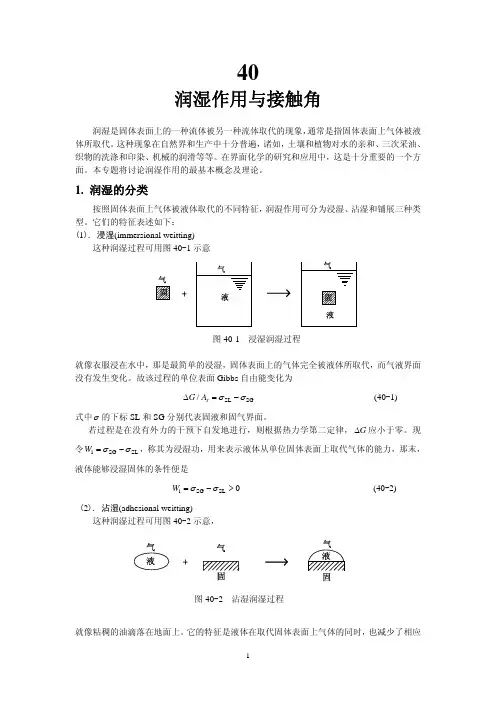
40润湿作用与接触角润湿是固体表面上的一种流体被另一种流体取代的现象,通常是指固体表面上气体被液体所取代。
这种现象在自然界和生产中十分普遍,诸如,土壤和植物对水的亲和、三次采油、织物的洗涤和印染、机械的润滑等等。
在界面化学的研究和应用中,这是十分重要的一个方面。
本专题将讨论润湿作用的最基本概念及理论。
1. 润湿的分类按照固体表面上气体被液体取代的不同特征,润湿作用可分为浸湿、沾湿和铺展三种类型。
它们的特征表述如下:(1). 浸湿(immersional weitting)这种润湿过程可用图40-1示意图40-1 浸湿润湿过程就像衣服浸在水中,那是最简单的浸湿,固体表面上的气体完全被液体所取代,而气液界面没有发生变化。
故该过程的单位表面Gibbs 自由能变化为SG SL /σσ−=Δs A G (40-1)式中σ的下标SL 和SG 分别代表固液和固气界面。
若过程是在没有外力的干预下自发地进行,则根据热力学第二定律,G Δ应小于零。
现令SL SG i σσ−=W ,称其为浸湿功,用来表示液体从单位固体表面上取代气体的能力,那末,液体能够浸湿固体的条件便是0SL SG i >−=σσW (40-2)(2). 沾湿(adhesional weitting)这种润湿过程可用图40-2示意,图40-2 沾湿润湿过程就像粘稠的油滴落在地面上。
它的特征是液体在取代固体表面上气体的同时,也减少了相应的气液界面。
故该过程的单位表面Gibbs 自由能变化为LG SG SL /σσσ−−=Δs A G (40-3)若令SL SG LG a σσσ−+=W ,并称其为粘附功,则表明a W 愈大,SG LG σσ+与SL σ相差愈大,要想从单位固体表面拉开被黏附的液体就愈不容易,这就是说,液体与固体结合愈牢固。
故a W 反映了固液两相在界面上结合的能力。
倘若沾湿过程是在没有任何外力干预下自发地进行,则必0<ΔG ,因此,液体能够沾湿固体表面的条件是0SL SG LG a >−+=σσσW (40-4)(3) 铺展(spreading weitting)这种润湿过程可由图40-3示意,图40-3 铺展润湿过程就像水滴洒在水泥地上,那是最常见的润湿过程。

润湿作用关键词:表面张力比表面能第一节润湿作用润湿是有条件的,润湿能否进行,取决于界面性质及界面能的变化,其润湿的程度可以用接触角的大小来判断。
一、表面张力与表面过剩自由能表面张力与表面过剩自由能是描述物体表面状态的物理量。
液体表面或固体表面的分子与其内部分子的受力情形是不同的,因而所具有的能量也是不同的。
以液体为例,如图1-1所示,处在液相内部的分子,四周被同类分子所包围,受周围分子的引力是对称的,因而相互抵消,合力为零;处在液体表面的分子则不然,因为液相的分子密度远大于气相的分子引力,致使合力不再为零,而是具有一定的量值且指向液相的内侧。
由于这个拉力的存在,使得液体表面的分子,相对于液体内部分子处于较高能量态势,随时有向液体内部迁移的可能,处于一种不稳定的状态。
液体表面分子受到的拉力形成了液体的表面张力,相对于液体内部所多余的能量,就是液体的表面过剩自由能。
由于表面张力或表面过剩自由能的存在,在没有外力作用时,液体都具有自动收缩其表面成为球形的趋势,这是因为在体积一定的几何形体中球体的表面积最小。
图1-1液体表面分子与内部分子能量的不同图1-2表面张力实验示意图图1-2是表面张力实验的示意图。
Ⅱ形框架的AB边是可以上下滑动的,长度为ι。
将框架直立于液体中,AB边也被浸没。
缓慢地提起AB边,便在框架内形成一个逐渐扩展的液体薄膜。
随着液膜的扩展,提起长度为ι的AB边所需要的力也要逐渐增加。
设:当AB边提升到高出液面h的位置时,为保持液膜平衡而不收缩,需要施加的力为F,则此力F应与液膜的两个表面所提供的力相平衡。
ι越长,F值越大。
因此,在A B边上,单位长度液面上受的力为:F=γ·2ι(1-1)比例系数γ定义为表面张力系数,表示垂直通过液体表面任一单位长度、与液面相切地收缩表面的力,常简称为表面张力。
表面张力的量纲是〔力/长度〕,常用的单位是N/m(牛顿/米)。
某一种液体,在一定的温度和压力下,有一定的γ值。



一、润湿作用凝聚态物体表面一种流体被另一种流体取代的过程称为润湿。
润湿过程分为三类,即在日常生活中经常遇到的沾湿、浸湿和铺展。
1、沾湿液体取代固体表面气体,液体不能完全展开的过程称为沾湿。
Asl sg A W G =-+=∆-γγγlg (黏附功)当W A>0时,沾湿过程才是自发的。
固-液界面取代液-气界面和气-固界面的过程2、铺展液体在固体表面展开成薄层,此过程称为铺展。
铺展是固气界面消失,气液界面和固液界面形成的过程。
SG sl gs s =--=∆-γγγlg (铺展系数)铺展系数S>0,过程自发进行。
3、浸湿固体浸于液体中的过程称为浸湿。
此过程是固气界面被固液界面取代,气液界面无变化,此过程自由能变化为Isl sg I W G =-=∆-γγ(浸润功)WI>0,过程自发进行。
二、接触角与Young 方程将一液体滴到一平滑均匀的固体表面上,若不铺展,将形成一平衡液滴,其形状由固液气三相交界面处所作气液界面之切线经液滴至固液界面所成之夹角决定,此角称为该种液体在所研究固体表面上之接触角,或称润湿角。
接触角常以θ表示。
γθ< 90︒θ> 90︒•接触角θ与各个界面张力θγγγcos lg =-sl sg该式称为Young 方程或润湿方程。
θ越小,润湿过程越易进行。
习惯上,θ>90℃, 为不润湿 θ<90℃, 为润湿三.决定和影响接触角大小的一些因素 1.物质的本性对于指定的固体,液体表面张力越小,其在该固体上的θ也越小。
对于同一液体,固体表面能越大,θ越小。
θ反应了液体与固体表面亲和作用大小,亲和力越强越易于在表面上展开, θ越小。
2.接触角滞后现象若液体与固面无相对运动时,所形成的两个接触角是相等的即平衡接触角θe ;若液体与固体发生相对运动时,则会形成两个不同的接触角。
较大的θa 称为前进接触角,较小的θr 称为后退接触角。
这种θa >θr 的现象称为接触角滞后。
润湿作用润湿是有条件的,润湿能否进行,取决于界面性质及界面能的变化,其润湿的程度可以用接触角的大小来判断。
一、表面张力与表面过剩自由能表面张力与表面过剩自由能是描述物体表面状态的物理量。
液体表面或固体表面的分子与其内部分子的受力情形是不同的,因而所具有的能量也是不同的。
以液体为例,如图1-1所示,处在液相内部的分子,四周被同类分子所包围,受周围分子的引力是对称的,因而相互抵消,合力为零;处在液体表面的分子则不然,因为液相的分子密度远大于气相的分子引力,致使合力不再为零,而是具有一定的量值且指向液相的内侧。
由于这个拉力的存在,使得液体表面的分子,相对于液体内部分子处于较高能量态势,随时有向液体内部迁移的可能,处于一种不稳定的状态。
液体表面分子受到的拉力形成了液体的表面张力,相对于液体内部所多余的能量,就是液体的表面过剩自由能。
由于表面张力或表面过剩自由能的存在,在没有外力作用时,液体都具有自动收缩其表面成为球形的趋势,这是因为在体积一定的几何形体中球体的表面积最小。
图1-1液体表面分子与内部分子能量的不同图1-2表面张力实验示意图图1-2是表面张力实验的示意图。
Ⅱ形框架的AB边是可以上下滑动的,长度为ι。
将框架直立于液体中,AB边也被浸没。
缓慢地提起AB边,便在框架内形成一个逐渐扩展的液体薄膜。
随着液膜的扩展,提起长度为ι的AB边所需要的力也要逐渐增加。
设:当AB 边提升到高出液面h的位置时,为保持液膜平衡而不收缩,需要施加的力为F,则此力F应与液膜的两个表面所提供的力相平衡。
ι越长,F值越大。
因此,在AB边上,单位长度液面上受的力为:F=γ·2ι(1-1)比例系数γ定义为表面张力系数,表示垂直通过液体表面任一单位长度、与液面相切地收缩表面的力,常简称为表面张力。
表面张力的量纲是〔力/长度〕,常用的单位是N/m(牛顿/米)。
某一种液体,在一定的温度和压力下,有一定的γ值。
因为温度升高时,液体分子间的引力减少,共存的气相蒸气密度加大,所以表面张力总是随温度的升高而降低。
故测定表面张力时,必须固定温度,否则会造成较大的测量误差。
液体的表面张力是表面紧缩力,它使液体表面积有自动缩小的趋势。
若要扩展液体的表面,即要把液相内的一部分分子移到表面上来,则必须克服其向液相内侧的拉力而作功,因此,液体自动收缩表面的趋势,也可以从能量的角度来解释。
设:当表面扩展的微面积为dA时,表面张力所作的元功为-δW,因为表面分子受到的指向液相内侧的拉力,要扩展表面,液相内部的一部分分子,就要向表面移动,所以作负功。
在表面扩展过程中,元功-δW 与微面积增量dW成正比,令γ为比例系数,则有:-δW=γ·dA(1-2)又因为在怛温恒压条件下,在表面扩展的过程中,体系对外界所做的功即为δW,而δW 应等于在此过程中体系自由能的减少一DgT.P,故(1-2)式可以写作dGT.P=γ·dA亦即γ=(G/A)T.P.(1-3)从(1-3)式中看出,γ的物理意义是:在恒温恒压条件下,增加单位表面积表面所引起的体系自由能的增量,也就是单位表面上的分子比相同数量的内部分子过剩的自由能。
因此,叫比表面过剩自由能,常简称为“比表面能”,单位是J/m2(焦尔/平方米)。
因为1J=1N·m,所以,一种物质的比表面能与表面张力数值上完全一样,量纲也一样,但物理意义有所不同,所用的单位也不同。
测定表面张力的方法很多,一般在实验室中,用滴体积法或挂环法既简便又准确。
滴体积法不仅可以测定润湿液的表面张力,也可以测定润湿液和油墨连结料的界面张力。
用挂环法测定液体表面张力时,为获得准确的表面张力数据,应该选用被液体完全润湿的金属环进行测试。
以上两种实验方法,请参看有关表面张力的书籍或资料,这里不再叙述。
表面张力或表面过剩自由能,是一强度因素,其值与物质的种类、共存另一相的性质以及温度、压力等因素有关。
对于纯液体来说,共存的另一相一般指空气或饱和蒸气。
一些纯液体在常温20℃时的表面张力值如表1-1所列。
表1-1 几种液体的表面张力γ(20℃)液体名表面张力(10-2N/m)液体名称表面张力(10-2N/m)称水7.275 苯2.888甘油6.340 甲苯2.845液体石3.310 醋酸2.763 蜡油酸2.250 正已烷1.843表1-2表面张力γ和温度的关系温度(℃)表面张力(10-2N/m)10 7.4220 7.2730 7.1250 6.7980 6.26100 5.89当温度升高时,液体分子间引力减弱,而共存蒸气的密度加大,所以表面分子的过剩自由能减少。
因此表面张力总是随温度的升高而降低的。
表1-2表示水的表面张力和温度之间的关系。
在一定的温度下,纯水中加入少量的表面活性剂,溶液的表面张力急剧下降。
水的表面张力随表面活性剂的种类及在溶液中的浓度而有不同程度的降低(表面活性剂对水溶液表面张力的降低作用,将在第五章详细讲述)。
以上讨论的有关表面张力的问题是以液体表面为例的,但也可以推广到固体,固体表面的分子和液体表面的分子一样,比内部分子有过剩的自由能。
对于固体的表面张力或比表面能,目前虽然还不能像对液体那样,用实验方法直接测定。
但根据间接推算,固体的表面张力或比表面能一般比液体大的多。
有的固体比表面能具有很高的数值。
需要注意的是,固-液相接触或液-液相接触的比表面能γSL或γLL的物理意义是:单位面积相界面上的两相物质的分子,各自比相同数量的本相内部分子过剩自由能和加和值。
当γSL或γLL取N/m 为单位时,通常称为界(表)面张力(γ)。
二、水和油的化学结构与表面张力水和油对固体的润湿程度,与各自的表面张力有关,水和油的表面张力又都与各自的化学结构有关。
1.水的化学结构与表面张力。
水分子由氢元素和氧元素组成,分子的偶极矩等于6.17×10-30C·m(库仑·米),分子的结构不对称,是极性很强的分子。
按照"结构相似互溶原理",极性分子对极性分子有强的亲合力,非极性分子对非极性分子有强的亲合力。
因此,当水分子和具有极性结构的物质相接触时,由于亲合力的作用,水会附着在不溶于水的极性物质表面,或者把能溶于水的极性物质溶解。
故极性物质叫亲水物质。
物质分子间的作用力主要是范德华力和氢键。
范德华力一般包括取向力、诱导力和色散力。
极性分子与极性分子之间,存在有取向力、诱导力和色散力;非极性分子与非极性分子之间,只存在色散力。
氢原子和其它电负性较强的原子(如F、O、N)化合而形成的分子之间,存在氢键。
水分子是由氢原子和电负性较大的氧原子化合而成的极性很强的分子。
因此,水分子之间的作用力,既有取向力、诱导力和色散力,也有氢键。
故表面张力值较大,纯水的表面张力在20℃时,约为7.2×10-2N/m。
2.油的化学结构与表面张力。
油是有机液体的统称。
分子结构较为简单的有机液体四氯化碳(CCL4),是具有对称结构的甲烷(CH4)的衍生物。
在四氯化碳分子中,4个C-C1键都是极性共价键,但因分子的结构是正四方体,碳原子位于正四方体中心,4个氯原子分别位于四面体4个顶端,分子的偶极矩等于零,是非极性分子。
各种饱和烃、苯等有机液体的结构也是对称的,偶极矩等于零,为非极性分子。
水或极性物质与油相接触时,因化学结构不相似,不产生亲合力,故非极性物质为疏水物质。
如果在非极性分子中,引入羟基(-OH)、氨基(-NH2)、硝基(-NNO2)、羧基(-COOH)等有极性的原子团时,非极性分子便会带有一定的极性,疏水物质也就有了一定的亲水性,但极性和亲水性的大小,取决于分子中非极性部分碳链的长短,碳链愈长,分子的非极性和疏水性愈大。
亚麻油是一种常用的油墨连结料,属于干性植物油,可以看成是甘油和亚麻油酸、亚油酸、油酸发生酯化反应生成的甘油三酸酯:亚麻油酸、亚油酸、油酸的分子中,虽然有极性原子团羧基(-COOH),但因碳链很长(均含有18个碳原子),亲水的极性基团几乎不起作用,所以,亚麻油酸等是非级性的疏水物质,故油墨中的连结料干性植物油疏水性很大。
油分子和油分子之间只有色散力,故油的表面张力比水的表面张力小,油的表面张力如表1-3所列。
油墨的粘度较高,尤其是胶印油墨,所以,用实验的方法测定油墨的表面张力存在一定的困难。
要想测得可靠而又可重复的实验数据,必须将油墨稀释后测定其表面张力,然后推断到100%纯油墨时的表面张力值。
为保证推断数据的可靠性,选择何种稀释剂稀释油墨,就成为测定油墨表面张力的关键。
目前,在测定油墨的表面张力时,一般选择两种稀释剂分别稀释油墨,一种稀释剂的表面张力高于纯油墨,另一种则低于纯油墨,分别测定油墨在两种稀释剂不同浓度下的表面张力,这样测定的数据可靠性最大。
图1-3表示两种热固性胶印油墨,分别用Magil470油和1-溴化萘稀释后的实验结果。
从实验曲线上推断的表面张力γ值分别为3.35×10-2N/m和3.1×10-2N/m。
表1-3油的表面张力γ(20℃)油表面张力(10-2N/m)庚烷1.97辛烷2.18苯2.89甲苯2.84油酸2.25蓖麻油3.90图1-3稀释后的油墨表面张力大多数油墨的表面张力,由于受到颜料和添加剂分子中极性基的影响,比纯油的表面张力大,一般在3.0×10-2N/m~3.6×10-2N/m。
三、液体在固体表面润湿的条件液体在固体表面的润湿分为沾湿、浸湿、铺展三类。
1.沾湿。
沾湿是指液体与固体接触,将"气-液"界面与"气-固"界面转变为“液-固”界面的过程,如图1-4所示。
图1-4沾湿过程在沾湿过程中,新形成的“液-固”界面增加了自由能γSL,而被取代的液体表面(即“气-液”界面)分别减少了自由能γLG和γSG,所以体系自由能的变化是ΔG=γSL-γLG-γSG(1-4a)体系对外界所做的功是Wa=-ΔG=γSG+γLG-γSL(1-4b)Wa叫粘附功,是液体和固体粘附时,体系对外界所作的最大功。
根据热力学第二定律,在恒温恒压条件下,当体系能量的变化ΔGT.P≤0时,这样的过程才能自发地进行。
因此,沾湿过程自发进行的条件是ΔG=γSL-γLG-γSG≤0(1-5a)或Wa=γSG+γLG-γSL≥0(1-5b)而且,体系自由能减少的愈多,沾湿过程愈容易进行,粘附功愈大,“液-固”界面结合得愈牢。
如果将图1-4所示过程的固体,换成具有相同面积的液柱,则因“液-固”界面消失,γSL=0,又因为γSG为γLG所取代,故(1-5b)式变为Wa=Wc=γLG+γLG-0=2γLG(1-6)Wc的大小表征了液体分子间的相互作用力,叫作内聚功。