直接胆红素测定试剂盒 (胆红素氧化酶法)产品技术要求豪迈
- 格式:docx
- 大小:15.40 KB
- 文档页数:2

直接胆红素测定试剂盒(钒酸盐氧化法)适用范围:用于体外定量测定人血清中直接胆红素的浓度。
1.1包装规格a) 试剂1:2×60ml,试剂2:2×15ml;b) 试剂1:4×60ml,试剂2:4×15ml;c) 试剂1:3×80ml,试剂2:3×20ml;d) 试剂1:2×40ml,试剂2:2×10ml;e)试剂1:2×400ml,试剂2:2×100ml;f)试剂1:2×72ml,试剂2:2×18ml;g)试剂1:12×16ml ,试剂2:12×4ml;h)试剂1:1×40ml,试剂2:1×10ml。
1.2 主要组成成分试剂1主要组成成分:柠檬酸缓冲液(pH 2.0-4.0 ) 100mmol/L,曲拉通3mmol/L试剂2主要组成成分:磷酸缓冲液 10mmol/L,钒酸钠 4mmol/L 2.1 外观和性状2.1.1 试剂盒各组分应齐全、完整、液体无渗漏;外包装完好、无破损,标签完好、字迹清晰。
2.1.2 试剂1应为无色或淡黄色透明溶液;试剂2应为无色或淡褐色透明溶液。
2.2 净含量应不低于试剂瓶标示装量。
2.3 试剂空白测定试剂空白吸光度,应≤0.5。
2.4 分析灵敏度测试300 umol/L的被测物时,吸光度变化(ΔA)应不低于0.055。
2.5 准确度与比对试剂盒同时测试40例线性范围内的不同浓度的血清样本,样本浓度在(1,396)umol/L区间内,测定结果相关性(r)≥0.975 在[30,396)umol/L区间内相对偏差≤15%,在(1,30)umol/L绝对偏差≤4.5umol/L。
2.6 重复性变异系数(CV)应不超过5%。
2.7 线性2.7.1在(1,396) umol/L范围内,线性回归的确定系数应不低于0.990;2.7.2 [30,396) umol/L范围内,相对偏差≤15%;2.7.3 (1,30) umol/L范围内,绝对偏差≤10umol/L。


血清直接胆红素测定标准操作规程1.检验原理:(机酸盐法)pH值接近3时,在锐酸盐和表面活性剂的作用下,胆红素被氧化成胆绿素。
此时,胆红素特有的黄色减少,在波长450nm处通过测定帆酸作用前后的吸光度的差可以求得样品中直接胆红素的浓度。
胆红素佩姗/表面活性剂>胆绿素3.样本要求新鲜无溶血血清,勿使用肝素抗凝血浆。
22〜25C保存8小时,2〜8℃保48小时,-20℃保存7天,样本不可反复冻融!4.检验方法:仪器法(详见DF-603∕DI-600标准操作规程)5.参考范围:6.检验结果的解释6.1样本含量超出线性范围时,建议用0.9%(W∕V)的氯化钠溶液稀释样本。
通常稀释2倍,当样本浓度较大时提高稀释倍数。
6.2单位换算:mg∕dL=umol∕L×0.05857检验方法的局限性6.1结果的准确性依赖于仪器的校正和测定温度、时间的控制。
7.2若试剂浑浊或以水空白在450nm处吸光度大于0.500时不能使用。
8.产品性能指标8.1线性范围:在给定的样本/试剂比例和条件下测定时,本世纪线性范围可达0-320umol∕Lo8.2试剂空白吸光度:在45Onm处,光径ICm时,空白吸光度AW0.500,△A空白/分钟WO.002.8.3准确度:相对偏差≤10%<.8.4精密度8. 4.1批内精密度CV≤3%8. 4.2批间精密度:R≤10%8.5分析灵敏度:在给定的样本/试剂比例和条件下测定时,IUmOl/L的直接胆红素对应的4A不低于1.5×IO-3内。
9.7方法比较:本试剂盒与商品化试剂盒测定40个样本测定结果相关性如下:y=1.052χ-1.254;r=0.9989.临床意义:在肝细胞内质网中,胆红素结合成水溶性的胆红素双葡糖醛酸酯,能和重氮试剂直接反应,故称直接胆红素。
它和总胆红素同时测定可作为黄疸的鉴别依据。

前言为使临床检验操作规范化,指导检验人员严格按规程进行正确的常规操作,保证检验质量,特制定本操作规程。
本规程的编写遵循了ISO 15189《医学实验室——关于质量和能力的特殊要求》及WS/T 227-2002《临床检验操作规程编写要求》的有关规定并结合产品实际情况制订,作为本产品的标准操作程序。
本规程从2007年5月2日起实施,每2年复审1次。
本规程由浙江伊利康生物技术有限公司编制。
本规程起草单位:伊利康生物技术有限公司技术部。
本规程主要起草人:蒙凯、蔡其浩。
本规程首次起草。
目录1 检验申请 (3)2 标本采集与处理 (3)3 试剂及成份 (4)4方法原理 (4)5 仪器 (4)6 校准液及校准模式 (4)7质控品与室内质控规则 (4)8标本检测步骤 (5)9 结果计算 (5)10 操作性能 (5)11试剂使用的注意事项 (5)12参考范围及医学决定水平 (5)13检验结果的报告及范围 (5)14临床意义 (6)15结果审核分析以及相关项目的联系 (6)16威胁生命的“紧急值”及报告规定. (6)17有关引用程序与文件 (6)18参考文献附录A XXX型生化分析仪参数直接胆红素测定标准操作规程1.检验申请单独检验项目申请:血清直接胆红素(缩写DBIL)测定;组合项目申请:肝功能测定项目组合。
临床医生根据需要提出检验申请。
2.标本采集与处理2.1 受检者的准备:病人空腹12h,不饮酒24h后。
体检对象抽血前应有两周的正常状况记录。
注意有无应用影响测试项目的药物。
此外,对于体检者,采血的季节都应做相关记录,因为样本中各项目的含量有季节性变动,为了前后比较应在每年同一季节检验。
应嘱体检对象在抽血前24小时内不做剧烈运动。
2.2标本采集2.2.1除非是卧床的病人,一般在采血时取坐位。
体位影响水分在血管内外的分布,会影响测试项目的浓度。
在采血前至少应静坐5分钟,一般从肘静脉取血,使用止血带的时间不超过1分钟,穿刺成功后立即松开止血带,不抗凝,置普通试管中。
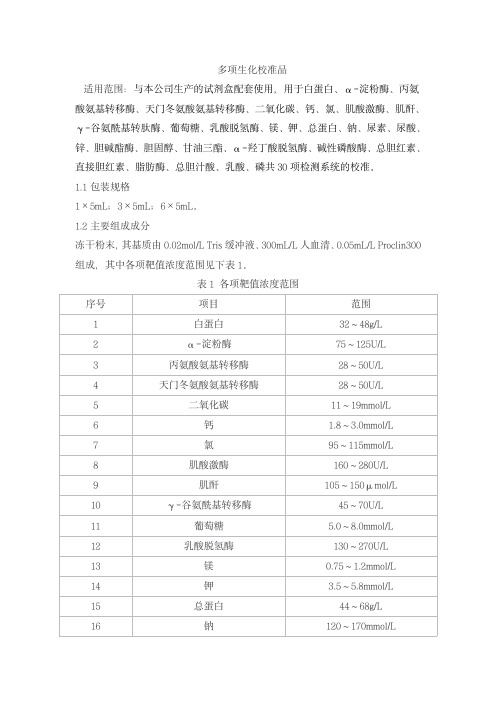
多项生化校准品适用范围:与本公司生产的试剂盒配套使用,用于白蛋白、α-淀粉酶、丙氨酸氨基转移酶、天门冬氨酸氨基转移酶、二氧化碳、钙、氯、肌酸激酶、肌酐、γ-谷氨酰基转肽酶、葡萄糖、乳酸脱氢酶、镁、钾、总蛋白、钠、尿素、尿酸、锌、胆碱酯酶、胆固醇、甘油三酯、α-羟丁酸脱氢酶、碱性磷酸酶、总胆红素、直接胆红素、脂肪酶、总胆汁酸、乳酸、磷共30项检测系统的校准。
1.1包装规格1×5mL;3×5mL;6×5mL。
1.2主要组成成分冻干粉末,其基质由0.02mol/L Tris缓冲液、300mL/L人血清、0.05mL/L Proclin300组成,其中各项靶值浓度范围见下表1。
表1各项靶值浓度范围校准品靶值批特异,详见说明书。
2.1外观和性状2.1.1各组分应齐全、完整、无渗漏;外包装完好、无破损,标签完好、字迹清晰。
2.1.2开封前应为白色或淡黄色冻干粉。
2.1.3复溶后应为浅黄色溶液,无浑浊,无未溶解物。
2.2准确度见表2:表2准确度要求2.3重复性变异系数(CV)应不超过10%。
2.4批内瓶间差变异系数(CV)应不超过10%。
2.5量值溯源根据GB/T21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》及有关规定提供校准品的来源、赋值过程及测量不确定度等内容,溯源情况见表3:表3溯源情况2.6稳定性2.6.1复溶稳定性复溶后的校准品在2℃~8℃条件下密闭避光保存,其中:1)二氧化碳可稳定6小时;2)胆红素可稳定6小时;3)其余项目可稳定1天。
各项目检测结果应符合2.2、2.3之规定。
复溶后的校准品在-20℃条件下密闭保存,可以稳定15天,应符合2.2、2.3之规定。
2.6.2效期稳定性该产品在2℃~8℃条件下密闭贮存有效期为24个月,取效期末的产品进行检测,应符合2.2、2.3之规定。

成都中医药大学2011年秋季学期期末考试立题格式论据行文结论总分得分姓名:学号:班级:胆红素检测的前景概况摘要:近年来,健康问题逐渐成为人们最关注的问题之一。
健康保健,健康体检逐渐成为人们生活中不可缺少的一部分。
在这些检查中,也不断地反映出一些情况来。
为了方便找出更有效的各种疾病的诊断、治疗方法,了解胆红素与人体各种疾病的关系便变得势在必行。
而血清胆红素在各种疾病诊断、治疗、及预后工作中的就显得尤为重要了。
血清胆红素浓度的测定在疾病诊断中也扮演着极其重要的角色,无论是肝功检测还是心血管疾病的诊断检测,血清胆红素都可作为一个很有力的参考依据。
于是,提高检测的灵敏度和特异度便可通过分析比较各种检测方法,找出精准度相对较高的检测方法或者寻找到更好的检测方法。
关键字:胆红素;重氮法;化学氧化法;KHC3法正文:胆红素(英文:Bilirubin)是胆色素的一种,它是人胆汁中的主要色素,呈橙黄色,同时也是内源性抗氧化活性的生物还原剂,它是血红蛋白分解代谢的一种产物[1],即它是体内铁卟啉化合物的主要代谢产物,有毒性,可对大脑和神经系统引起不可逆的损害,但也有抗氧化剂功能,可以抑制亚油酸和磷脂的氧化。
胆红素是临床上判定黄疸的重要依据,也是肝功能的重要指标。
胆红素有游离胆红素和结合胆红素两种形式,结合胆红素不存在分子内氢键,可以直接与重氮试剂结合,生成紫红色偶氮化合物,因此又称直接胆红素,游离胆红素存在分子内氢键[2],不能直接与重氮试剂结合,必须先用乙醇或尿素破坏氢键,才能与重氮试剂反应,因此又称间接胆红素。
正常人每天产生250-350mg的胆红素,其中70%是衰老红细胞血红蛋白血红素的降解产物,即衰老细胞被单核吞噬细胞系统破坏,释放出血红蛋白,再被分解成珠蛋白和血红素。
胆红素裂解成胆绿素,胆绿素还原成胆红素,即游离胆红素。
肝脏可以有效地摄取血浆游离胆红素,并将其转化成结合胆红素,提高其极性和水溶性,使其易于随胆汁排入肠道。
直接胆红素(DBIL)测定试剂盒(钒酸盐氧化法)适用范围:本产品用于体外定量测定人血清中直接胆红素的含量。
1.1 规格试剂1(R1):5×60mL,试剂2(R2):5×15mL;试剂1(R1):4×80mL,试剂2(R2):4×20mL;试剂1(R1):3×40mL,试剂2(R2):3×10mL;试剂1(R1):2×80mL,试剂2(R2):2×20mL;试剂1(R1):2×400mL,试剂2(R2):2×100mL;试剂1(R1):1×20mL,试剂2(R2):1×6mL;1.2试剂组成表1 试剂组成2.1 外观液体双试剂:试剂1(R1)为无色澄清液体,试剂2(R2)为浅黄绿色澄清液体。
2.2 装量液体试剂的净含量不得低于标示体积。
2.3空白吸光度在37℃、450nm波长、1cm光径条件下,试剂空白吸光度<0.1ABS。
2.4分析灵敏度浓度为100umol/L,吸光度变化范围在(0.07-0.2)之间。
2.5线性范围在[1-430]umol/L线性范围内,线性相关系数r2≥0.995。
在(150–430]umol/L,范围内的相对偏差≤15%;测定结果[1-150]umol/L时绝对偏差≤22.5umol/L。
2.6精密度试剂盒测试项目精密度 CV<5%。
2.7批间差不同批号之间测定结果的相对偏差应<10%。
2.8准确度回收率:回收率80%-120%。
2.9稳定性原包装试剂,在(2-8)℃下有效期为18个月,取失效期的试剂盒检测其准确度和线性,试验结果满足2.5、2.8的要求。
医疗器械产品技术要求:肝功多项检测卡(微流控干化学法)适用范围:本产品与本公司的干式生化分析仪配套使用,用于体外定量测定人静脉全血、末梢全血、血浆、血清中丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、L-γ-谷氨酰基转移酶(GGT)、白蛋白(ALB)、总蛋白(TP)、碱性磷酸酶(ALP)、总胆红素(TBIL)、直接胆红素(DBIL)共8项的含量。
1.1包装规格10人份/盒。
1.2主要组成成分每盒包括10人份检测卡密封袋、1张信息卡(NFC卡,内含标准曲线信息)。
每人份检测卡密封袋含有1张检测卡和1个干燥剂。
检测卡:由载有化学试剂的固相聚合物载体组成;化学试剂成分如表1所示。
表1肝功多项检测卡(微流控干化学法)主要组成成分2.1外观试剂盒外观应整洁,各组分齐全,文字、符号标识清晰、内容完整。
2.2空白限用空白样本加入检测卡测试,各指标空白限应满足以下要求,见表2。
表2肝功多项检测卡(微流控干化学法)空白限要求2.3准确度2.3.1用有证参考物质作为样本进行检测,碱性磷酸酶(ALP)、丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、L-γ-谷氨酰基转移酶(GGT)、总胆红素(TBIL),其相对偏差在±15%范围内;白蛋白(ALB)、总蛋白(TP),其相对偏差在±10%范围内;2.3.2使用标准溶液作为样本进行检测,直接胆红素(DBIL)回收率在85%~115%范围内。
2.4线性检测卡线性须满足以下要求,见表3表3肝功多项检测卡(微流控干化学法)线性要求2.5精密度2.5.1重复性测试血清样本或质控样本的变异系数(CV)应满足:碱性磷酸酶(ALP)、丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、L-γ-谷氨酰基转移酶(GGT)、总胆红素(TBIL)、直接胆红素(DBIL)均应不大于10.0%;白蛋白(ALB)、总蛋白(TP)均应不大于5.0%。
总胆红素(TBIL)含量检测试剂盒说明书微量法货号:BC5185规格:100T/96S产品内容:使用前请认真核对试剂体积与瓶内体积是否一致,有疑问请及时联系索莱宝工作人员。
试剂名称规格保存条件试剂一液体30mL×1瓶4℃保存试剂二液体10mL×1瓶4℃保存产品说明:总胆红素(Total bilirubin,TBil)是直接胆红素和间接胆红素的总和。
血清总胆红素的测定是肝、胆功能检查中的一项重要检测项目。
能准确地反映黄疸的程度,对临床诊断隐性黄疸有重要意义。
在表面活性剂的存在下,总胆红素能被亚硝酸钠氧化,生成胆绿素。
通过检测450nm下波长变化,可计算出总胆红素的含量。
注意:实验之前建议选择2-3个预期差异大的样本做预实验。
如果样本吸光值不在测量范围内建议稀释或者增加样本量进行检测。
需自备的仪器和用品:可见分光光度计/酶标仪、低温离心机、可调式移液器、微量玻璃比色皿/96孔板、冰和蒸馏水。
操作步骤:一、样本处理(可适当调整待测样本量,具体比例可以参考文献)血清、血浆等液体样本:直接测定。
若有浑浊可以离心后取上清进行测定。
二、测定步骤1、分光光度计/酶标仪预热30min以上,调节波长至450nm,分光光度计蒸馏水调零。
2、按下表步骤加样(在EP管或者96孔板上加入下列试剂):试剂名称(μL)测定管空白管样本20蒸馏水20试剂一240240充分混匀,37℃避光孵育5min,测定450nm处吸光度,分别记为A1测定、A1空白试剂二6060充分混匀,37℃避光反应5min,测定450nm处吸光度,分别记为A2测定、A2空白;ΔA测定=A1测定-A2测定;ΔA空白=A1空白-A2空白。
空白管只需测1-2次。
(使用比色皿反应时,第一步5min反应完成将液体倒入比色皿比色后,可直接在比色皿中加入试剂二混合均匀反应5min直接进行测定;使用96孔板反应时,可以将上述试剂直接加入96孔板中反应第一步的5min,之后直接加入试剂二进行第二步反应)三、TBIL含量计算1、计算公式(1)使用96孔板:TBIL含量(μmol/L)=874.67×(ΔA测定-ΔA空白)+10.699(2)使用微量比色皿:TBIL含量(μmol/L)=491.98×(ΔA测定-ΔA空白)+18.478注意事项:1、胆红素见光易分解,测定时要尽量避光。
直接胆红素测定试剂盒(钒酸盐氧化法)适用范围:本试剂用于体外定量测定人血清中直接胆红素的含量。
1.产品型号/规格产品组成:2.1 外观2.1.1 试剂1为无色透明液体,无混浊,无未溶解物。
2.1.2 试剂2为浅黄色透明液体,无混浊,无未溶解物。
2.1.3 校准品为浅黄色冻干粉,溶解后为黄色液体,无未溶解物。
2.1.4 标签内容清晰,字迹牢固不易脱落。
2.2 试剂装量液体试剂的净含量不少于标示值。
2.3 含水量校准品冻干粉含水量≤3%。
2.4 试剂空白吸光度A≤0.080(光径1.0cm,546nm±20nm 波长)。
2.5 分析灵敏度测定20μmol/L样本,吸光度变化在0.02~0.04范围内。
2.6 线性区间2.6.1 [1,342]μmol/L。
在规定的线性范围内,测定值与样本浓度值的相关系数(r)应不低于0.990。
2.6.2 [1,10]μmol/L范围内,线性绝对偏差应不超过±1μmol/L;(10,342]μmol/L范围内,线性相对偏差应不超过±10%。
2.7 精密度2.7.1 重复性变异系数CV≤5.0%。
2.7.2 批内瓶间差试剂盒内校准品瓶间差CV≤5.0%。
2.7.3 批间差批间相对极差≤6.0%。
2.8 准确度回收率在(100±10)%范围内。
2.9 稳定性2.9.1 校准品冻干粉复溶后在2℃~8℃避光保存稳定4天,测定结果应符合2.8要求。
2.9.2 原装试剂2℃~8℃保存,有效期12个月,有效期满后2个月内测定结果应符合2.1、2.4、2.5、2.6、2.7.1、和2.8要求。
直接胆红素测定试剂盒(胆红素氧化酶法)
适用范围:本试剂用于体外定量测定人血清中直接胆红素[DBIL]的浓度。
1.1包装规格
1.2主要组成成分
本试剂由试剂1(R1)和试剂2(R2)组成
试剂1(R1):
邻苯二甲酸盐缓冲液 120mmol/L
NaF(氟化钠) 2.5mmol/L NAC (N-乙酰半胱氨酸) 2.5mmol/L
对甲苯磺酸钠 50mmol/L EDTA 2g/L 叠氮钠 0.5g/L 试剂2(R2):
Tris缓冲液 100mmol/L 胆红素氧化酶 3KU/L
酶稳定剂k-80 4g/L
叠氮钠0.5g/L 2.1 外观
试剂盒各组分应齐全、完整、液体无渗漏;外包装完好、无破损,标签完好、字迹清晰;R1试剂应为无色澄清液体,R2试剂应为无色或淡黄色澄清液体。
液体试剂不得有沉淀和絮状物。
2.2 净含量
用通用量具测量,液体试剂的净含量应不少于标示值。
2.3 试剂空白
在450nm处测定试剂空白吸光度,应≤0.050A。
2.4 分析灵敏度
测试50umol/L的被测物时,吸光度变化(ΔA)应不低于0.005A。
2.5 准确性
在样品中加入一定体积的纯品,计算回收率,应介于90%~110%之间。
2.6 重复性
用两个水平的样本检测,检测结果批内变异系数(CV)应不超过5%。
2.7 线性
2.7.1在[0.2,342]umol/L范围内,线性相关系数r应不低于0.990;
2.7.2 在[0.2,34.2)umol/L范围内绝对偏差不超过±
3.4umol/L;
[34.2,342]umol/L范围内相对偏差不超过±10%。
2.8 批间差
对同一份样品进行重复测定,相对极差≤10%。
2.9 稳定性
该产品在2℃~8℃条件下贮存有效期为12个月,取到效期后的产品进行检测,应符合2.1、2.3、2.4、2.5、2.6、2.7的要求。