总胆红素(TBIL)测定试剂盒(钒酸盐氧化法)产品技术要求sainuopu
- 格式:docx
- 大小:14.25 KB
- 文档页数:2

总胆红素测定试剂盒(钒酸盐氧化法)适用范围:用于体外定量检测人血清中总胆红素的浓度。
1.1包装规格a) 试剂1:2×60ml,试剂2:2×15ml;b) 试剂1:4×60ml,试剂2:4×15ml;c) 试剂1:3×80ml,试剂2:3×20ml;d) 试剂1:2×40ml,试剂2:2×10ml;e)试剂1:2×400ml,试剂2:2×100ml;f)试剂1:2×72ml,试剂2:2×18ml;g)试剂1:12×16ml ,试剂2:12×4ml;h)试剂1:1×40ml,试剂2:1×10ml。
1.2主要组成成分试剂1主要成成组分试剂2主要组成成分2.1 外观和性状2.1.1 试剂盒各组分应齐全、完整、液体无渗漏;外包装完好、无破损,标签完好、字迹清晰。
2.1.2 试剂1应为无色或淡黄色透明溶液;试剂2应为无色或淡黄色透明溶液。
2.2 净含量应不低于试剂瓶标示装量。
2.3 试剂空白吸光度在450nm波长下,测定试剂空白吸光度,应≤0.05。
2.4 分析灵敏度测试550 umol/L的被测物时,吸光度变化(ΔA)应不低于0.15。
2.5 准确度测定国家标准品(YY90377),测定值与靶值相对偏差不超过±10%。
2.6 精密度2.6.1批内精密度批内精密度应不大于5%。
2.6.2批间差抽取3个不同批号试剂,对两个浓度样品进行重复检测,批间差应不大于10%。
2.7 线性2.7.1 在[3,628]umol/L区间内,线性回归的相关系数(r)应不低于0.990;2.7.2 (50,628]umol/L区间内,相对偏差不超过±15%。
2.7.3 [3,50]umol/L区间内,绝对偏差不超过±7.5umol/L。
2.8 稳定性该产品在2℃~8℃条件下贮存有效期为18个月,取效期末的产品进行检测,应符合2.1、2.3、2.4、2.5、2.6.1、2.7之规定。

医疗器械产品技术要求编号:总胆红素测定试剂盒(钒酸盐氧化法)1.产品型号/规格及划分说明1.1包装规格试剂1:60mL×8、试剂2:60mL×2;试剂1:68mL×3、试剂2:51mL×1;试剂1:50mL×4、试剂2:25mL×2;试剂1:60mL×1、试剂2:15mL×1;试剂1:68mL×3、试剂2:17mL×3;试剂1:60mL×3、试剂2:45mL×1;试剂1:60mL×6、试剂2:45mL×2;试剂1:20mL×1、试剂2:5mL×1;1200测试/盒(试剂1:68mL×2、试剂2:17mL×2);2400测试/盒(试剂1:68mL×4、试剂2:17mL×4);1750测试/盒(试剂1:100mL×2、试剂2:25mL×2);1050测试/盒(试剂1:20mL×6、试剂2:10mL×3);1680测试/盒(试剂1:48mL×4、试剂2:12mL×4);1260测试/盒(试剂1:48mL×3、试剂2:36mL×1);800测试/盒(试剂1:24mL×2、试剂2:6mL×2);1000测试/盒(试剂1:50mL×4、试剂2:24mL×2);1800测试/盒(试剂1:68mL×3、试剂2:50mL×1);750测试/盒(试剂1:60mL×1、试剂2:14mL×1);2200测试/盒(试剂1:72mL×4、试剂2:23mL×4)。
1.2组成成分试剂1:酒石酸缓冲液(pH=3.0)100mmol/L试剂2:磷酸缓冲液(pH=7.0)10mmol/L偏钒酸钠 3.5mmol/L1.3适用范围仅供定量测定人血清中总胆红素的浓度。

总胆红素(TBIL)测定试剂盒(重氮盐法)适用范围:本产品用于体外定量测定人血清中总胆红素的含量。
1.1规格试剂1(R1):4×80mL,试剂2(R2):1×16mL;试剂1(R1):5×60mL,试剂2(R2):1×16mL;试剂1(R1):3×40mL,试剂2(R2):1× 6mL;试剂1(R1): 4×80mL,试剂2(R2):4×16mL;试剂1(R1):5×60mL,试剂2(R2):5×12mL;试剂1(R1):4×80mL,试剂2(R2):4×20mL;试剂1(R1):4×60mL,试剂2(R2):4×20mL;试剂1(R1):5×60mL,试剂2(R2):5×15mL;试剂1(R1):1×20mL,试剂2(R2):1×3mL。
1.2 组成表1 试剂组成2.1 外观液体双试剂:试剂1(R1)为无色澄清液体,试剂2(R2)为无色澄清液体。
2.2 净含量液体试剂的净含量不得低于标示体积。
2.3 空白吸光度在37℃、(546 nm±10%范围内的)波长、1cm光径条件下,试剂空白吸光度应<0.1 ABS。
2.4 分析灵敏度浓度为84.9μmol/L时,吸光度变化范围在(0.2-0.5)之间。
2.5 线性范围在[0 -340]μmol/L线性范围内,线性相关系数r2 ≥0.996。
在(100–340]μmol/L范围内的相对偏差≤10%;测定结果[0-100]μmol/L时绝对偏差≤10μmol/L。
2.6 精密度试剂盒测试项目精密度 CV< 6%。
2.7 批间差不同批号之间测定结果的相对极差应< 10%。
2.8 准确度相对偏差:用参考物质配制一定浓度的溶液作为样本进行检测,其测量结果在(100–340]μmol/L范围内的相对偏差≤10%,在[0-100]μmol/L范围内的绝对偏差≤10μmol/L。

直接胆红素测定试剂盒(钒酸盐氧化法)
适用范围:本产品适用于体外定量测定人血清中直接胆红素的含量。
1.1 产品规格
1.2 主要组成成分
2.1外观
2.1.1试剂盒标签标识清晰,外包装完整无破损;
2.1.2试剂1为无色澄清液体,目测不得有任何沉淀及絮状悬浮物;
2.1.3试剂2为淡黄色澄清液体,目测不得有任何沉淀及絮状悬浮物。
2.2净含量
净含量不低于标示值。
2.3空白吸光度
测定待检试剂在主波长450nm、副波长为546nm、37℃条件下:A≤0.05。
2.4线性范围
(3,340)μmol/L范围内,相关系数r≥0.990;
(3,50]μmol/L范围内,绝对偏差不超过±5μmol/L;
(50,340)μmol/L范围内,相对偏差不超过±10.0%。
2.5分析灵敏度
在产品说明书规定参数设定条件下,样本浓度为30µmol/L时,△A≥0.002。
2.6 精密度
2.6.1批内重复性
CV≤10.0%。
2.6.2 批间差
相对极差R≤10.0%。
2.7 准确度
与已上市产品比对:(3,340)μmol/L范围内,相关系数r≥0.990;(3,50]μmol/L范围内,绝对偏差不超过±5μmol/L;(50,340)μmol/L范围内,相对偏差不超过±10.0%。
2.8 稳定性
未开封试剂2℃~8℃储存,可稳定12个月。
取到效期后2个月内产品进行检测,检测结果应满足2.1、2.3、2.4、2.5、2.6.1和2.7的规定。
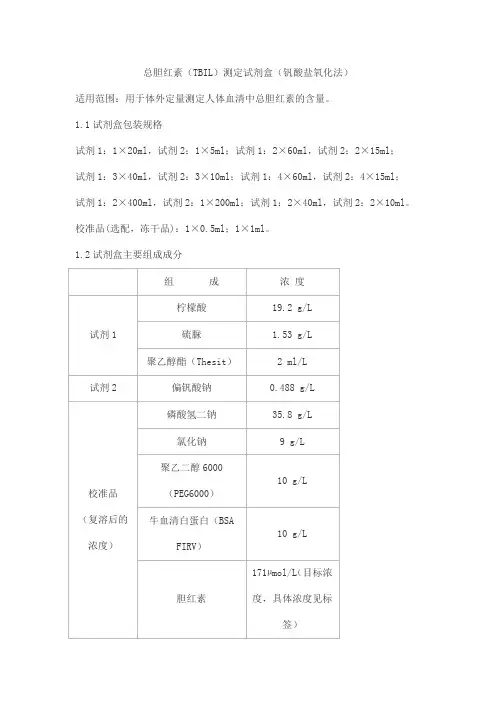
总胆红素(TBIL)测定试剂盒(钒酸盐氧化法)适用范围:用于体外定量测定人体血清中总胆红素的含量。
1.1试剂盒包装规格试剂1:1×20ml,试剂2:1×5ml;试剂1:2×60ml,试剂2:2×15ml;试剂1:3×40ml,试剂2:3×10ml;试剂1:4×60ml,试剂2:4×15ml;试剂1:2×400ml,试剂2:1×200ml;试剂1:2×40ml,试剂2:2×10ml。
校准品(选配,冻干品):1×0.5ml;1×1ml。
1.2试剂盒主要组成成分2.1 外观试剂1:无色澄清液体;试剂2:无色至浅黄绿色澄清液体。
校准品:冻干品,复溶后为黄色至黄褐色液体。
2.2 净含量液体试剂的净含量不得低于标示体积。
2.3 试剂空白吸光度在37℃、450 nm波长、1cm光径条件下,试剂空白吸光度应不大于0.05。
2.4 分析灵敏度测定浓度为100µmol/L样本时,吸光度变化值(ΔA)应在(0.1,0.3)范围内。
2.5 线性范围在(2.0,680)µmol/L线性范围内,线性相关系数r应不小于0.995。
在[150,680)µmol/L范围内的线性相对偏差应不大于±10%;在(2.0,150)µmol/L范围内的线性绝对偏差不大于±15µmol/L。
2.6 重复性重复测试两份高低浓度的样本,所得结果的变异系数(CV%)应不大于5%。
2.7 批间差不同批号试剂测试同一份样本,测定结果的批间相对极差应不大于6%。
2.8 准确度相对偏差:相对偏差应不超过±10%。
2.9瓶间差(均一性)校准品的瓶间变异系数(CV%)应不大于5%。
2.10含水量(冻干品)校准品的水分含量不大于8%。
2.11 校准品溯源性依据GB/T 21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》的要求,校准品溯源至NIST生产的有证参考物质(SRM 916)。

直接胆红素测定试剂盒(钒酸盐氧化法)适用范围:本试剂盒用于体外定量测定人血清中直接胆红素的含量。
1.1包装规格试剂1:3×80mL,试剂2:3×20mL;试剂1:4×60mL,试剂2:4×15mL;试剂1:6×40mL,试剂2:3×20mL;试剂1:2×80mL,试剂2:2×20mL 1.2产品组成试剂1:酒石酸缓冲液100mmol/L。
试剂2:磷酸盐缓冲液10mmol/L,钒酸钠10mmol/L。
2.1 外观试剂1为无色透明液体;试剂2为无色或略带黄色透明溶液;试剂盒各组分齐全、完整,液体无渗漏,包装标签文字符号清晰牢固不易脱落,外包装完整无破损。
2.2 装量液体试剂的净含量应不少于标示值。
2.3 试剂空白吸光度在450nm波长、1cm光径条件下,试剂空白吸光度应不大于0.050。
2.4 分析灵敏度测定40.0μmol/L直接胆红素时,吸光度的变化应在0.0620±0.020范围内。
2.5 准确度采用比对试验,相关系数r2≥0.95,相对偏差应不超过±10%。
2.6 精密度2.6.1 重复性用血清样品或质控样品重复测试所得的变异系数(CV)应不大于5.0%。
2.6.2 批间差试剂(盒)批间相对极差应不大于5.0%。
2.7线性试剂线性在[1.0,256.0]μmol/L区间内:a) 线性相关系数|r|应不小于0.990;b) [1.0,20.0]μmol/L区间内,线性绝对偏差应不超过±2.0μmol/L;(20.0,256.0]μmol/L区间内,线性相对偏差应不超过±10%。
2.8稳定性原包装试剂2~8℃避光保存有效期12个月,到效期末进行检验,检验结果应符合2.1、2.3、2.4、2.5、2.6.1、2.7的要求。

总胆红素测定试剂盒(钒酸盐氧化法)原则化操作规程1 目旳规范实验室操作,保证检查工作顺利有效进行特制定此规程。
2 授权操作人经培训且考核通过旳实验室检查人员。
3 合用范畴本试剂合用于体外定量检测人血清或血浆中旳总胆红素旳浓度。
4 检查措施本试剂盒采用钒酸盐氧化法测定总胆红素旳浓度。
5 检查原理pH值接近3时,在钒酸盐、加速剂和表面活性剂旳作用下,总胆红素被氧化成胆绿素,胆红素在450nm处旳特异性吸光度下降。
通过测定钒酸盐氧化前后吸光度旳变化,即可计算出样品中总胆红素旳含量。
6 检查标本规定6.1标本类型: 使用新鲜血清样本,不要使用溶血及乳糜血样本。
6.2原则运送:室温条件下运送。
7 试剂及配套品7.1试剂来源长春迪瑞医疗科技股份有限公司总胆红素试剂盒(钒酸盐氧化法)7.2试剂构成7.3试剂旳稳定性与贮存:7.3.1试剂在2˚C ~8˚C条件下,干燥、避光、密封贮存,有效期12个月。
7.3.2开封后在2~8℃可稳定30天。
8 实验仪器及性能指标8.1 实验仪器迪瑞CS系列全自动生化分析仪8.2试剂性能指标8.2.1试剂空白:试剂空白吸光度A≤0.0508.2.2分析敏捷度:测试1μmol/L被测物时,吸光度变化△A<-0.0002。
8.2.3线性范畴: 0~684.0μmol/L,线性有关系数r值≥0.9900;线性范畴在0~187.0μmol/L时,绝对偏差应不超过±28.05μmol/L;线性范畴在187.0~684.0μmol/L时,相对偏差应不超过±15%。
8.2.4精确度:相对偏差应在±10%。
8.2.5精密度:反复性:CV≤5.0%批间差: R≤6.0%9 校准9.1校准品来源长春迪瑞医疗科技股份有限公司生产旳临床化学校准血清9.2校准品旳构成:人血清9.4校准品使用注意事项9.4.1 若该复溶血清受细菌污染,将会减少许多成分旳稳定性。
9.4.2 不同批号旳校准血清不能交叉使用,由于批号于批号之间旳赋值不同。

总胆红素(TBIL)测定试剂盒(化学氧化法)适用范围:该试剂盒用于体外定量测定人血清中总胆红素的浓度。
1.1 产品规格1.2 组成成分该试剂盒由试剂1(R1)、试剂2(R2)和校准品(选配)组成。
1.2.1试剂组成试剂1: 磷酸盐缓冲液≥100.0mmol/L 表面活性剂≥1.0mL/L试剂2: 磷酸盐缓冲液(pH7.00)≥10.0mmol/L化学氧化剂≥10.0mmol/L 1.2.2 校准品组成牛血清总胆红素目标浓度:200μmol/L该校准品为牛血清基质冻干品2.1 外观a) R1应为无色溶液,无混浊,无未溶解物。
b) R2应为无色溶液,无混浊,无未溶解物。
c) 校准品应为白色至淡黄色固体2.2 净含量液体组分不少于标示值。
2.3 试剂空白2.3.1试剂空白吸光度应不大于0.050。
2.4 分析灵敏度TBIL试剂盒测定浓度100.0μmol/的被测物时,吸光度差值(ΔA)应不小于0.050。
2.5 准确度测试参考物质,测定结果的相对偏差应不超过±10%。
2.6 精密度2.6.1重复性变异系数应不大于5%。
2.6.2批间差批间相对极差(R)应不大于10%。
2.6.3校准品批内瓶间差测试校准品,所得结果的批内瓶间差应不大于5%。
2.7 线性在(0,684.0]μmol/L范围内,TBIL试剂盒的线性相关系数r应不低于0.9900;在(0,50.0]范围内绝对偏差应不超过5.0μmol/L,在(50.0,684.0]范围内相对偏差应不超过±10%。
2.8校准品溯源性依据GB/T21415-2008《体外诊断医疗器械生物样品中量的测量校准品控制物质赋值的计量学溯源性》及有关规定提供总胆红素校准品的来源、赋值过程以及测量不确定度等内容。
校准品溯源至国家参考物质GBW(E)090002。
2.9稳定性2.9.1校准品复溶稳定性校准品复溶后,在2℃~8℃密封保存24小时,测试试剂盒准确度,应符合2.5的要求。

总胆红素测定试剂盒(钒酸盐氧化法)适用范围:用于体外定量检测人血清中总胆红素的浓度。
1.1规格a) 试剂1:2×40ml,试剂2:2×10ml;b) 试剂1:3×80ml,试剂2:3×20ml;c) 试剂1:4×60ml,试剂2:4×15ml;d) 试剂1:2×60ml,试剂2:2×15ml;e) 试剂1:2×72ml,试剂2:2×18ml;f) 试剂1:12×16ml,试剂2:12×4ml;g) 试剂1:2×400ml,试剂2:2×100ml;h) 试剂1:1×60ml,试剂2:1×15ml;i) 试剂1:1×40ml,试剂2:1×10ml;j) 试剂1:8×60ml,试剂2:2×60ml;k) 试剂1:4×40ml,试剂2:4×10ml。
1.2 组成试剂主要组分见表1:表1 试剂主要组分2.1 外观外包装完整无破损,标签清晰;试剂1应为无色或淡黄色透明溶液;试剂2应为无色或淡黄色透明溶液。
2.2 净含量应不低于试剂瓶标示装量。
2.3 试剂空白在450nm处测定试剂空白吸光度,应≤0.05。
2.4 分析灵敏度测定浓度为550μmol/L的样品,吸光度变化(ΔA)应不低于0.15。
2.5 线性2.5.1在[3,628]μmol/L范围内,线性回归的相关系数应不低于0.990;2.5.2测试浓度[100,628]μmol/L的样品,相对偏差应不超过±10%;测试浓度[3,100)μmol/L的样品,绝对偏差应不超过±10μmol/L。
2.6 重复性2.6.1 批内重复性变异系数(CV)应不超过5%。
2.6.2 批间差对同一份样品进行重复测定,相对极差(R)应不超过10%。

◆许可证号:浙食药监械生产许20090029号 ◆产品注册号: ◆产品标准号: -20093.4~21.7μmol/L(参照《全国临床检验操作规程》,建议各实验室建立自己的参考范围)检验结果的解释本法的检测范围为0~400μmol/L ,当样品测定值超过上限,应将样品用生理盐水进行稀释,重新测定,结果乘以稀释倍数。
检验结果的局限性1、当样品中抗坏血酸浓度≥1704μmol/L ,血红蛋白浓度≥4.0g/L ,甘油三酯浓度≥20mmol/L 时对测定结果又干扰。
2、血清中TBIL 的测定只是临床医师对患者进行诊断的指标之一,临床医师还要根据患者的体症、病史以及其他诊断项目、诊断手段进行综合判断。
产品性能指标1、线性范围:0~400μmol/L (相关系数r ≥0.99)2、重复性:测量精密度CV ≤4%、批间差≤8%3、准确度:相对偏差<10%注意事项1、试剂盒样品用量可因仪器要求不同,按比例增减,计算公式不变。
2、本试剂仅供体外诊断用,试剂产生的废液及使用后难以降解的包装材料应集中收集后交当地废物处理站处理。
3、试剂使用后立即盖紧瓶盖,避免污染。
4、不同方法学试剂的质量控制结果之间会存在差异,使用时请确保质控选择与试剂的方法学保持一致。
5、不同批号的试剂不建议混用,如混用应重新校准。
参考文献1、叶应妩,王毓三.全国临床检验操作规程[M],3版.南京:东南大学出版社.,2006:452-457.2、德田邦明,古本和仁:临床化学22(2),116-122(1993)。
总胆红素检测试剂盒说明书(氧化法)企业名称:温州市维日康生物科技有限公司 生产地址:温州市瓯海区娄桥工业园园一路邮政编码:325000 电话:0577- 86585999 86585666 传真:0577- 86581858 网址: 邮箱:weirikan@感谢您使用我们的产品,使用前请仔细阅读此说明书总胆红素检测试剂盒说明书(氧化法)产品名称1、中文名称:总胆红素检测试剂盒(氧化法)2、英文名称:Total Bilirubin Determine Reagent Kit(Oxidation method)3、英文缩写:TBIL或TB包装规格预期用途本试剂盒用于体外定量检测人血清中总胆红素(TBIL)的含量。

总胆红素测定试剂盒(钒酸盐氧化法)适用范围:本试剂盒用于体外定量测定人血清中总胆红素浓度1.1规格:试剂1:1×40ml;试剂2:1×10ml试剂1:2×40ml;试剂2:1×20ml试剂1:1×60ml;试剂2:1×15ml试剂1:1×80ml;试剂2:1×20ml试剂1:3×80ml;试剂2:3×20ml试剂1:4×60ml;试剂2:3×20ml试剂1:2×80ml;试剂2:2×20ml试剂1:4×60ml;试剂2:4×15ml试剂1:4×60ml;试剂2:1×60ml试剂1:2×40ml;试剂2:2×10ml试剂1:8×60ml;试剂2:2×60ml试剂1:2×60ml;试剂2:2×15ml2.1 外观试剂1、试剂2均为无色至浅黄色澄清液体。
2.2 净含量试剂的净含量不少于标称装量。
2.3 试剂空白吸光度在450nm波长下,用生理盐水作为样本加入试剂测试时,试剂空白吸光度应不大于0.050。
2.4 分析灵敏度TB含量为100umol/L时,测定吸光度差值的绝对值>0.020△A。
2.5 线性区间试剂(盒)线性在[1.2,684]umol/L区间内:2.5.1 线性相关系数(r)应不小于0.9900;2.5.2 [1.2,68]umol/L区间内,线性绝对偏差不超过±7umol/L;(68,684]umol/L 区间内,线性相对偏差不超过±10%。
2.6 精密度2.6.1 重复性用相同批号试剂盒测试两个水平的质控品,所得结果的重复性(变异系数,CV)应不大于5.0%。
2.6.2 批间差用3个不同批号试剂盒测试两个水平的质控品,试剂(盒)批间相对极差应不大于10.0%。
总胆红素测定试剂盒(钒酸盐氧化法)适用范围:用于体外定量测定人血清中总胆红素的含量。
1.1 包装规格包装规格见表1。
表1 包装规格1.2 主要组成成分主要组成成分见表2。
表2 试剂成分2.1 外观试剂1为无色澄清液体,目测不得有任何沉淀及絮状悬浮物;试剂2为淡黄色澄清液体,目测不得有任何沉淀及絮状悬浮物;试剂盒标签标识清晰,外包装完整无损。
2.2 净含量试剂的净含量应不少于标称量。
2.3 试剂空白吸光度试剂空白:A450nm(主)/A546nm(副)下测定空白吸光度应≤0.0500。
2.4 准确度使用国家标准物质GBW09184,对试剂盒进行测试,实测值与标示值的相对偏差应在±10.0%内。
2.5 分析灵敏度样本浓度为82.0μmol/L时,其吸光度变化在0.0540~0.1080之间。
2.6 线性区间在[3.0,684.0]μmol/L区间内,线性相关系数r应不小于0.9900,在[3.0,30.0]μmol/L区间内测定的绝对偏差应不超过±3.0μmol/L,在(30.0,684.0]μmol/L区间内测定的相对偏差应不超过±10%。
2.7 精密度2.7.1重复性对高、低两个浓度的血清样本或质控品重复测定10次,其测定值的变异系数(CV%)应不大于5%。
2.7.2批间差随机抽取三批试剂盒的批间相对极差(R)应不大于10%。
2.8 稳定性试剂盒在2℃~8℃密封避光保存,有效期为18个月。
试剂盒在规定的保存条件下保存至有效期末进行检验,检验结果应符合2.1、2.3、2.4、2.5、2.6、2.7.1的要求。
复星长征体外诊断试剂标准操作规程试剂名称:总胆红素试剂盒(钒酸盐法)上海复星长征医学科学有限公司目录1 试剂盒概况2 方法学原理3 试剂主要组分4 样本准备5 试剂准备6 校准要求7 质量控制8 计算方法9 参数设定10 参考范围11 试剂性能概要12 超出可报告范围的处理13 其他必须说明的内容14 参考文献1 试剂盒概况1.1 货号:1.02.2801/1.02.2802/1.02.2803/1.02.2805。
1.2 包装规格:试剂1(R1):4×60mL;试剂2(R2):4×15mL试剂1(R1):2×60mL;试剂2(R2):2×15mL试剂1(R1):6×40mL;试剂2(R2):2×30mL。
1.3 医疗器械注册证编号/产品技术要求编号:沪械注准20172400523/沪械注准201724005232 方法学原理本试剂采用表面活性剂为间接胆红素的增溶剂。
在酸性溶液中,样本中的总胆红素在被钒酸盐氧化生成胆绿素的同时,在450nm波长处可引起吸光度的下降。
其在450nm波长处吸光度的下降值与样本中总胆红素的浓度成正比。
通过在450nm波长处测定总胆红素在氧化前后吸光度的差值,即可测得样本中总胆红素的浓度。
3 试剂主要组分3.1 试剂1(R1)柠檬酸缓冲液100mmol/L表面活性剂 1.0%3. 2 试剂2(R2)磷酸盐缓冲液200mmol/L偏钒酸钠 3.8mmol/L3.3 储存条件3.3 . 1在2~8℃避光、密封的储存条件下,试剂盒自生产之日起效期18个月。
3.3 . 2 试剂启用后,在2~10℃避光的条件下可稳定14 天。
4 样本准备4.1 样本要求:血清样本应不溶血,防止阳光照射。
4.2 样本稳定性要求:样本在2~8˚C 可保存4~7天,在室温可保存2天。
5 试剂准备试剂为液体双试剂形式,无须特别准备,可直接上机使用。
总胆红素测定试剂盒(钒酸盐氧化法)适用范围:本产品用于体外定量测定人血清中总胆红素的含量。
本产品用于体外定量测定人血清中总胆红素的含量。
1.1 规格具体产品规格见下表:1.2组成成分试剂1:柠檬酸缓冲液(pH2.6) 100mmol/L试剂2:磷酸缓冲液(pH7.0) 10mmol/L偏钒酸钠 4mmol/L 2.1 外观2.1.1 外包装完整无破损;2.1.2 试剂1:无色澄清透明液体;2.1.3 试剂2:无色或淡黄色澄清透明液体。
2.2 净含量净含量不低于标示值。
2.3 试剂空白吸光度在主波长450nm、副波长546nm、37℃条件下,试剂空白吸光度不大于0.050。
2.4 线性2.4.1 线性范围[5.0,680.0]μmol/L线性范围内,相关系数r>0.990。
2.4.2 线性偏差(50.0,680.0]μmol/L线性范围内,相对偏差不超过±10%。
[5.0,50.0]μmol/L线性范围内,绝对偏差不超过±10.0μmol/L。
2.5 分析灵敏度检测浓度为221.0μmol/L的样本时,吸光度变化不小于0.01。
2.6 重复性测试不同浓度的样本或质控品,重复测试至少10次,CV不大于5%。
2.7 批间差用三个不同批号的试剂测试同一样本,重复测试3次,相对极差R不大于10%。
2.8 准确度测定360033标准物质水平2,测定结果应不超过标示值的±10%。
2.9 稳定性原包装试剂2~8℃避光储存,有效期12个月。
效期后1个月内产品,应符合2.1、2.3、2.4、2.5、2.6和2.8的要求。
总胆红素测定试剂盒(钒酸盐氧化法) 适用范围:用于体外定量测定人血清中总胆红素的含量。
1.1 包装规格试剂1: 1×24mL, 试剂2: 1×6mL;试剂1: 1×60mL, 试剂2: 1×12mL;试剂1: 1×60mL, 试剂2: 1×15mL;试剂1: 1×60mL, 试剂2: 1×20mL;试剂1: 2×40mL, 试剂2: 2×10mL;试剂1: 2×50mL, 试剂2: 1×25mL;试剂1: 2×80mL, 试剂2: 2×20mL;试剂1: 2×80mL, 试剂2: 2×80mL;试剂1: 3×28mL, 试剂2: 3×7mL;试剂1: 4×60mL, 试剂2: 4×15mL;试剂1: 4×90mL, 试剂2: 2×45mL;试剂1: 6×60mL, 试剂2: 2×45mL;试剂1: 1×4 L, 试剂2: 1×1 L;试剂1: 2×4L, 试剂2:1×2L。
1.2 组成成分试剂1:试剂2:2.1 外观试剂1:无色澄清液体。
试剂2:淡黄色澄清液体。
外包装完好、无破损,标签完好、字迹清晰。
2.2 装量液体试剂的装量应不少于标示值。
2.3 试剂空白吸光度A450nm下测定空白吸光度应≤ 0.0500。
2.4 分析灵敏度样本浓度为100 μmol/ L时,其吸光度变化在0.0810~0.1510之间。
2.5 准确度参照CLSI EP9-A2的方法,与比对试剂盒同时测试40例线性范围内的不同浓度的血清样本,在[3.0,684] μmol/ L线性范围内,线性相关系数r应≥0.975,在[3.0,68.4] μmol/ L区间围内测定的偏差应不超过±6.8μmol/ L,在(68.4,684] μmol/ L区间内测定的偏差应不超过±10%。
目录1. 检测原理2. 标本采集与处理2.1 受检者的准备2.2 静脉采血2.3 抗凝剂2.4 标本处理3. 试剂3.1 试剂3.2 校准血清3.3 试剂与校准血清的稳定性4. 仪器5. 操作6. 计算7. 操作性能7.1 精密度7.2 准确度7.3 灵敏度7.4 可报告范围7.5 特异性7.6 干扰8. 参考值9. 临床意义附录A: 参数1. 检测原理钒酸盐测定钒酸盐作用前后吸光度差异,可求得样品中的直接胆红素的浓度。
胆红素————胆绿素pH 3.02. 标本采集与处理2.1 受检者的准备:病人空腹12h,不饮酒24h后采集血样。
体检对象抽血前应有两周的的正常状况记录。
注意有无应用影响测试项目的药物。
此外,对于体检者,采血的季节都应做相关记录,因为样本中各项目的含量有季节性变动,为了前后比较应在每年同一季节检验。
应嘱体检对象在抽血前24小时内不做剧烈运动。
2.2 静脉采血:除非是卧床的病人,一般在采血时取坐位。
体位影响水分在血管内外的分布,会影响测试项目的浓度。
在采血前至少应静坐5分钟,一般从肘静脉取血,使用止血带的时间不超过1分钟,穿刺成功后立即松开止血带。
2.3 抗凝剂:血浆多主张用EDTAN a2(1mg/mL)抗凝。
2.4 标本处理:血标本室温放置30mi n~45min后离心分离血清或血浆,在两小时内检测完毕;如两小时内不能检测完毕,将离心分离血清或血浆置洁净试管加盖2-8℃保存。
3.试剂3.1 试剂:本科使用湖南永和阳光科技有限责任公司TBI L试剂盒,为液体双试剂,各组分如下:3.2 校准血清:使用湖南永和阳光科技有限责任公司提供的40项校准血清。
校准频次:空白定标:每日需做试剂空白定标。
全点定标:试剂换批号使用时或质控结果超过规定的2SD范围,需要全点定标。
总胆红素(TBIL)测定试剂盒(钒酸盐氧化法)适用范围:本产品用于体外定量测定人血清中总胆红素的含量。
1.1 规格试剂1(R1):5×60mL,试剂2(R2):5×15mL;试剂1(R1):4×80mL,试剂2(R2):4×20mL;试剂1(R1):3×40mL,试剂2(R2):3×10mL;试剂1(R1):2×80mL,试剂2(R2):2×20mL;试剂1(R1):2×400mL,试剂2(R2):2×100mL;试剂1(R1):1×20mL,试剂2(R2):1×6mL。
1.2 试剂组成表1 试剂组成2.1 外观液体双试剂:R1为无色澄清液体,R2为浅黄绿色澄清液体。
2.2 净含量液体试剂的净含量不得低于标示体积。
2.3 空白吸光度在37℃、450 nm波长、1cm光径条件下,试剂空白吸光度应≤0.05 ABS。
2.4 分析灵敏度浓度为100µmol/L时,吸光度变化范围在(0.05-0.2)之间。
2.5 线性范围在[1-680]µmol/L线性范围内,线性相关系数r≥0.995。
在(150–680]µmol/L 范围内的相对偏差≤10%;测定结果[1-150]µmol/L时绝对偏差≤15µmol/L。
2.6 精密度试剂盒测试项目精密度CV≤5%。
2.7 批间差不同批号之间测定结果的相对偏差应< 6%。
2.8 准确度相对偏差:用参考物质配制一定浓度的溶液作为样本进行检测,其测量结果在(101–340)µmol/L范围内的相对偏差≤10%;在(0-100)µmol/L范围内的绝对偏差≤10µmol/L。
2.9 稳定性原包装试剂,在(2-8)℃下有效期为18个月,取失效期的试剂盒检测其外观、空白吸光度、分析灵敏度、线性范围、精密度和准确度试验结果满足2.1、2.3、2.4、2.5、2.6、2.8的要求。
总胆红素(TBIL)测定试剂盒(钒酸盐氧化法)
适用范围:用于体外定量测定人体血清中总胆红素的含量。
1.1试剂盒包装规格
试剂1:1×20ml,试剂2:1×5ml;试剂1:2×60ml,试剂2:2×15ml;
试剂1:3×40ml,试剂2:3×10ml;试剂1:4×60ml,试剂2:4×15ml;试剂1:2×400ml,试剂2:1×200ml;试剂1:2×40ml,试剂2:2×10ml。
校准品(选配,冻干品):1×0.5ml;1×1ml。
1.2试剂盒主要组成成分
2.1 外观
试剂1:无色澄清液体;试剂2:无色至浅黄绿色澄清液体。
校准品:冻干品,复溶后为黄色至黄褐色液体。
2.2 净含量
液体试剂的净含量不得低于标示体积。
2.3 试剂空白吸光度
在37℃、450 nm波长、1cm光径条件下,试剂空白吸光度应不大于0.05。
2.4 分析灵敏度
测定浓度为100µmol/L样本时,吸光度变化值(ΔA)应在(0.1,0.3)范围内。
2.5 线性范围
在(2.0,680)µmol/L线性范围内,线性相关系数r应不小于0.995。
在[150,680)µmol/L范围内的线性相对偏差应不大于±10%;在(2.0,150)µmol/L范围内的线性绝对偏差不大于±15µmol/L。
2.6 重复性
重复测试两份高低浓度的样本,所得结果的变异系数(CV%)应不大于5%。
2.7 批间差
不同批号试剂测试同一份样本,测定结果的批间相对极差应不大于6%。
2.8 准确度
相对偏差:相对偏差应不超过±10%。
2.9瓶间差(均一性)
校准品的瓶间变异系数(CV%)应不大于5%。
2.10含水量(冻干品)
校准品的水分含量不大于8%。
2.11 校准品溯源性
依据GB/T 21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》的要求,校准品溯源至NIST生产的有证参考物质(SRM 916)。
2.12稳定性
2.12.1复溶稳定性
校准品开瓶复溶后,复溶物在室温10℃~30℃密封避光保存,可以稳定4小时,在第5小时检测,校准品测量结果与靶值的相对偏差应在±10%以内,复溶物在2℃~8℃密封避光保存,可以稳定24小时,在第25小时内检测,校准品测量结果与靶值的相对偏差应在±10%以内。
2.12.2效期稳定性
试剂盒在2℃~8℃下有效期为12个月,取失效期的试剂盒进行检测,试验结果应满足2.1、2.3、2.4、2.5、2.6、2.8的要求。