大鼠水合氯醛麻醉的方法
- 格式:ppt
- 大小:83.00 KB
- 文档页数:10

mcao拟血管性痴呆大鼠模型的建立一、引言血管性痴呆(Vascular Dementia,VD)是一种由脑血管疾病引起的认知功能障碍,严重影响了患者的生活质量。
目前,VD的病理机制尚不完全清楚,因此建立可靠的动物模型对于深入研究VD的发病机制、早期诊断和治疗具有重要意义。
本研究旨在通过改进线栓法制备大脑中动脉阻塞(Middle Cerebral Artery Occlusion,MCAO)大鼠模型,以模拟VD的病理过程,为VD的研究提供一个新的工具。
二、材料与方法1. 实验动物选取健康雄性SD大鼠,体重在250300g之间,饲养于清洁级动物房,自由摄食和饮水。
动物实验符合动物伦理学要求。
2. MCAO模型的制备(1)手术准备:大鼠术前禁食12小时,不禁水。
术前10分钟腹腔注射10%水合氯醛(350mg/kg)麻醉。
麻醉后,将大鼠仰卧位固定于手术台上,剪去颈部毛发,消毒皮肤。
(3)模型评估:术后24小时进行神经功能缺损评分(Neurological Severity Score,NSS)和脑梗死体积测量。
NSS评分包括运动、感觉和平衡功能,总分018分,分数越高表示神经功能缺损越严重。
脑梗死体积通过TTC染色法测量,梗死体积百分比(%)=(梗死体积/半球体积)×100%。
3. 数据处理采用SPSS 22.0软件对数据进行统计分析。
计量资料以均数±标准差(±s)表示,组间比较采用t检验。
P<0.05为差异有统计学意义。
三、结果1. MCAO模型的制备成功率本实验共制备MCAO大鼠模型40只,成功率为95%(38/40)。
失败原因包括术中出血、术后死亡等。
2. 神经功能缺损评分术后24小时,MCAO组大鼠的NSS评分为(14.5±1.8)分,显著高于假手术组(1.8±0.5)分(P<0.01)。
3. 脑梗死体积术后24小时,MCAO组大鼠的脑梗死体积百分比为(38.5±5.2)%,显著高于假手术组(0.0±0.0)%(P<0.01)。

![大鼠水合氯醛麻醉心得[参考内容]](https://uimg.taocdn.com/f86865f571fe910ef12df87d.webp)
大鼠水合氯醛麻醉心得本人所做的模型需要使用水合氯醛麻醉,所使用的是医院里配制的用于儿科灌肠的10%水合氯醛。
在先前的实验中,剂量为0.3mL/100g(这个剂量来自于师姐使用的经验),麻醉完全清醒时间约4h(当初没有记录开始清醒的时间)现在由于实验方案有所改动,希望麻醉的时间尽量缩短(1~1.5h),而麻醉深度保持不变,这样在侧脑室注射操作后,大鼠能够尽快的恢复清醒状态,便于后续的实验操作。
因此,对水合氯醛麻醉的剂量与药效进行了摸索,我把它贴出来,跟大家分享一下。
动物:雄性SD大鼠4只,平均体重356g(这里就不算标准差了),水合氯醛浓度分为4%、7%、10%三个水平。
结果:如下表格所示:水合氯醛浓度 4% 7% 7% 10% 10%水合氯醛剂量 0.5mL/100g 0.3mL/100g 0.2mL/100g 0.2 mL/100g 0.3 mL/100g诱导时间约7min 约4min 约7min 约4min 约4min麻醉深度浅麻醉水平中度麻醉浅麻醉深度麻醉深度麻醉麻醉开始清醒时间约90min 约100min 未观察约68min 114min 结论:1、麻醉的诱导,似乎从4%到(7%、10%),随着浓度的增加,麻醉诱导的时间缩短。
但在7%及10%这两个浓度,麻醉时间基本一致。
2、麻醉时间的长度与水合氯醛的总剂量可能成正相关。
3、麻醉的深度跟与水合氯醛的浓度可能成正相关在之前甲醛《做动物实验前必须给予阿托品吗?》的这篇中,有战友提出“把水合氯醛配成4%的,而不是10%的,这样就拉开了麻醉剂量和致死剂量之间的差距,可安全了”,我的经验是这样:(1)确实,4%的水合氯醛在实验中比较安全,我们一般用于追加麻醉的时候,4%水合氯醛每次1mL,追加一到两次,安全度颇高。
(2)而水合氯醛的致死剂量,我不是很了解,希望知道的战友能够告知一声。
对于10%的水合氯醛,我们用到0.3mL/100g也很安全,应该距离致死剂量还有一段距离,麻醉深度与维持时间也很确切。


1.大鼠PASMCs的提取和原代培养(1)提取:对雄性SD大鼠用5%的水合氯醛经腹腔麻醉后,浸泡在75%的乙醇中5 rain。
将麻醉后的大鼠在超净工作台中固定好,无菌操作下迅速分离出心肺组织,置于盛有含有1%青链霉素的PBS培养皿中。
转移至无菌操作台中,漂洗心肺组织数次,眼科镊仔细剥离出肺动脉(包括肺动脉主干和左右肺动脉干)。
将已分离出的肺动脉用含1%青链霉素的HBSS冲洗数次,直至液体清亮为止,以尽量减少血细胞等的混入。
眼科剪纵向剪开肺动脉,内膜面朝上,用刀片来回轻刮2~3遍,去除内膜。
再将外膜面翻转过来,同样方法刮去外膜。
将中膜转移至盛有含20%胎牛血清的DMEM/F12的培养基中,用眼科剪反复剪成1 am×l mm×1 mm 的小组织块。
用滴管将小组织块转移至25T的培养瓶中,均匀的摆放与于瓶底,间距约0.5 cm。
加入3 mL含20%胎牛血清的DMEM/F12培养液,瓶底朝上,静置于37 oC、5%CO,的细胞培养箱巾孵育4~5 h。
待小组织块干涸后,轻翻转培养瓶,让培养液慢慢浸润瓶底上的小组织块,继续静置于培养箱中培养。
(2)原代培养:3—5 d后,有少量细胞从组织块周围游离出来;8—10 d后细胞融合成片,成峰.谷状分布,用胰酶消化传代。
一般2—3 d更换培养液,提取PASMCs 时用含20%胎牛血清的DMEM/F12,培养时用含15%胎牛血清的DMEM/F12。
采用生长状态良好的3~5代细胞进行后续实验。
取材、细胞原代及传代培养SD 大鼠肌注氯胺酮(22 mg / kg)麻醉后,作下腹部横切口,切取双侧输精管。
剥去外膜组织,小圆刀片刮除内膜,4 C PBS缓冲液(含青霉素100 U/ mI、链霉素100#g / mI)反复漂洗4 ~ 6遍,然后剪碎成1 mm3 大小的组织块。
先用0.1%的"型胶原酶消化作用10 min,倒去上清液,再加0.2% 的胰蛋白酶和0.1%的"型胶原酶消化20 min,使游离成单个细胞,600 > ! 离心5 min,收集消化的细胞,接种至25 cm2 培养瓶,加含20%胎牛血清的DMEM 培养液,置37 C含5%CO2孵箱中培养。
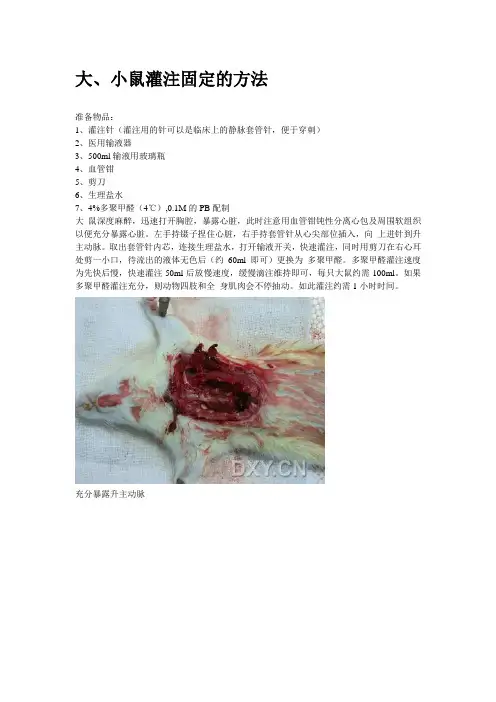
大、小鼠灌注固定的方法准备物品:1、灌注针(灌注用的针可以是临床上的静脉套管针,便于穿刺)2、医用输液器3、500ml输液用玻璃瓶4、血管钳5、剪刀6、生理盐水7、4%多聚甲醛(4℃),0.1M的PB配制大鼠深度麻醉,迅速打开胸腔,暴露心脏,此时注意用血管钳钝性分离心包及周围软组织以便充分暴露心脏。
左手持镊子捏住心脏,右手持套管针从心尖部位插入,向上进针到升主动脉。
取出套管针内芯,连接生理盐水,打开输液开关,快速灌注,同时用剪刀在右心耳处剪一小口,待流出的液体无色后(约60ml即可)更换为多聚甲醛。
多聚甲醛灌注速度为先快后慢,快速灌注50ml后放慢速度,缓慢滴注维持即可,每只大鼠约需100ml。
如果多聚甲醛灌注充分,则动物四肢和全身肌肉会不停抽动。
如此灌注约需1小时时间。
充分暴露升主动脉套管针从心尖部位插入,向上进针到升主动脉1、暴露心脏时要小心,速度要快,但不可损伤心脏及大血管,如果出现血液凝固或大血管损伤,灌流将失败。
2、最好是剖开右心室,但是因为暴露的问题,有误剪到左心室的可能。
相对来说,剪开右心耳更为方便。
我们就是这样做的。
3、灌流的效果:PBS或NS灌流时,血流丰富的脏器如肝脾肾等的颜色会迅速转为灰白,此为灌流正常。
另外,大鼠耳尖,口唇,四肢掌部也会变苍白。
4、PBS或NS灌流需缓慢而持续,防止血液血管内凝固。
有条件的话可加点肝素。
5、先主动脉插管,再右心耳放血,这样插管容易些。
先剪右心耳的话,心脏会瘪下去的。
小鼠灌注固定方法:采用水合氯醛麻醉后剪开胸腔,动作要快,经左心室插入头皮针连接的20 mL注射器(头皮针磨钝,从与身体纵轴成45°角的方向进针,针尖插入升主动脉内,可以看见,动作要轻柔),同时剪开右心耳,推入20 mL 生理盐水。
推完以后迅速换4 ℃多聚甲醛20 mL,灌完以后取材基本就可以了。


几种常见疾病的造模方法1.血管性痴呆大鼠模型动物选取选用健康Ⅱ级SD雄性大鼠,体重280- 320 g,动物于安静环境下分笼饲养,室温控制在(22士1)℃的范围内,相对湿度60%,光线自动控制,明(07: 00- 19: 00)暗(19: 00-07)交替,给予充足清洁饮水、摄食。
处理大鼠10%水合氯醛腹腔注射(1 g/ kg)麻醉后,将其仰卧固定。
分离右颈总动脉(CCA),颈内动脉(ICA)及颈外动脉(ECA)并挂线备用,结扎ECA与CCA,用动脉夹夹闭ICA远心端后,迅速于ECA与ICA分义处作一切切口,从切口处插入一端加热成光滑球形尼龙线(直径为0. 25 mm,距球端2cm处作标记)。
线插入ICA后,于入日处稍稍结扎尼龙线与入口处ICA段,然后松开夹闭ICA的动脉夹,继续插入尼龙线至稍有阻力后略回撤,至线插入深度为(18. 5士0. 5)mm左右,实现大脑中动脉阻塞导致脑缺血。
再次结扎入口处,尼龙线外留约1缝合皮肤。
2h后轻轻提拉所留线头至有阻力,实现大脑中动脉再灌,则造模完成。
纳入动物入选的标准(按照Zea Longa 5级评分法取评分为2,3,4分的动物,动物于缺血2h后出现对侧前肢倦曲或行走转圈或行走向对侧倒体征则纳入,动物无此体征或于缺血2h后仍不清醒者弃去。
2.大鼠酒精性肝病模型取材体重125- 155g雄性SD大鼠,环境温度18℃一20 0C,湿度70%左右,自由采食全价营养颗粒饲料,垫料为紫外线消毒后的卫生纸。
将酒精体积分数为0. 52的红星二锅头自酒(北京酿酒总厂生产),按体积比分别稀释成400Io .450Io .500Io ( v/ v)备用。
处理按每周所测得的体重给子每日早晚白酒灌胃各1次。
第1周将稀释成40%的白酒按剂量4g/(kg.d)、每次0. 5m1/ 100g灌胃,第2周按剂量8g/(kg.d)、每次1. 0ml/ 100g,灌胃,第5周开始将稀释成45%的自酒按9g/(kg.d),每次1. 0m1/ 100g灌胃,第9周将稀释成50%的白酒按10g/(kg.d)、每次1. 0m1/ 100g灌胃,第11周起改用自由饮酒至第12周,以浓度50%白酒作为主要饮料,日供给量40ml,同时限制饮水。

大鼠放射性脑损伤磁共振成像的初步研究孙晨;王凡;王鹏;吴黎明【摘要】Objective Study gamma knife radiosurgcry (Gamma knife) after irradiation of rat caudate nucleus imaging findings of radiation injury and cytoiogical changes. Methods 10 adult male Wistar rats were were enrolled into the study. Five rats served as controlled group while the other five rats underwent Gamma knife. The right caudatc-pu-tamen nucleus was selected as the target of irradiation. A 8 mm collimator was used to transmit 50 Gy to the target region. 3 months after irradiation, the rats were killed and accept the 1. 5 T MRI axial unenhanced and enhanced scans take brain tissue after HE staining cytological changes. Results MRI prompted the first 12 weeks after irradiation can be found in the exposed rat caudate nucleus T2WI to the the visible exposed area signal increased,enhanced the visible exposed area T1WI marked enhancement. The light microscope showed gliosis. Conclusion MRI for gamma knife of radioactive brain injury diagnosis has important clinnical significance.%目的研究伽玛刀(Gamma knife)照射大鼠尾状核后放射性损伤的影像学表现及细胞学变化.方法 10只成年SD大鼠,5只大鼠作为对照组,5只大鼠接受MASEP-SRRS型伽玛刀8 mm准直器以50 Gy(50%等剂量线)照射大鼠右侧尾状核.照射后3个月,大鼠处死前接受1.5 T MRI轴位平扫和增强扫描,后取脑组织行HE染色观察细胞学变化.结果 MRI提示照射后第12周可发现受照大鼠尾状核T2相可见受照区信号增高,增强T1相可见受照区强化明显,并且光镜下可见胶质细胞增生.结论 MRI对于伽马刀所致的放射性脑损伤诊断有重要临床意义.【期刊名称】《中国实验诊断学》【年(卷),期】2013(017)003【总页数】4页(P449-452)【关键词】伽马刀;放射性脑损伤;磁共振成像【作者】孙晨;王凡;王鹏;吴黎明【作者单位】安徽医科大学第一附属医院,肿瘤放疗科,安徽,合肥230022;安徽医科大学第一附属医院,肿瘤放疗科,安徽,合肥230022;安徽医科大学第一附属医院,肿瘤放疗科,安徽,合肥230022;安徽医科大学第一附属医院,肿瘤放疗科,安徽,合肥230022【正文语种】中文【中图分类】R818.74随着头颈部肿瘤放射治疗技术的日渐广泛,放射性脑损伤的发病率也逐渐增加,现已成为限制脑部放射治疗剂量,影响疗效的重要因素。

大鼠水合氯醛麻醉心得集团标准化小组:[VVOPPT-JOPP28-JPPTL98-LOPPNN]大鼠水合氯醛麻醉心得本人所做的模型需要使用水合氯醛麻醉,所使用的是医院里配制的用于儿科灌肠的10%水合氯醛。
在先前的实验中,剂量为0.3mL/100g(这个剂量来自于师姐使用的经验),麻醉完全清醒时间约4h(当初没有记录开始清醒的时间)现在由于实验方案有所改动,希望麻醉的时间尽量缩短(1~1.5h),而麻醉深度保持不变,这样在侧脑室注射操作后,大鼠能够尽快的恢复清醒状态,便于后续的实验操作。
因此,对水合氯醛麻醉的剂量与药效进行了摸索,我把它贴出来,跟大家分享一下。
动物:雄性SD大鼠4只,平均体重356g(这里就不算标准差了),水合氯醛浓度分为4%、7%、10%三个水平。
结果:如下表格所示:水合氯醛浓度4%7%7%10%10%水合氯醛剂量0.5mL/100g0.3mL/100g0.2mL/100g0.2mL/100g0.3mL/100g诱导时间约7min约4min约7min约4min约4min麻醉深度浅麻醉水平中度麻醉浅麻醉深度麻醉深度麻醉麻醉开始清醒时间约90min约100min未观察约68min114min结论:1、麻醉的诱导,似乎从4%到(7%、10%),随着浓度的增加,麻醉诱导的时间缩短。
但在7%及10%这两个浓度,麻醉时间基本一致。
2、麻醉时间的长度与水合氯醛的总剂量可能成正相关。
3、麻醉的深度跟与水合氯醛的浓度可能成正相关在之前甲醛《做动物实验前必须给予阿托品吗》的这篇中,有战友提出“把水合氯醛配成4%的,而不是10%的,这样就拉开了麻醉剂量和致死剂量之间的差距,可安全了”,我的经验是这样:(1)确实,4%的水合氯醛在实验中比较安全,我们一般用于追加麻醉的时候,4%水合氯醛每次1mL,追加一到两次,安全度颇高。
(2)而水合氯醛的致死剂量,我不是很了解,希望知道的战友能够告知一声。
对于10%的水合氯醛,我们用到0.3mL/100g也很安全,应该距离致死剂量还有一段距离,麻醉深度与维持时间也很确切。

一、SD大鼠的麻醉1、SD大鼠腹腔麻醉把异氟烷和脂肪乳混合做成乳化异氟烷,腹腔注射,3分钟麻醉,30分钟清醒。
乳化异氟烷制备:用30%的脂肪乳为载体,在室温下(20℃)应用玻璃瓶法,配制成8%的乳化异氟烷。
即将1.2ml的液态异氟烷和21.3ml的30%脂肪乳加入至一个气密性良好的25~30ml玻璃容器内,在振荡器上以2000r/min的速度剧烈震荡30s,静置30s,然后再以2000r/min速度剧烈震荡50min,达到平衡后放置于4℃冰箱保存备用。
乳化异氟烷,大鼠腹腔注射的半数有效量(ED50)相当于液态异氟烷0.51~0.64ml/kg,半数致死量(LD50)相当于液态异氟烷1.10~1.46ml/kg,治疗指数(TI)为2.24。
致死量大鼠表现为呼吸抑制、心律失常,继而心跳停止。
病理解剖显示腹腔注射乳化异氟烷不会引起心、肺、肝、肠系膜的病理改变。
2、SD大鼠吸入麻醉可以作一个小金鱼缸(四方形)算出体积,钻个眼用橡皮塞塞住,老鼠装进去封住缸口,从橡皮塞插上注射器给液态吸入麻醉药(如1ml异氟烷可挥发成196ml的气体),算出需要的浓度就会算出需要的液态麻醉药量,一般一个MAC 就够了,老鼠的异氟烷MAC大约是2%。
3、SD大鼠经口气管插管腹腔麻醉,四肢仰面固定,上下切牙用丝线系住作牵引,操作者头戴额镜(五官科检查耳朵用的),对面放置好光源(一个射灯),牵出舌头和下切牙丝线一起由左手捏住,上切牙丝线由助手提着或用止血钳夹住用自己的前胸固定,拉动丝线使头部上提和口充分张开,右手持18G或16G套管针(戴芯但不超过管口),看到声门(鱼口状)既可插管。
二、异氟醚大鼠麻醉安全且具有麻醉科特色。
我们是用异氟醚(应该是国产的吧)麻醉的,用那种市面上常见的可以提的比较大的带盖塑料水杯自制一个封闭的小麻醉空间,水杯是那种直桶透明,盖子类似特百惠按盖,上有一个约2cm饮水孔的那种,用一个合适的注射器前端堵住饮水孔。
不同浓度水合氯醛对大鼠的麻醉作用比较李少春;马丽娜;李峰杰;郝伟;赵乐;李贻奎【期刊名称】《中国药业》【年(卷),期】2014(000)019【摘要】目的:比较水合氯醛浓度对青、老年大鼠的麻醉作用。
方法采用固定水合氯醛给药量的方法,分别设青、老年大鼠高、低浓度组,进行腹腔注射水合氯醛麻醉,观察麻醉诱导时间、深度麻醉开始时间、深度麻醉持续时间和麻醉持续时间。
结果不同浓度水合氯醛对老年大鼠的诱导麻醉时间和深度麻醉开始时间之间无明显差异( P>0.05);而深度麻醉时间和麻醉持续时间高浓度组长于低浓度组;对于青年大鼠,诱导麻醉时间和麻醉持续时间组间无显著差异,而深度麻醉开始时间和深麻持续时间低浓度组短于高浓度组。
结论水合氯醛对老年大鼠和青年大鼠麻醉的剂量不同,同等剂量下不同浓度的水合氯醛对大鼠麻醉效应也不相同。
%Objective To compare the anesthetic effects of various concentrations of chloral hydrate on young and aged rats. Methods The young and aged rats were divided into the low concentration group and the high concentration group by adopting the fixed dose of chloral hydrate. Then the rats were administered of chloral hydrate by intraperitoneal injection respectively and the induction time, start time of deep anesthesia, duration of deep anesthesia and duration of total anesthetic period were observed. Results The different con-centrations of chloral hydrate in the aged rats had no statistically significant difference between the induction time and the start time of deep anesthesia ( P>0.05 );while the duration of deep anesthesia and the duration of total anesthetic period in the high concentration group showed significantly longer compared with the low concentration group;in young rats, the induction time and the duration of total anesthetic period had no statistical significant difference between the low concentration group and the high concentration group, but the start time of deep anesthesia and the duration of surgical anesthesia in the low concentration group were shorter than those in the high concentration group. Conclusion The dose of chloral hydrate is different in anesthesia of aged and young rats and the different concen-trations of chloral hydrate under the same dosage induce different anesthetic effect.【总页数】2页(P22-23)【作者】李少春;马丽娜;李峰杰;郝伟;赵乐;李贻奎【作者单位】中国中医科学院西苑医院基础医学研究所,北京 100091; 河北大学基础医学院,河北保定 071000;中国中医科学院西苑医院基础医学研究所,北京100091; 北京中医药大学,北京 100029;中国中医科学院西苑医院基础医学研究所,北京 100091;中国中医科学院西苑医院基础医学研究所,北京 100091;中国中医科学院西苑医院基础医学研究所,北京 100091;中国中医科学院西苑医院基础医学研究所,北京 100091【正文语种】中文【中图分类】R965;R971+.2【相关文献】1.10%水合氯醛与2%戊巴比妥钠在建立术后疲劳综合征大鼠模型中的麻醉效果比较 [J], 陈红燕;庞凤舜;陈经宝;冼敏玲;杨艳婷;胡琼;秦有2.丙泊酚与水合氯醛对亚低温大鼠海马神经元凋亡的影响比较 [J], 何亚;刘晓颖;邓庆华;郑小红;蒋红艳;苏爱淇3.水合氯醛和戊巴比妥钠对SD大鼠麻醉效果的比较 [J], 李志勇;孙建宁;张硕峰4.吸入异氟烷与腹腔注射水合氯醛对大鼠骨癌痛模型建立的影响比较 [J], 朱恒舟;李文婷;吴勉华5.不同剂量10%水合氯醛在构建大鼠脊髓半切模型中的麻醉效果比较 [J], 赵兴昌;宋世强;唐毓金;刘佳因版权原因,仅展示原文概要,查看原文内容请购买。
大鼠原代星状细胞提取方法一、原位灌注:1、1ml 5%水合氯醛麻醉大鼠,腹壁酒精消毒,十字切口打开腹腔,用湿棉签将肠管推向左侧,暴露门静脉和下腔静脉。
2、将充满灌流液的针(0.45或0.55的头皮静脉针)经小口插入门静脉(不要插的过深),止血夹或线结扎,软管部分用纸胶布固定以免滑脱。
3、灌注I液灌注在肝脏迅速发白后剪断下腔静脉,肝脏在全部灌注完后可见白色纹理。
可以注射器灌注,也可以使用专门的大鼠灌注器。
先灌注I液:5min\37度\8ml/min。
可稍快再灌注II液:10min\37度\5ml/min。
一定要慢,防止门静脉破掉二、梯度离心:1、灌流结束后,将取适量(直径不超过5cm)肝脏移至无菌培养皿中(镊子泡过酒精,尽量把血管和胆管、胆囊留下),移至超净台,加入少量(5ml左右)灌注II液,剪碎肝组织(2mm,尽可能碎),剔除其他组织。
2、将搅碎的肝组织倒入50ml的离心管,加入灌注II液至30ml,加入12mg pronase 和0.6mg DNase,37度水浴消化12~15min,消化过程中每2~3min拿出来轻轻震荡或摇晃。
3、加入15ml 4°C含10%FBS的DMEM终止消化。
4、70um过滤网过滤:用无菌镊子夹出过滤网,放入10CM无菌培养皿中,将液体用枪打入,有较多沉淀时用1ml无菌注射器尾部粗糙不平部位去研磨,留下的都是一些血管等白色物质后即可停止。
5、将过滤后的液体转移至50ml离心管中,静置10min,肝细胞较重沉淀下来,收集悬浮液转移到新离心管中,400g,7min,使所有细胞都沉下去。
6、吸掉悬浮液,加入4~5ml 15%optiprep液,重悬后转移至15ml离心管(注意不要滴到壁上),缓慢倾斜至与水平面夹角30度,缓慢加入5ml 11.5%optiprep(枪头竖直指向离心管口附近,使液体缓慢流进去),同法再加5ml HBSS溶液。
加完后慢慢竖直可见三种液体明显分层,记住11.5%optiprep与HBSS溶液的分层处。
大鼠水合氯醛麻醉心得本人所做的模型需要使用水合氯醛麻醉,所使用的是医院里配制的用于儿科灌肠的10%水合氯醛。
在先前的实验中,剂量为0.3mL/100g(这个剂量来自于师姐使用的经验),麻醉完全清醒时间约4h(当初没有记录开始清醒的时间)现在由于实验方案有所改动,希望麻醉的时间尽量缩短(1~1.5h),而麻醉深度保持不变,这样在侧脑室注射操作后,大鼠能够尽快的恢复清醒状态,便于后续的实验操作。
因此,对水合氯醛麻醉的剂量与药效进行了摸索,我把它贴出来,跟大家分享一下。
动物:雄性SD大鼠4只,平均体重356g(这里就不算标准差了),水合氯醛浓度分为4%、7%、10%三个水平。
结果:如下表格所示:水合氯醛浓度 4% 7% 7% 10% 10%水合氯醛剂量 0.5mL/100g 0.3mL/100g 0.2mL/100g 0.2 mL/100g 0.3 mL/100g诱导时间约7min 约4min 约7min 约4min 约4min麻醉深度浅麻醉水平中度麻醉浅麻醉深度麻醉深度麻醉麻醉开始清醒时间约90min 约100min 未观察约68min 114min 结论:1、麻醉的诱导,似乎从4%到(7%、10%),随着浓度的增加,麻醉诱导的时间缩短。
但在7%及10%这两个浓度,麻醉时间基本一致。
2、麻醉时间的长度与水合氯醛的总剂量可能成正相关。
3、麻醉的深度跟与水合氯醛的浓度可能成正相关在之前甲醛《做动物实验前必须给予阿托品吗?》的这篇中,有战友提出“把水合氯醛配成4%的,而不是10%的,这样就拉开了麻醉剂量和致死剂量之间的差距,可安全了”,我的经验是这样:(1)确实,4%的水合氯醛在实验中比较安全,我们一般用于追加麻醉的时候,4%水合氯醛每次1mL,追加一到两次,安全度颇高。
(2)而水合氯醛的致死剂量,我不是很了解,希望知道的战友能够告知一声。
对于10%的水合氯醛,我们用到0.3mL/100g也很安全,应该距离致死剂量还有一段距离,麻醉深度与维持时间也很确切。
大鼠灌注取脑用途:1.用于常规HE染色,免疫组化分析。
2。
冰冻切片可以不做脑组织固定。
3.不可用于western blot和PCR.4。
如果观察脑组织的缺血、损伤或其它病变时,不作灌注固定,而是在取出脑组织后作固定,将大大影响效果.原理:心脏灌流术能够快速冲净血液并在动物死亡前进行组织的前固定,避免了组织的自溶现象,是脑组织切片观察的常用方法.多聚甲醛使组织蛋白发生交联,以保持蛋白的原位和表面结构不变,从而能使其对应的抗体准确检测其表达位置和量。
必要性:1.脑组织较软,且细胞成分不易保留,脑组织是较易软化的组织之一,血供也较为丰富,所以最好是在取脑组织前用4%多聚甲醛灌注固。
2.经前固定后,取脑操作时,可减少脑组织损伤.3.脑内血液都在,HE染色后,可去除红细胞背景影响.大鼠灌注取脑标准操作规程(SOP):流程:1)麻醉 2)开胸 3)心脏左心室穿针,剪开右心耳 4)生理盐水冲水 5)4%多基甲醛固定 6)取脑 7)保存或切片。
具体过程:大鼠经深度麻醉后,固定于自制的手术木板上,置于解剖盘中,开胸暴露并游离出心脏,经左心室插入灌流针并固定, 切开右心耳,先灌注冰冻无菌生理盐水(4℃)XmL,直到肝和肺脏颜色转白及右心房流出液澄清,后再灌注冰冻(4℃)4%多聚甲醛XmL,断头取脑,多聚甲醛浸泡固定24小时。
Tips:1。
多聚甲醛的配置:一般方法为:4%多聚甲醛PBS缓冲液配法:称取40g PFA溶于装有500mlDEPC水的玻璃容器(烧杯或烧瓶)中,持续加热磁力搅拌至60~65℃,使成乳白色悬液。
用1。
0mol/L的NaOH 值至7.4,使呈清亮状(滴加),再加入约500ml PBS,充分混匀(在冰浴或冷水浴中),可再检测一下pH,过滤后定容至1000ml,室温或4℃保存备用。
简便方法:先配好PBS,称好相应的多聚甲醛,37℃水浴或温箱密封放置2天,就能全溶。
若是很急,55℃水浴一天,期间不时震荡。
大鼠灌注取脑用途:1.用于常规HE染色,免疫组化分析。
2.冰冻切片可以不做脑组织固定。
3.不可用于western blot和PCR。
4.如果观察脑组织的缺血、损伤或其它病变时,不作灌注固定,而是在取出脑组织后作固定,将大大影响效果。
原理:心脏灌流术能够快速冲净血液并在动物死亡前进行组织的前固定,避免了组织的自溶现象,是脑组织切片观察的常用方法。
多聚甲醛使组织蛋白发生交联,以保持蛋白的原位和表面结构不变,从而能使其对应的抗体准确检测其表达位置和量。
必要性:1.脑组织较软,且细胞成分不易保留,脑组织是较易软化的组织之一,血供也较为丰富,所以最好是在取脑组织前用4%多聚甲醛灌注固。
2.经前固定后,取脑操作时,可减少脑组织损伤。
3.脑内血液都在,HE染色后,可去除红细胞背景影响。
大鼠灌注取脑标准操作规程(SOP):流程:1)麻醉2)开胸3)心脏左心室穿针,剪开右心耳4)生理盐水冲水5)4%多基甲醛固定6)取脑7)保存或切片.具体过程:大鼠经深度麻醉后,固定于自制的手术木板上,置于解剖盘中,开胸暴露并游离出心脏,经左心室插入灌流针并固定, 切开右心耳,先灌注冰冻无菌生理盐水(4℃)XmL,直到肝和肺脏颜色转白及右心房流出液澄清,后再灌注冰冻(4℃)4%多聚甲醛XmL,断头取脑,多聚甲醛浸泡固定24小时。
Tips:1.多聚甲醛的配置:一般方法为:4%多聚甲醛PBS缓冲液配法:称取40g PFA溶于装有500mlDEPC水的玻璃容器(烧杯或烧瓶)中,持续加热磁力搅拌至60~65℃,使成乳白色悬液。
用1.0mol/L的NaOH 值至7.4,使呈清亮状(滴加),再加入约500ml PBS,充分混匀(在冰浴或冷水浴中),可再检测一下pH,过滤后定容至1000ml,室温或4℃保存备用。
简便方法:先配好PBS,称好相应的多聚甲醛,37℃水浴或温箱密封放置2天,就能全溶。
若是很急,55℃水浴一天,期间不时震荡。
注意,4%的多聚甲醛需临用前配制,配制后需过滤去除小的杂质,避免心脏灌流时造成栓塞影响灌流效果。
大鼠脑损伤模型制作的具体方法及步骤(1)复制方法健康雄性大鼠,体重为230~260g。
采用改进的Feeney自由落体硬膜外撞击方法。
损伤装置由底板、固定支架、垂直导杆、下落击锤和聚乙烯撞击圆锥组成。
撞击圆锥头端直径为4mm、高为2.5mm。
经腹腔注射水合氯醛(按350~400mg/kg 体重的剂量)或戊丨巴丨比丨妥丨钠(按50~60mg/kg体重的剂量)麻醉。
将其头部固定于立体定向仪上,剪去顶部毛发,手术区域皮肤消毒。
沿中线左侧切开头皮,分离骨膜,用牙科钻于中线旁2mm、紧挨冠状缝后开一直径5mm的圆形窗,硬膜保持完整。
用20g砝码于10cm和30cm高处通过一金属导杆坠落,撞击置于硬膜上的圆锥上致轻、中型损伤,另用40g砝码于25cm高处坠落致重型损伤。
轻、中、重三型损伤的致伤冲击力分别为200g·cm、600g·cm和1000g·cm,用锌汀粉封闭骨窗,缝合头皮,置鼠笼喂养。
(2)检测指标1)脑含水量测定动物断头处死后,30s内取出大脑,用滤纸吸尽脑表面血丨渍后,锐性分离左侧顶叶皮质约100mg,用电子分析天平称湿重后,置于110℃恒温干燥箱内烤干(24h),称干重。
用Elliot公式计算各部位脑含水量百分率:脑含水量(%)=[(湿重-干重)/湿重]×比率2)血脑屏障定量测定动物于损伤前1h注射2%伊文斯蓝(3ml/kg体重)。
在取脑组织前,为清除血液中染料,可用生理盐水经左心室灌注至右心室流出清亮液体为止。
取损伤侧皮质分别称重,加入二倍体积的二甲基甲酰胺,50℃水浴中孵育72h,1500g离心,离心10min,取上清液。
应用分光光度计在伊文斯蓝大吸收光谱635mm处检测吸光度,从标准曲线上查得伊文斯蓝含量,结果以μg/g脑组织表示。
3)病理学观察损伤后24h再次麻醉,经升主动脉快速灌注生理盐水150ml,继之快速灌注冰冷的4%多聚甲醛200ml,随后再用其300ml在2h内慢速灌注,取脑组织浸入4%多聚甲醛内4℃后固定48h,常规乙醇脱水,石蜡包埋,行5μm冠状切片,作HE 染色及尼氏小体染色,光镜下观察。