仪器分析-原子吸收光谱的产生及谱线轮廓
- 格式:pdf
- 大小:357.93 KB
- 文档页数:8




原子吸收光谱分析4。
2.1 概述4。
2。
1。
1 基本概念1)原子光谱根据原子外层电子跃迁所产生的光谱进行分析的方法,称为原子光谱法,包括原子发射光谱法、原子吸收光谱法和原子荧光光谱法。
本章重点介绍应用广泛的原子吸收光谱法。
2)原子吸收光谱原子吸收光谱法,又称原子吸收分光光度法或简称原子吸收法,它是基于测量试样所产生的原子蒸气中基态原子对其特征谱线的吸收,从而定量测定化学元素的方法.4。
2.1。
2 仪器结构和过程图4-21 原子吸收示意图如上图,含Pb溶液将经过预处理-喷射成雾状进人燃烧火焰中,Pb化合物雾滴在火焰温度下,挥发并离解成Pb原子蒸气。
用Pb空心阴极灯作光源,产生Pb的特征谱线,通过Pb原子蒸气时,由于蒸气中基态Pb原子的吸收,Pb的特征谱线强度减弱,通过单色器和检测器测得其减弱程度,即可计算出溶液中Pb的含量。
4。
2。
1。
3 方法特点灵敏度高,10—9g/ml-10—12g/ml。
选择性好,准确度高。
单一元素特征谱线测定,多数情况无干扰。
测量范围广.测定70多种元素。
操作简便,分析速度快。
4。
2.2 原子吸收法基本原理 4。
2。
2.1 共振线和吸收线 1) 基本概念➢ 共振线电子从基态跃迁到能量最低的激发态(称为第一激发态),为共振跃迁,所产生的谱线称为共振吸收线(简称共振线).当电子从第一激发态跃回基态时,则发射出同样频率的谱线,称为共振发射线(也简称共振线)。
对大多数元素来说,共振线是指元素所有谱线中最灵敏的线。
➢ 特征谱线各种元素的原子结构和外层电子排布不同.不同元素的原子从基态激发至第一激发态(或由第一激发态跃回基态)时,吸收(或发射)的能量不同,因此各种元素的共振线不同而有其特征性,这种共振线称为元素的特征谱线。
2) 朗伯原理图4-22 原子吸收法的朗伯定律示意图原理公式:b K e I I νν-=0νK :吸收系数;ν:频率。
吸收线图4-23 吸收线轮廓图 图4—24 吸收线半宽度比较上述两个图,注意图的纵坐标参量的不同。

原子吸收光谱分析基本要点:1. 了解影响原子吸收谱线轮廓的因素;2. 理解火焰原子化和高温石墨炉原子化法的基本过程;3. 了解原子吸收分光光度计主要部件及类型;4. 了解原子吸收分光光度法干扰及其抑制方法;5. 掌握原子吸收分光光度法的定量分析方法及实验条件选择原则。
第一节原子吸收光谱分析概述一、原子吸收光谱分析定义:根据物质产生的原子蒸气中待测元素的基态原子对光源特征辐射谱线吸收程度进行定量的分析方法。
二、原子吸收光谱分析的特点:( 1 )灵敏度高:其检出限可达 10 -9 g /ml ( 某些元素可更高 ) ;( 2 )选择性好:分析不同元素时,选用不同元素灯,提高分析的选择性;( 3 )具有较高的精密度和准确度:试样处理简单。
第二节原子吸收光谱分析基本原理一、原子吸收光谱的产生及共振线在一般情况下,原子处于能量最低状态(最稳定态),称为基态(E 0 = 0)。
当原子吸收外界能量被激发时,其最外层电子可能跃迁到较高的不同能级上,原子的这种运动状态称为激发态。
处于激发电磁波的形式放出能量:共振发射线:电子从基态跃迁到能量最低的激发态时要吸收一定频率的光,它再跃迁回基态时,则发射出同样频率的光(谱线),这种谱线称为共振发射线。
共振吸收线:电子从基态跃迁至第一激发态所产生的吸收谱线称为共振吸收线。
共振线:共振发射线和共振吸收线都简称为共振线。
各种元素的原子结构和外层电子排布不同,不同元素的原子从基态激发至第一激发态(或由第一激发态跃迁返回基态)时,吸收(或发射)的能量不同,因而各种元素的共振线不同而各有其特征性,所以这种共振线是元素的特征谱线。
二、谱线轮廓与谱线变宽式中:Kn ——基态原子对频率为的光的吸收系数,它是光源辐射频率的n函数由于外界条件及本身的影响,造成对原子吸收的微扰,使其吸收不可能仅仅对应于一条细线,即原子吸收线并不是一条严格的几何线(单色l ),而是具有一定的宽度、轮廓,即透射光的强度表现为一个相似于图8-3的频率分布, 若用原子吸收系数Kn随n变化的关系作图得到吸收系数轮廓图:(二)谱线变宽引起谱线变宽的主要因素有:1. 自然宽度:在无外界影响下,谱线仍有一定宽度,这种宽度称为自然宽度,以ΔvN 表示。

第七章原子吸收光谱法1.原子吸收光谱的历史2.原子吸收光谱的特点3.原子吸收光谱与紫外可见吸收光谱的区别4.原子吸收光谱分析过程第一节概述1. 原子吸收光谱的历史◆1802年,沃拉斯顿(Wollaston)在研究太阳连续光谱时,首次发现太阳连续光谱中出现暗线。
◆1817年,夫琅和费(Fraunhofer)研究太阳连续光谱时再次发现这些暗线,但无法解释暗线产生的原因。
2/1363/1361825年,法国著名哲学家孔德在哲学讲义中说“恒星的化学组成是人类绝对不能得到的知识”◆1859年,本生、基尔霍夫研究碱金属和碱土金属火焰光谱时,发现钠蒸气发出的光通过温度较低的钠蒸气时,会引起钠光的吸收,并且钠在光谱中位置相同。
发射线与暗线D◆太阳光谱暗线:太阳外围大气圈中钠原子对太阳光谱中钠辐射特征波长光进行吸收的结果。
4/1365/136太阳中含有94种稳定和放射性元素:氢(71%)、氮(27%)、氧、碳、氖、硅、铁等。
◆1955年,澳大利亚物理学家Walsh(沃尔什)发表了著名论文《原子吸收光谱法在分析化学中的应用》,奠定了原子吸收光谱法的基础。
◆1960年以后,原子吸收光谱法得到迅速发展,成为微量、痕量金属元素的可靠分析方法。
6/1362. 原子吸收光谱法的特点✓检出限低:10-10~10-14g。
✓准确度高:1%~5%。
✓选择性好:一般情况下共存元素无干扰。
✓应用范围广:可测定70多种元素。
✗缺点:难熔元素、非金属元素测定困难,不能实现多元素同时分析。
7/1363. 原子吸收与紫外可见吸收的区别✓相同点:利用物质对辐射的吸收进行分析。
✗不同点:◆吸收机理不同:紫外可见为溶液中分子或离子宽带吸收,带宽为几纳米至几十纳米;原子吸收为气态基态原子的窄带吸收,带宽仅为10-3nm。
◆光源不同。
◆试样处理、实验方法及对仪器的要求不同。
8/1364. 原子吸收光谱分析过程◆确定待测元素。
◆选择该元素相应锐线光源,发射出特征谱线。

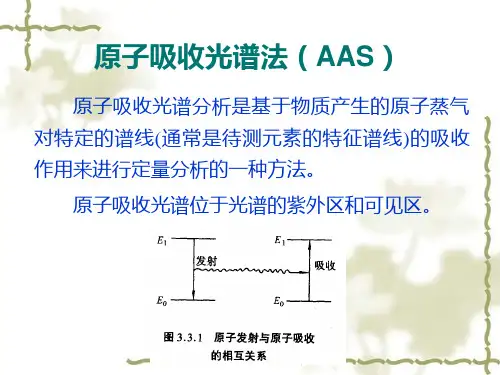
原子吸收光谱法原子吸收光谱(Atomic Absorption Spectroscopy,AAS),又称原子分光光度法,是基于待测元素的基态原子蒸汽对其特征谱线的吸收,由特征谱线的特征性和谱线被减弱的程度对待测元素进行定性定量分析的一种仪器分析的方法。
中文名原子吸收光谱法外文名Atomic Absorption Spectroscopy光线范围紫外光和可见光出现时间上世纪50年代简称AAS测定方法标准曲线法、标准加入法别名原子吸收分光光度法基本原理原子吸收光谱法(AAS)是利用气态原子可以吸收一定波长的光辐射,使原子中外层的电子从基态跃迁到激发态的现象而建立的。
由于各种原子中电子的能级不同,将有选择性地共振吸收一定波长的辐射光,这个共振吸收波长恰好等于该原子受激发后发射光谱的波长。
当光源发射的某一特征波长的光通过原子蒸气时,即入射辐射的频率等于原子中的电子由基态跃迁到较高能态(一般情况下都是第一激发态)所需要的能量频率时,原子中的外层电子将选择性地吸收其同种元素所发射的特征谱线,使入射光减弱。
特征谱线因吸收而减弱的程度称吸光度A,在线性范围内与被测元素的含量成正比:A=KC式中K为常数;C为试样浓度;K包含了所有的常数。
此式就是原子吸收光谱法进行定量分析的理论基础由于原子能级是量子化的,因此,在所有的情况下,原子对辐射的吸收都是有选择性的。
由于各元素的原子结构和外层电子的排布不同,元素从基态跃迁至第一激发态时吸收的能量不同,因而各元素的共振吸收线具有不同的特征。
由此可作为元素定性的依据,而吸收辐射的强度可作为定量的依据。
AAS现已成为无机元素定量分析应用最广泛的一种分析方法。
该法主要适用样品中微量及痕量组分分析。
原子吸收光谱法谱线轮廓原子吸收光谱线并不是严格几何意义上的线,而是占据着有限的相当窄的频率或波长范围,即有一定的宽度。
原子吸收光谱的轮廓以原子吸收谱线的中心波长和半宽度来表征。
中心波长由原子能级决定。