江苏省宜兴中学高中化学 1.2物质的转化学案(无答案)苏教版必修1
- 格式:doc
- 大小:71.64 KB
- 文档页数:4

《化学1》学案1—2 物质的转化编制:高一化学组贺天才使用班级:高一(3)、(4)、(5)班姓名:第小组【学习目标】1、理解单质、氧化物、酸、碱、盐等物质之间的相互转化关系。
2、从化合价升降的角度初步认识氧化还原反应。
【课前检测】1、请判断下列说法是否正确,正确请在括号内打“√”,错误的打“×”,并在直线上举出反例:(1)、非金属氧化物都是酸性氧化物()_________________(2)、酸性氧化物都是非金属氧化物()_________________(3)、金属氧化物都是碱性氧化物()___________________(4)、碱性氧化物都是金属氧化物()___________________(5)、酸性氧化物都能溶于水形成对应的酸()(6)、碱性氧化物都能溶于水形成对应的碱()2、请独立完成P4问题解决3、在稀硫酸、CO2、Cu、食盐、生石灰、CO、纯碱(Na2CO3)溶液、铁片和木炭粉(C)等9种物质间存在下面的相互关系,选择①~⑤中适当的物质,使有连线的两物质能发生反应。
(1)请推断它们的化学式分别为:①_________;②_________;③__________;④_________;⑤_________。
(2)写出下列序号之间的化学方程式,并标出该反应属于四种基本反应类型中的哪一种?①和②___________________________________,__________________;②和④___________________________________,__________________;_________________________________②和⑤_________________,;_③和④_________________________________,________________;【学习探究】1、请判断下列化学反应的反应类型①H2SO4 + 2NaOH = 2H2O + Na2SO4②H2 + CuO H2O + Cu③C + O 2 CO2④BaCl2 + CuSO4== CuCl2 + BaSO4↓⑤Na2O + H2O = 2NaOH ⑥CO + CuO Cu + CO2⑦2KClO3 2KCl + 3O2⑧CaCO 3CaO + CO2↑在上述反应中,属于化合反应的有(填编号),属于分解反应的有,属于复分解反应的信息提示:分类并没有唯一性,它会根据分类的标准不同而不同。
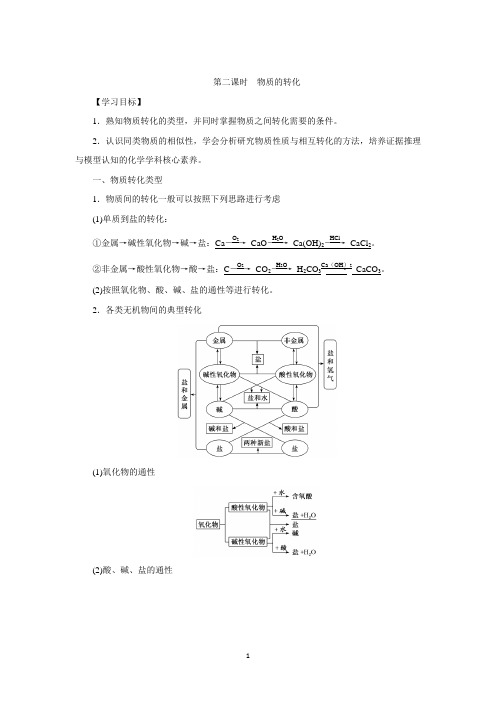
第二课时 物质的转化【学习目标】1.熟知物质转化的类型,并同时掌握物质之间转化需要的条件。
2.认识同类物质的相似性,学会分析研究物质性质与相互转化的方法,培养证据推理与模型认知的化学学科核心素养。
一、物质转化类型1.物质间的转化一般可以按照下列思路进行考虑(1)单质到盐的转化: ①金属→碱性氧化物→碱→盐:Ca ――→O 2 CaO ――→H 2O Ca(OH)2――→HClCaCl 2。
②非金属→酸性氧化物→酸→盐:C ――→O 2 CO 2――→H 2O H 2CO 3――→Ca (OH )2 CaCO 3。
(2)按照氧化物、酸、碱、盐的通性等进行转化。
2.各类无机物间的典型转化(1)氧化物的通性(2)酸、碱、盐的通性3.无机化合物转化为有机化合物1828年,德国化学家维勒用氰酸铵(NH 4CNO)合成了尿素,打破了无机化合物与有机化合物之间不可转化的观念,揭开了人工合成有机化合物的序幕。
【问题探讨】1.硫酸属于常见酸,可与哪些类别的物质反应?写出相应的化学方程式。
提示:(1)硫酸可与活泼金属反应,如Fe +H 2SO 4===FeSO 4+H 2↑;(2)硫酸与碱性氧化物反应,如CuO +H 2SO 4===CuSO 4+H 2O ;(3)硫酸与碱反应,如H 2SO 4+2NaOH===Na 2SO 4+2H 2O ;(4)硫酸与某些盐反应,如H 2SO 4+BaCl 2===2HCl +BaSO 4↓。
2.同类物质具有相似的性质,思考并讨论:酸、碱、盐的化学性质中涉及哪些反应类型?提示:(1)置换反应:酸与金属、盐与金属。
(2)复分解反应:碱性氧化物与酸、酸与碱、盐与酸、盐与碱、盐与盐等。
【对点练习】1.盐是一类常见的物质,下列物质通过一步反应可直接形成盐的是( )①金属单质 ②碱性氧化物 ③碱 ④非金属单质⑤酸性氧化物 ⑥酸A .①②③B .①④⑥C .②⑤⑥D .全部解析:选D 题中所列物质均可通过一步反应直接形成盐。

最新苏教版必修1《物质的转化》学案1-1-2.物质的转化【自学导航】学习目标:知识目标:1、巩固我们初中所学的化学反应类型。
2、了解物质的转化关系。
3、认识氧化还原反应及其与其它反应类型的特点。
能力目标:1、通过对于以前学习内容的梳理,建立关于化学反应的知识体系。
2、培养学生的归纳能力,知识的整合能力。
情感目标:1、通过互动式的教学,培养师生感情。
2、让学生思考、发言,表现,培养他们的求真科学素养和精神。
重点:物质的转化途径、物质的转化关系;氧化还原反应的认识难点:物质的转化途径、物质的转化关系;氧化还原反应的认识【学习过程】预习检测:1、单质、氧化物、酸、碱、盐之间有一定的反应关系,可以相互转化,请将下列各类物质按其之间的反应关系连线:2,化合物碱性氧化物碱酸性氧化物酸盐34、根据化学反应的特征(如参加反应的物质种类或种数),完成下表的填充。
5、氧化还原反应的特征6、氧化还原反应与四种基本反应类型的关系典型例题【例1】有钠、氢、氧、硫四种元素,试关于它们填写下列空白:(1)用其中的一种或几种元素写出符合下列要求的化学式:单质,氧化物,酸,碱,盐。
(2)写出上述物质间相互发生反应的化学方程式:单质与酸;酸与氧化物;碱与氧化物;酸与碱;单质与单质。
(3)又知潜水艇中需要配备氧气再生装置,利用过氧化钠(Na2O2)与二氧化碳反应生成碳酸钠和氧气,该反应的化学方程式为。
【变式1】现有下列五种物质:锌粒、硫酸锌、氢氧化锌、氧化锌、硫酸,试关于它们回答下列问题:(1)根据它们组成或性质的不同,把它们分成两大类。
(2)写出它们之间转化的化学方程式。
【变式2】按下列化学反应基本类型依次填入四个化学方程式,要求后一个反应的反应物必须含有前一个反应的生成物:分解反应:_______________________________________________________。
置换反应:_______________________________________________________。

基础课时2 物质的转化 化学反应的分类1.能通过观察和分析,辨识物质形态、物质性质及其变化的宏观现象,培养宏观辨识与微观探析的化学核心素养。
2.能从不同视角对物质及其变化进行分类,培养证据推理与模型认知的化学核心素养。
一、物质的转化1.以碳、钙两种元素的单质和化合物为例,按要求完成物质间的转化。
物质的转化反应 实例(化学方程式) 单质→化合物C +O 2=====点燃CO 2或2Ca +O 2===2CaO 碱性氧化物→碱CaO +H 2O===Ca(OH)2 酸性氧化物→酸CO 2+H 2O===H 2CO 3 酸→盐 Ca(OH)2+2HCl===CaCl 2+2H 2O2.物质转化中的常见反应类型(1)酸、碱、盐在溶液中发生复分解反应,通常有沉淀析出、气体放出或有水等物质生成。
例如:MgCl 2+2NaOH===Mg(OH)2↓+2NaCl 。
(2)酸性氧化物与碱性氧化物可以发生化合反应,生成盐类物质。
例如:CaO +CO 2===CaCO 3。
(3)排在金属活动性顺序表中氢前面的金属与稀盐酸(或稀硫酸)发生置换反应,生成氢气和盐。
例如:Mg +2HCl===MgCl 2+H 2↑。
3.无机化合物转化为有机化合物1828年,德国化学家维勒通过蒸发无机化合物氰酸铵(NH 4CNO)水溶液得到了尿素[CO(NH 2)2]。
尿素的合成揭开了人工合成有机化合物的序幕。
(正确的打“√”,错误的打“×”)(1)同类别物质之间的转化有相似性。
( )(2)通常条件下,碱性氧化物都可以与H 2O 反应生成相应的碱。
( )(3)化学反应中一定有物质的转化,物质的转化过程中一定发生化学反应。
( ) (4)有机物只能在自然界中合成,无法通过人工合成。
( )[答案] (1)√ (2)× (3)√ (4)×二、化学反应的分类1.基本反应类型 根据反应物、生成物的类别和数量,将化学反应分为化合反应、分解反应、置换反应和复分解反应等基本类型。


1物质的分类及转化【知识梳理】: 一、物质的分类世界上的物质极其繁多,为了简明有序地掌握其性质及变化规律,常采用的方法之一是进行 ①分类研究。
人们常根据物质的②组成、③状态、④性能等对物质进行分类。
1.根据物质的状态:物质分为⑤气态(g)、⑥液态(l)、⑦固态(s)。
2.根据物质的导电性:物质分为⑧导体、⑨半导体、⑩绝缘体。
3.可溶物 微溶物 难溶物 4.物质可以分为混合物和纯净物,纯净物可以分为单质和化合物,化合物可以分为无机化合物和有机化合物,无机化合物可分为 酸、 碱、 盐和氧化物。
二、物质间的转化1.化学反应的分类A+B AB 化合反应 AB A+B 分解反应 AB+C 置换反应 AB+CD 复分解反应 另外根据在反应前后物质所含元素的化合价是否发生改变,将化学反应分为氧化还原反应和非氧化还原反应。
2.酸性氧化物:能与 碱反应只生成盐和水的氧化物。
碱性氧化物:能与 酸反应只生成盐和水的氧化物。
【基础知识交流】1.中学所学习的化学知识中,常见的易溶物、微溶物、难溶物有哪些?2.纯净物具有相同的组成元素,具有相同组成元素的物质都是纯净物吗?3.氧化物是否只能分为酸性氧化物和碱性氧化物两种?4.有同学认为“氧化还原反应就是有氧元素参与的反应”,你认为这句话对吗? 【问题探究】 探究1:物质的分类B CH3COOH KHSO4SO2C NaHSO4NaHCO3SiO2D H3PO4K2CO3CO2已知Na2O2与盐酸反应生成氯化钠、水和氧气,则Na2O2是否为碱性氧化物?探究2:基本反应类型与氧化还原反应的关系已知有下列反应: ①SO3+H2O H2SO4②Cu(OH)2CuO+H2O③Fe2O3+3CO2Fe+3CO2④NaCl+AgNO3AgCl↓+NaNO3⑤Fe+2HCl FeCl2+H2↑(1)上述反应中属于氧化还原反应的是。
(2)指出上述反应各属于哪种基本反应类型?1.四大基本反应类型中哪些一定属于氧化还原反应?哪些一定不属于氧化还原反应?2.写出一个既属于氧化还原反应又属于化合反应的化学方程式。
第一单元物质的分类和转化一、学习目标1.知道化学科学的主要研究对象,知道化学是在分子层次上认识物质和合成新物质的一门科学。
2.初步认识物质的科学分类方法,学会从不同角度(尤其是物质的组成和性质角度)对常见物质进行分类。
认识分类等科学方法对化学研究的作用,能尝试运用比较、分类的方法对信息进行加工。
3.掌握四种基本反应类型,能根据化合价的变化判断是否氧化还原反应。
认识基本反应类型与氧化还原反应之间的关系。
4.了解化学家研究物质及其变化的方法和内容,体会化学的学科价值。
二、教学重点及难点物质的分类方法;物质之间的转化规律。
三、设计思路本课设计以“化学家眼中的物质世界”为切入口,通过故事激发学生从化学的角度去认识物质世界的兴趣,探讨物质的分类方法及不同物质之间的转化规律,并从不同角度对化学反应进行分类。
四、教学过程[导入]在同学们眼中,什么是化学?化学家们又是些什么样的人呢?在化学家眼中,物质世界是怎样的呢?我们都知道,巧克力是情人节的首选礼物,然而化学家却在思考:这是为什么呢?经研究,他们发现在巧克力中含有一些物质,食用后能令人产生愉悦的感觉,这样的氛围中,爱人更加可爱。
这就是为什么要送巧克力了。
再如臭脚丫,那种气味可不敢恭维,是什么物质如此难闻呢?化学家们研究发现,原来是一种叫做“硫醇”的物质作怪,硫醇的结构与我们学过的乙醇相似,只是其中的氧换成了硫。
化学家研究了硫醇,又利用其特殊的气味,将其少量添加到无色无味的煤气中去。
这样万一煤气泄漏,我们就能闻到其气味了。
这就是化学家眼中的物质世界。
他们绝不只是穿着白大褂,在一堆试管和烧杯中摆弄各种药品的人。
对于我们早已习惯的物质世界,化学家们总是保持着敏锐的洞察力和强烈的探索欲望,他们在分子、原子水平上研究物质的组成、结构、性质和变化规律。
下面,让我们以“化学家”的眼光来观察、认识、研究我们周围的物质世界,做好准备了吗?化学世界绚丽多彩,千姿百态,目前已知物质的种类超过千万种,每年还有大量新物质不断被合成出来。
物质的转化班级_______姓名_________学号_______[学习目标]1、理解单质、氧化物、酸、碱、盐等物质之间的相互转化关系。
2、从化合价升降的角度初步认识氧化还原反应。
[课前检测]1、请根据物质的组成、性质对下列物质进行分类。
NH4Cl、CO(NH2)2、NaH2PO4、SiO2、BaO、H3PO4、液态氧、NH4CNO、液氨、盐酸、CuSO4·5H2O2、⑴SO3属于酸性氧化物,请写出SO3与足量KOH溶液反应的化学方程式⑵Na2O属于碱性氧化物,请写出Na2O与硫酸反应的化学方程式;一、物质的转化[情景设计]在初中阶段我们已经学习了一些物质转化的知识。
如下表:这些物质间如何转化?并[能生成氯化钙。
请你尽可能多地写出图中物质之间转化的方程式,并将你的结果与同学交流讨论。
CaCO3CaO Ca(OH)2Ca CaCl2[知识归纳]化学反应的四种基本类型反应类型实例A +B == ABAB == A + BAB + C == A + CBAB + CD == AD + CB[概念形成]分类并没有唯一性,它会根据分类的标准不同而不同。
根据反应前后元素化合价是否发生改变可分为氧化还原反应和非氧化还原反应。
氧化还原反应:凡是的反应都是氧化还原反应。
[典型例题]①H2SO4 + CuO = H2O + CuSO4②H2 + CuO H2O + Cu③CO + CuO Cu + CO2④Fe + CuSO4 == Cu + FeSO4⑤Na2O + H2O = 2NaOH ⑥Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑⑦2KClO32KCl + 3O2⑧SiO2 + 2NaOH = Na2SiO3 + H2O在上述反应中,属于化合反应的有(填编号,下同),属于分解反应的有,属于复分解反应的有,属于置换反应的有,属于氧化还原反应的有。
[知识归纳]四类基本反应与氧化还原反应的关系[知识拓展]1、氧化剂:2、还原剂:3、氧化产物:4、还原产物:[情景设计]判断下面溶液中的化学反应能否发生①Cu + 2AgNO3 = 2Ag + Cu(NO3)2②Fe + 2HCl = H2↑ + FeCl2③K2SO4 + BaCl2 = BaSO4↓ + 2KCl ④Na2CO3 + H2SO4 = Na2SO4 + H2O + CO2↑⑤Cl2 + Na2S = 2NaCl + S ⑥CO2通入 BaCl2溶液中[知识归纳]复分解反应和置换反应的条件[当堂训练]1、下面物质混合能否反应?若能请写出化学反应方程式A.硝酸银溶液和氯化钠溶液混合B.氯化钡溶液和稀硫酸混合C.二氧化硫通入氯化钙溶液中D.氯化银与碳酸钾溶液混合2、下列物质间的转化能一步实现的是()A.Na2CO3→ NaOHB.CaCO3→ Ca(OH)2C.NaNO3→ NaClD.FeSO4→ CuSO43、用化学方程式表示制取MgCl2的可能方法。
专题1 化学家眼中的物质世界第一单元 丰富多彩的化学物质教学课题【必修Ⅰ】§1-1-1.物质的分类和转化(2)教学课时共2课时-第2课时教学目的知识目的1、稳固我们初中所学的化学反响类型2、理解物质的转化关系3、认识氧化复原反响及其与其它反响类型的特点才能目的1、通过关于往常学习内容的梳理,建立关于化学反响的知识体系2、培养学生的归纳才能,知识的整合才能情感目的1、通过互动式的教学,培养师生感情2、让学生考虑、发言,表现,培养他们的求真科学素养和精神教学重点物质的转化途径、物质的转化关系教学难点氧化复原反响得认识教学方法归纳探究法教具准备回忆初中学过的化学反响教学课件教学过程老师主导活动学生主体活动修正、备注引入:上节课我们所研究的是化学物质的分类方法,本节课我们来一起归纳物质的转化途径板书:物质的转化回忆上节课的内容咨询题处理:KOH属于碱,CO2、SO2属于酸性氧化物,请写出足量的KOH与CO2、SO2反响的化学方程式。
评述:略2KOH + CO2 = K2CO3 + H2O2KOH + SO2 = K2SO3 + H2O过渡:关于化学物质的转化,我们首先来看不同的类别的物质的转化引导讨论:1、举例说明P4表1-1物质间的转化单质→化合物碱性氧化物→碱酸性氧化物→酸考虑书写:(2个学生板演)交流与讨论分组讨论、归纳小结写出每组的转化类型中化学反响方程式。
讨论归纳写出每组对应的化学反响方程式。
CaCO3CaO Ca(OH)2Ca CaCl2完成左图表格Fe + CuSO4 = Cu + FeSO4请大家分析,该反响中哪些元素的化合价发生了变化。
给出:二、氧化复原反响:但凡有元素的化合价发生变化的反响即为氧化复原反响。
非氧化复原反响:但凡化学反响中元素的化合价没有发生变化的化学反响即为非氧化复原反响。
组织交流讨论:教材P6 交流与讨论归纳:氧化复原反响:1、2非氧化复原反响:3、4氧化复原反响与四类根本反响类型的关系:阅读介绍:化学史话---无机化合物转化为有机化合物给的化学反响哪些属于氧化复原反响,哪些是非氧化复原反响。
第一单元丰富多彩的化学物质第一课时物质的分类与转化[学习目标]1、掌握化学物质的分类方法,认识比较和分类等科学方法对化学研究的作用;2、学会从不同角度对常见物质进行分类。
3、理解单质、氧化物、酸、碱、盐等物质之间的相互转化关系。
4、从化合价升降的角度初步认识氧化还原反应。
[重难点]1、学会从不同角度对常见物质进行分类。
2、理解单质、氧化物、酸、碱、盐等物质之间的相互转化关系。
3、从化合价升降的角度初步认识氧化还原反应[课前检测]在我们的日常生活中,常会接触到下列物质:空气乙醇硫酸铵铜碘酒碘氢气石墨食盐水请你将上述物质进行分类,并说明分类的依据。
将你的分类结果与同学交流讨论。
1、根据通常的存在状态分类2、根据导电性能分类3、根据所含物质的种类分类4、根据组成纯净物是否为同种元素5、将物质分为无机物和有机物在上图中氧化物、酸、碱、盐等各类无机化合物我们能否进行更细致的划分?[学习过程]一、物质的分类[情景设计1]试写出下列化学反应方程式:CuO+H2SO4------ MgO+HCl------SO2+Ca(OH)2------- CO2+NaOH------[概念形成]1、碱性氧化物:能与________反应生成_______和_______的____________。
2、酸性氧化物: 能与_______反应生成_________和_____的____________。
[友情提示]金属氧化物、非金属氧化物与碱性氧化物、酸性氧化物有什么关系?[知识拓展]1、两性氧化物:。
2、不成盐氧化物:如。
3、酸酐:含氧酸失水后的生成物,如H2CO3的酸酐是CO2[情景设计2] HCl、H2SO4、H3PO4、H2S、HF、HNO3能否进一步分类呢?[归纳][情景设计3] NaOH、Ca(OH)2、Fe(OH)3、Ba(OH)2能否进一步分类呢?[归纳][情景设计4]NaCl、NaHCO3、Cu2(OH)2CO3、KAl(SO4)2能否进一步分类呢?[归纳][典型例题]下列每组物质中都有一种物质与其它物质在分类方法上不同,试分析每组中物质的组成规律,将这种不同于其它物质的物质找出来,用横线划出。
物质的转化
【学习目标】
1.掌握四种基本反应类型,能根据化合价的变化判断是否氧化还原反应。
2.认识基本反应类型与氧化还原反应之间的关系。
3. 能尝试运用比较、分类的方法对信息进行加工。
4. 了解化学家研究物质及其变化的方法和内容,体会化学的学科价值。
【重点与难点】物质之间的转化规律。
【学习过程】
一.物质的转化
[交流与讨论]
①完成下表所列的物质的转化类型,并将你知道的其他的转化类型补充到表中。
物质的转化类型化学方程式
单质化合物
碱性氧化物碱
酸性氧化物酸
酸盐
②请你尽可能多的写出表示图1-3中物质之间转化的化学方程式,并与同学
交流讨论。
根据化学反应的特点,我们也可将化学反应分为不同的反应类型来研究。
[整理与归纳]根据化学反应的特征,完成表1-4的填充。
[过渡]写出一氧化碳还原氧化铁的方程式,它属于那种基本反应类型呢?二.化学反应的分类
根据化合价是否变化
例题:判断下列反应哪些是氧化还原反应
2H2+O2=2H2O CaO+CO2=CaCO3 CaCl2=Ca+Cl2↑ CaCO3=CaO+CO2↑ Zn+H2SO4=ZnSO4+H2↑ Fe+2HCl=FeCl2+H2↑ NaOH+HCl=NaCl+H2O KCl+AgNO3=AgCl↓+KNO3
【讨论】基本反应类型与氧化还原反应的关系。
课时练习
班级:学号:姓名:
1、常温下,某反应M + N →盐 + 水,其中M、N的类别不可能是
A. 酸、碱
B.单质、氧化物
C.氧化物、酸
D.氧化物、碱
2、复分解反应不能生成的物质是
①单质②氧化物③酸④碱⑤盐
A、①②
B、②④
C、③⑤
D、①
3、下列有关酸、碱、盐的说法中,错误的是
A. 酸根中可能含有氧元素
B. 盐中可能含氢元素
C. 碱中一定含有氢元素和氧元素
D. 盐和碱中一定含有金属元素
4、在AgNO3、KNO3和Cu(NO3)2的混合溶液中,加入一定量的铁粉充分反应后,过滤、洗涤,
将滤渣放入盐酸中有气泡产生,则滤液中存在的阳离子可能是
A.Cu2+
B.只有Fe3+
C.只有Fe2+
D.K+、Fe2+
6、严冬我国北方某些城市曾用食盐融雪,造成土壤中含盐浓度偏高,使路旁树木死亡。
目前专家已研究出一种新型融雪剂,既能融化冰雪,又能起施肥养护树木的作用。
具有上述作用的新型融雪剂是
A. 氯化钠氯化钙
B. 氯化钠氯化镁
C. 氯化钠醋酸钙镁 D尿素硝酸钙硝酸镁
7、在一定条件下,下列转化不能由一步反应实现的是
A.CO→CaC03
B.HCl→NaCl
C.Fe→FeSO4
D.Ca(OH)2→NaOH
8、泉州是白蚂蚁的高发地区,白蚂蚁会蛀蚀木头,它分泌的蚁酸是一种酸,还能腐蚀很
多建筑材料。
下列建筑材料最不容易被白蚂蚁腐蚀的是
A.钢筋B.铜制品 C.大理石 D.铝合金
9、某同学为了确定Fe、Cu、Hg三种金属的活动性顺序,用铁片、铜片、硝酸汞溶液和盐
酸四种试剂设计了下列实验方案,其中可行的是
A.Fe+HCl Cu+HCl Fe+Hg(NO3)2
B.Fe+HCl Fe+Hg(NO3)2 Cu+Hg(NO3)2
C.Fe+HCl Cu+HCl Cu+ Hg(NO3)2
D.Cu+HCl Fe+Hg(NO3)2 Cu+ Hg(NO3)2
10、将少量的生石灰加到一定质量的饱和石灰水中,溶液的温度升高,再恢复到室温(不
考虑水的蒸发)。
下列四位同学对变化后溶液的分析错误
..的是。