医疗器械飞行检查情况汇总表
- 格式:doc
- 大小:73.00 KB
- 文档页数:18

2023
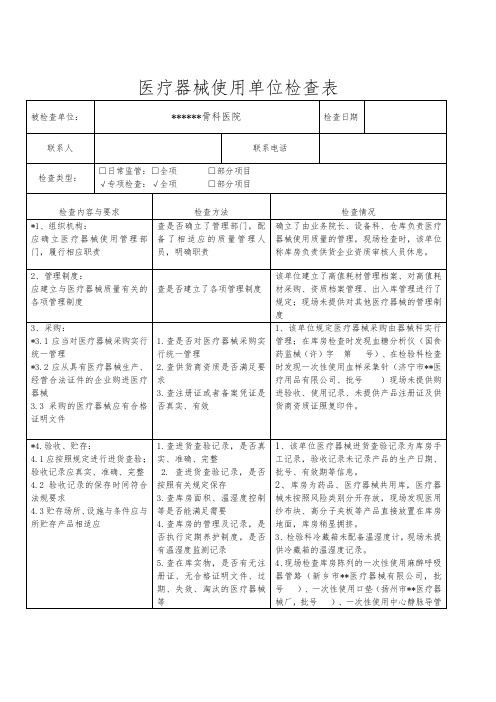
序号被检查
单位
品种省份检查发现问题备注
1 湖南海普
明科技有
限公司
软性亲
水接触
镜
湖南
检查发现一般不符合项12项。
一、机构和人员方面
1.进入十万级洁净车间的人员更衣流程未明确是否需要戴手套,实际对
进入车间的检查组人员要求不一致,从女更进入人员要求戴手套,从男更进
入人员未要求。
二、设备方面
2.提纯车间旋转蒸发器清洗记录中未记录设备编号;PP杯包装机的硅胶
管未规定更换周期,未建立更换记录;萃取车间的萃取柜舱门不严密,工作
时有蒸汽漏出。
3.旋转蒸发器的真空表未计量检定,检验室使用的滴定管没有检定标
识。
提纯车间的电子计重秤的操作规程中未规定使用前校验。
三、文件管理方面
不符合
项目整
改已完
成。

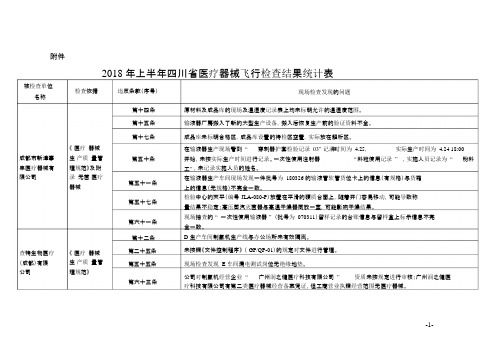
附件被检查单位2018 年上半年四川省医疗器械飞行检查结果统计表检查依据违反条款(序号)名称第十四条第十五条现场检查发现的问题原材料及成品库的现场及温湿度记录表上均未标明允许的温湿度范围。
输液器厂房搬入了新的大型生产设备,搬入后恢复生产前的验证资料不全。
《医疗器械第十七条成品库未标明合格区,成品库设置的待检区空置,实际放在解析区。
在输液器生产现场看到“穿刺器护套检验记录03”记录中时,间为 4.25,实际生产时间为 4.24 18:00成都市新津事丰医疗器械有限公司查特生物医疗(成都)有限公司生产质量管理规范》及附录无菌医疗器械《医疗器械生产质量管理规范》第五十条第五十一条第五十七条第六十一条第十二条第二十五条第五十五条第六十三条开始,未按实际生产时间进行记录。
一次性使用注射器“料粒使用记录” ,实施人员记录为“粉料工” ,未记录实施人员的姓名。
在输液器生产车间现场发现一件批号为180326 的输液管软管货位卡上的信息(有规格)与货箱上的信息(无规格)不完全一致。
检验中心的天平(编号JLA-080-P)放置在平滑的硬质台面上,随着开门容易移动,可能导致称量结果不稳定;高压蒸汽灭菌器与高温干燥器同放一室,可能影响干燥结果。
现场抽查的“ 一次性使用输液器” (批号为070311)留样记录的台账信息与留样盒上标示信息不完全一致。
D 生产车间制氧机生产线与办公场所未有效隔离。
未按照《文件控制程序》(GP/QP-01)的规定对文件进行管理。
现场检查发现 E 车间漏电测试岗位无绝缘地垫。
公司对制氧机经营企业“广州润之健医疗科技有限公司”资质未按规定进行审核:广州润之健医疗科技有限公司有第二类医疗器械经营备案凭证,但工商营业执照经营范围无医疗器械。
-1-四川省广元市《医疗器械生产质量管第十七条第二十七条仓储区未按照待验、合格、不合格、退货或召回等进行有序、分区存放各类材料和产品,以便于检查和监控。
在灭菌环节的原始记录中,使用热敏纸作为原始数据载体,不符合法规要求的“记录保存期限至少相当于生产企业规定的医疗器械的寿命期”的要求。
2021
序号被检查
单位
品种省份检查发现问题备注
1 江西国康
实业有限
公司
医用一
次性防
护服、红
外额温
计
江西
检查发现一般不符合项4项。
一、机构与人员方面
1.查看质量部负责人任职资格要求并现场询问,质量部经理晏某兼任销
售市场相关工作,不熟悉医疗器械相关法律法规和标准以及质量体系管理工
作。
二、文件管理方面
2.部分文件未及时修订。
如《医用一次性防护服成品检验规程》中规定
逐批检验项目未包括无菌检验项目,而成品检验报告里有无菌检验项目,检
验规程与检验报告不符;手提式不锈钢压力蒸汽消毒器的使用与《手提式不
锈钢压力蒸汽消毒器操作规程》的操作说明不符;未及时修订或更新《质量
手册》,企业提供了两份《管理者代表任命书》。
其中先任命的王某任命书收
录在现行版本《质量手册》中,但后任命的陈某任命书未收录。
三、设计开发方面
3.医用一次性防护服贴条工序的工艺参数温度、速率,红外额温计关键
工序校准调试的温度发生变更,企业未对设计开发更改(工艺参数变更)进
行识别并保持记录。
四、生产管理方面。